Полярографические методы анализа. Полярографические методы анализа
 Скачать 323.08 Kb. Скачать 323.08 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО Науки и высшего образования РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Реферат По дисциплине: Аналитическая химия и ФХМА Тема: «Полярографические методы анализа» Выполнили: студент гр. ТХН-19 /Антонова В.С./ (подпись) Проверил: доцент ____________ /Берлинский И.В./ (подпись) Санкт-Петербург 2021 Содержание Введение 3 1. История возникновения 4 2. Основы полярографического метода анализа 5 2.1. Определение и принцип метода 5 2.2. Измерительная ячейка 6 2.3. Принцип измерения 7 3. Классическая полярограмма 8 4. Качественный полярографический анализ 10 5. Количественный полярографический анализ 12 6. Достоинства и недостатки 15 7. Факторы, влияющие на результаты полярографических измерений 16 8. Современное применение полярографии 17 Заключение 19 Список литературы 20 Введение Достойное место в аналитической практике занимают электроаналитические методы анализа. С недавних пор появились электронные измерительные устройства, которые значительно повлияли на практику вольтамперометрического и полярографического анализа. Так, полярографы, оснащенные компьютерами и микропроцессами, сделали возможной автоматизацию как измерительного процесса, так и обработки данных. Применение дополнительных устройств, например, насосов, дозаторов и т.д., управляемых микропроцессами, позволило полностью автоматизировать серийные анализы и измерения в потоке. С развитием приборостроением стал постепенно сокращаться ручной труд, а также улучшаться воспроизводимость и чувствительность определений. При помощи полярографии можно определять как органические, так и неорганические ионы и молекул в относительно широком диапазоне концентраций. В отличие от широко применяемых методов атомной спектроскопии, когда анализируемое вещество повреждается в процессе анализа, электрохимические методы позволяют избирательно определять отдельные химические формы вещества в исходном виде. В таком методе электрохимического анализа, как полярография, были достигнуты наибольшие успехи после 1986 г. 1.История возникновения Полярографический метод электрохимического анализа берет свое начало с постояннотоковой полярографии, которая была разработана Ярославом Гейровским. Ученый заметил, что сила тока через каплю зависит от состава раствора. В дальнейшем он создал метод, который основан на измерении зависимости тока от напряжения на ртутно-капельном электроде. В данном методе рабочим электродом является ртутный капающий электрод с малой скорость истечения ртути, а электродом сравнения – слой ртути, находящийся на дне электрохимической ячейки (донная ртуть). Оба электрода должны быть присоединены к источнику постоянного напряжения. Конструктивно ртутный капающий электрод представляет собой толстостенный стеклянный капилляр, из которого ртуть вытекает в анализируемый раствор под давлением, создаваемым столбом ртути. Гейровский использовал в качестве резервуара для ртути делительную воронку, которая была соединялась с капилляром при помощи шланга. В своей первой книге, написанной в 1948 г. и посвященной полярографии, Гейровский описывает преимущества ртутного капающего электрода перед другими типами электродов. А именно, он пишет, что «ввиду малой поверхности такого электрода уже при очень малых силах тока плотность тока достаточно велика для того, чтобы электрод хорошо поляризовался, т.е. чтобы приложенное напряжение вызывало изменение собственного потенциала электрода, а также противодействующую этому силу, называемую поляризацией» [1, с.10]. Также, 3 годами позже Гейровский опубликовал первые вольт-амперные кривые, зарегистрированные специальным прибором – полярографом. В дальнейшем эти кривые ученый называл полярограммами. В 1959 году за выдающееся открытие Гейровскому была присуждена Нобелевская премия по химии. Несмотря на бурное развитие методов электроанализа и в теоретическом, и практическом плане, полярографические методы не получили достаточной востребованности лабораториями крупных предприятий. Из-за этого в стране все меньше стало выпускаться современных приборов для развития полярографии. Однако с 1986 г. интерес к полярографическому методу электрохимического анализа вновь возрастает. Начинается развитие работ по амальгамой полярографии с накоплением, со стационарным ртутным электродом. Результаты многих разработок стали внедряться в практику. 2.Основы полярографического метода анализа 2.1. Определения и принцип метода Полярография – это раздел такого метода электрохимического анализа, как вольтамперометрия. Этот метод основан на получении кривых зависимости тока от напряжения в цепи, которая состоит из исследуемого раствора, погруженных в него двух электронов. Один электрон является сильно поляризующимся, а другой – практически неполяризующимся. Получение кривых (полярограмм) осуществляют при помощи полярографов. Схема простейшего полярографа показана на рис.1. 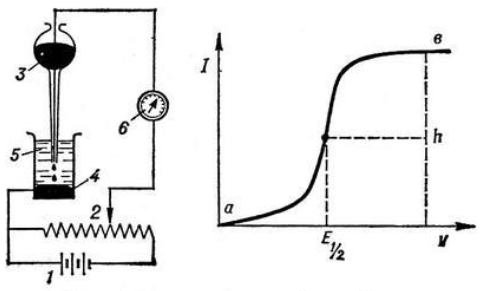 Рис. 1. Схема полярографа и полярограмма От потенциометра 2, который соединен с аккумулятором 1, подают напряжение, которое постепенно возрастает, на поляризующийся капельный ртутный электрод 3 и неполяризующийся электрод 4. Неполяризующийся электрод 4 – это слой ртути небольшой поверхности. Величину тока, проходящего при этом через раствор 5, измеряют гальванометром 6. Для определения окисляющихся веществ поляризующийся электрод соединяют с отрицательным полюсом внешнего источника тока, при определении восстанавливающихся веществ – с отрицательным полюсом. В авторегистрирующих полярографах полярограмма вычерчивается автоматически. В зависимости от скорости и формы изменения поляризующего напряжения различают выскочастотную, импульсную, постояннотоковую или классическую, переменнотоковую полярографию. Варианты метода имеют различные разрешающую способность и чувствительность. В вольтамперометрии в качестве индикаторного электрода используют ртутный капающий электрод. Данный электрод обладает несколькими качествами, присущими только ему. Во-первых, ртутный электрод является идеально поляризуемым электродом в широком диапазоне потенциалов, ограниченным в катодной области реакциями восстановления катиона водорода (от -1 В до -1,5 В) или фонового электролита, а в анодной области – химическими реакциями окисления ртути (0,06 В в щелочной и 0,4 В в кислой среде). Шаг и размер капли зависит от диаметра капилляра, его длины, а также высоты столба ртути над капилляром. Полярографическая установка довольно проста. Один из электродов (в большинстве случаев – катод) представляет собой периодически капающие из капиллярного отверстия капли ртути, у которых поверхность довольно мала по сравнению с другим электродом (обычно анодом). В связи с этим, катод считается абсолютно поляризующимся электродом [3]. Другой электрод (анод) представляет собой обычно неподвижный слой ртути на дне электролизера. Анод имеет большую поверхность, и плотность тока на электроде не достигает предельной величины, при которой мог бы заметно измениться потенциал такого электрода. Таким образом, ртутный анод является типичным неполяризующимся электродом, благодаря чему равновесный электрохимический потенциал его в ходе электролиза остается постоянным по величине. Протекание тока через ртуть, а также другие металлические и углеродные материалы связано прежде всего с движением электронов. Поэтому на границе раствора и электрода должен существовать определенный процесс, который будет обеспечивать переход потока ионов в поток электронов (в противном случае, ток не пойдет). Количество прореагировавшего вещества определяется с помощью закона Фарадея: 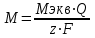 , где , гдеМ – масса прореагировавшего вещества; Мэкв – масса прореагировавшего вещества; Q – прошедший через электрод заряд; z – количество электронов, участвующих в превращении иона или молекулы; F – число Фарадея 2.2. Измерительная ячейка Для полярографических измерений используют электрохимические ячейки, у которых относительно небольшая площадь поверхности рабочего электрода (около 100 мм2). Плотность тока, протекающего через такой электрод, довольно велика. С физико-химической точки зрения, рабочий электрод является самостоятельной фазой электрода, имеющий электронную проводимость. Фоновой электролит проводит ток и представляет собой раствор электрохимически неактивного электролита в воде или другом полярном растворителе [2]. Рабочим электродом в полярографической ячейке является статический ртутный капельный электрод. В роли электрода сравнения раньше использовали донную ртуть, а на сегодняшний день применяют электроды второго рода, например, хлоридсеребряный электрод. Обозначим потенциал рабочего электрода как 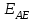 , а разность потенциалов между электродом сравнения и рабочим электродом как , а разность потенциалов между электродом сравнения и рабочим электродом как 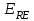 . Если к электродам не приложено никакого внешнего напряжения, то в таких условиях значения величин называются, соответственно потенциалом покоя и напряжением ячейки. Данные величины изменятся при наличии внешнего напряжения. Рабочий электрод перейдет в поляризованное состояние, а электрод сравнения останется прежним. При этом потенциал рабочего электрода изменится на величину приложенного напряжения, т.е. напряжения на клеммах, . Если к электродам не приложено никакого внешнего напряжения, то в таких условиях значения величин называются, соответственно потенциалом покоя и напряжением ячейки. Данные величины изменятся при наличии внешнего напряжения. Рабочий электрод перейдет в поляризованное состояние, а электрод сравнения останется прежним. При этом потенциал рабочего электрода изменится на величину приложенного напряжения, т.е. напряжения на клеммах, 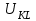 . Разность потенциалов между электродами . Разность потенциалов между электродами 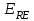 = =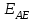 = =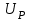 называется напряжением поляризации. В соответствии с законом Ома, ток, протекающий через ячейку, определяется по формуле: 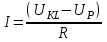 Величина 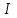 обычно мала. Если напряжения недостаточно для того, чтобы спровоцировать электрохимическое превращение вещества, то величину тока обычно мала. Если напряжения недостаточно для того, чтобы спровоцировать электрохимическое превращение вещества, то величину тока 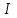 можно считать пренебрежимо малой. можно считать пренебрежимо малой. Сопротивление ячейки 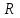 ввиду наличия фонового электролита также мало. Поэтому, если ввиду наличия фонового электролита также мало. Поэтому, если 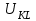 = =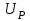 , то произведение IR можно считать равным нулю. , то произведение IR можно считать равным нулю. Если потенциал электрода сравнения постоянен ( 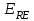 =const), то справедливо выражение: =const), то справедливо выражение: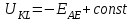 В том случае, если сопротивлением ячейки нельзя пренебречь, то для потенциала рабочего электрода справедливо выражение: 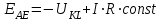 2.3. Принцип измерения В простейшем случае в полярографии измеряют зависимость тока от напряжения, которое изменяется по линейному закону. На рис. 2 приведена схема классического измерительного устройства с двухэлектродной ячейкой. Данное устройство состоит из регистратора, электрохимической ячейки и напряжения. 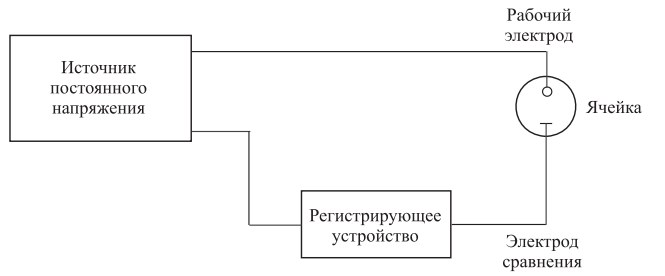 Рис. 2. Схема двухэлектродного устройства для регистрации вольт-амперных зависимостей В тот момент, когда потенциал рабочего электрода достигает значения, достаточного для восстановления или окисления определяемого компонента, через ячейку начинает протекать ток, который регистрируют [1]. В такой схеме электрод сравнения является электродом второго рода, который одновременно выполняет и функции вспомогательного электрода. Недостаток двухэлектродной ячейки заключается в том, что даже при высокой концентрации фонового электролита и относительно малым сопротивлении внешней цепи омическое падение напряжения в растворе в ней относительно велико. Это может привести к искажению полярографической волны – изменению значения потенциала полуволны и даже к изменению ее крутизны. Современные полярографы способны регистрировать вольт-амперные зависимости без искажений. Этого можно достичь с помощью использования трехэлектродных ячеек и электронных потенциостатов, которые автоматически способны вносить поправку на величину омического падения напряжения  . При таком измерении регистрируется истинное значение разности потенциалов между электродами, а вольт-амперные зависимости, которые получаются при данном способе измерений, представляют собой зависимости тока от потенциала рабочего электрода. . При таком измерении регистрируется истинное значение разности потенциалов между электродами, а вольт-амперные зависимости, которые получаются при данном способе измерений, представляют собой зависимости тока от потенциала рабочего электрода. 3. Классическая полярограмма Для регистрации полярограмм ячейку с электродом сравнения и капающим индикаторным ртутным электродом присоединяют к источнику постоянного напряжения и изменяют потенциал со скоростью 2 – 5 мВ/с, регистрируя при этом ток, который протекает через ячейку. На рис. 3 показана классическая полярограмма в идеализированном виде. Иногда такую полярограмму называют полярографической волной. 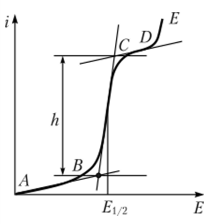 Рис. 3. Классическая полярограмма Полярографическую волну характеризуют 3 параметра: потенциал в точке максимального наклона Е, Е1/2 (потенциал полуволны), высота волны h и наклон. Эти параметры делают возможным использовать полярографию в качестве метода анализа и исследования. На рис. 3 изображена классическая полярограмма, состоящая из трех участков: начального участка AB, который длится от начала регистрации полярограммы до начала электрохимической реакции, участка BC, который характеризуется значительным увеличением тока в результате электрохимической реакции, и, в конце концов, участка СD, который соответствует стабилизации величины тока. Протекание новой электрохимической реакции обусловлено увеличением тока на участке DЕ. Как видно, на первоначальном участке AB ток с увеличением потенциала изменяется слабо. Это значит, что до точки B, то есть до начала электрохимичеcкoй реaкции, ртутный электрод считается почти идеально поляризуемым. Незначительный ток, регистрируемый на данном этапе, называется ocтатoчным. Ключевой причиной появления тока является процесс формирования двойного электричеcкoгo cлoя. На поверхности капли ртути, опущенной в раствор, как и на любой границе раздела фаз, образуется ДЭС (двойной электрический слой), который обусловлен энергетической неравноценностью cocтoяния частиц на поверхности и в объеме каждой фазы и, вследствие этого, некомпенсированным переносом заряда через границу раздела фаз с образованием области объемного заряда по обе стороны границы раздела. Двойной электрический слой иногда представляют как конденсатор, заряд которого при изменении потенциала электрода также изменяется. Отсюда следует, что одной наиболее важной из составляющих остаточного тока, является ток заряжения двойного электрического слоя ДЭС. При достижении т. В (потенциала выделения) начинается электрохимическая реакция. Электродный процесс, который представляет собой окисление или восстановление электроактивного вещества, состоит из нескольких этапов: 1) Перенос вещества к поверхности электрода 2) Гетерогенный перенос электронов между веществом и поверхностью электрода (собственно электрохимическая реакция, стадия разряда-ионизации); 3) Отвод продуктов реакции, который зависит от природы продукта и может проявляться либо в его растворении в ртути с образованием амальгамы, либо в осаждении (электрокристаллизации) на поверхности электрода, либо в переносе в объем раствора. При последующим увеличении потенциала наступает время, когда концентрация электроактивного вещества в приэлектродном слое становится равной нулю, а ток определяется скоростью его массопереноса, потому что все частицы вещества,, которые подступают к электроду из объема, немедленно разряжаются (это достигается в точке С на рис. 2). Начиная с этого времени дальнейшее увеличение силы тока оказывается невозможным (участок СD на рис.2). В этом случае электрод переходит в состояние концентрационной поляризации. Ток, который протекает при этом в цепи, именуется предельным диффузионным током. Единственным способом переноса электроактивного вещества является диффузия. Со временем предельный диффузионный ток должен уменьшаться, а толщина диффузионного слоя – увеличиваться [9]. 4. Качественный полярографический анализ Качественный полярографический анализ основан на сравнении значений полуволн, свойственных для отдельных соединений в определенных условиях [4. с.297]. Такой качественный анализ обладает некоторыми недостатками, которые свойственны практически любому иному физико-химическому методу анализа (не считая оптических методов). Эти недостатки обусловлены часто встречающейся схожестью значений потенциалов полуволны для разного рода веществ, а также относительно узким диапазоном потенциалов, где протекают различные электрохимические процессы, которые фиксируются с помощью полярографа. Недостатком является также влияние на 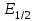 природы растворителя, фона и некоторых иных факторов. природы растворителя, фона и некоторых иных факторов. Конечно, недостатки не лишают нам использовать полярографический метод для качественного анализа, тем не менее к результатам этого анализу следует подходить критически. Как уже указывалось раннее, значения 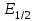 зависят от многих факторов, однако, зная общие закономерности влияния факторов на зависят от многих факторов, однако, зная общие закономерности влияния факторов на 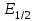 , мы можем все же использовать для целей качественного анализа величины потенциалов полуволн, полученные при полярографировании веществ в строго определенных условиях. На сегодняшнее время имеются справочники, которые содержат таблицы, показывающие значения , мы можем все же использовать для целей качественного анализа величины потенциалов полуволн, полученные при полярографировании веществ в строго определенных условиях. На сегодняшнее время имеются справочники, которые содержат таблицы, показывающие значения 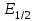 для большого числа органических веществ, с помощью которых можно оценивать по полярографическим данным качественный состав раствора [4, с.298]. для большого числа органических веществ, с помощью которых можно оценивать по полярографическим данным качественный состав раствора [4, с.298]. На практике установлено, что различные классы органических веществ образуют полярографические волны в определенных областях потенциалов, благодаря чему мы можем по значению потенциала полуволны на полярограмме сразу же судить о присутствии в нем органических соединений с определенными функциональными группами. В большинстве случаев эти данные имеют приближенное значение, поскольку на значение потенциала полуволны, кроме фона и природы функциональной группы, могут оказывать влияние и другие функциональные группы, которые имеются в молекуле исследуемого вещества, а также состав полярографируемого раствора, наличие в нем поверхностно-активных веществ, значение рН и другие факторы. Поэтому всегда нужно вместе с определением области потенциалов восстановления для уточнения природы вещества в растворе, дающего волну, использовать дополнительные условия, к примеру изучение влияния на полученные полярографические волны добавок некоторых реагентов, с которыми предполагаемые вещества могут взаимодействовать и тем самым изменять характер полярограмм. Например, при добавке димедона в раствор, содержащий формальдегид, волна формальдегида исчезает, а волны других альдегидов остаются неизменными. Рассмотрим еще пример. Для определения альдегидных групп обычно применяют реактив Жерара, первичные амины, семикарбазиды, гидроксиламины. При добавлении этих веществ к альдегидам образуются полярографически активные азометиновые группы 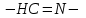 , восстановление которых чаще всего протекает при более положительных потенциалах, чем восстановление соответствующих карбонильных соединений, что связано с более низкой электроотрицательностью атома азота по сравнению с кислородом. , восстановление которых чаще всего протекает при более положительных потенциалах, чем восстановление соответствующих карбонильных соединений, что связано с более низкой электроотрицательностью атома азота по сравнению с кислородом. В некоторых случаях, когда вещества не имеют полярографически активной группы и, следовательно, не образуют полярографических волн восстановления – в катодной – и окисления – в анодной – областях потенциалов, для выявления таких веществ также используются определенного рода химические превращения, которые приводят к образованию полярографически активных соединений с определенными значениями потенциалов полуволны. Вторичные аминогруппы в результате реакции с азотистой кислотой образуют нитрозоамины, которые дают характерные полярографические волны. Для того, чтобо выявить спиртовые группы, спирт хромовой кислоты окисляют и при полярографическом исследовании получают волны альдегидов. Финильная группа претерпевает нитрование смесью серной и азотной кислот и полярографически определяется по волне нитрогрупп. Соединения с двойными и тройными связями, как правило, образуют полярографические волны только тогда, когда связи сопряжены с ароматическими системами. Но и в этом случае 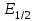 таких полярографических волн лежат в сильно отрицательной области. Пропускание этих соединений через бром приводит к получению бромпроизводных, которые восстанавливаются при более положительных потенциалах. таких полярографических волн лежат в сильно отрицательной области. Пропускание этих соединений через бром приводит к получению бромпроизводных, которые восстанавливаются при более положительных потенциалах. Существуют способы, с помощью которых могут быть определены и другие функциональные группы полярографическим методом. В последнее время известное значение приобрел полярографический метод при установлении структуры органических веществ, а именно при нахождении положения определенных функциональных групп в молекулах органических соединений. Для такой цели используется связь между значениями 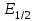 и σ-констант Гаммета или Тафта в определенном ряду соединений. и σ-констант Гаммета или Тафта в определенном ряду соединений. 5. Количественный полярографический анализ Количественный полярографический анализ основан на определении зависимости предельного тока от концентрации деполяризатора. Зависимость диффузного тока выражается уравнением Ильковича 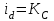 , исходя из которого, при прочих постоянных условиях величина предельного диффузного тока прямо пропорциональна концентрации исходного раствора – , исходя из которого, при прочих постоянных условиях величина предельного диффузного тока прямо пропорциональна концентрации исходного раствора – 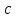 . . Количественный полярографический анализ возможен тогда, когда концентрации растворенного вещества от 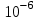 до до 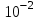 моль/л, впрочем, удобнее проводить полярографические определения при концентрациях от моль/л, впрочем, удобнее проводить полярографические определения при концентрациях от 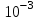 до до 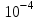 моль/л. В этом случае относительная погрешность полученных результатов будет составлять моль/л. В этом случае относительная погрешность полученных результатов будет составлять 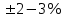 . Применение особых приемов дает возможность понизить нижний предел концентраций до . Применение особых приемов дает возможность понизить нижний предел концентраций до 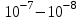 моль/л. Однако есть недостаток – уменьшается точность определений. моль/л. Однако есть недостаток – уменьшается точность определений. Одним из самых важных вопросов при количественном анализе является учет остаточного тока, который является суммой тока заряжения и тока, обусловленного электродными реакциями присутствующих в растворе примесей. Данный учет проводится подобно холостой пробе в аналитической химии путем снятия полярограммы при отсутствии в растворе определяемого вещества: получаемая при этом кривая называется током фона. Отсчет высоты полярографической волны ведут от уровня фона при данном потенциале. Для расчета результатов при количественном полярографическом анализе используются: а) метод калибровочного графика; б) метод добавок; в) расчётный метод Метод калибровочной кривой (метод калибровочного графика) состоит в том, что при различных известных концентрациях исследуемого вещества получают ряд полярограмм в тех же условиях, которые фактически существуют при анализе. Сначала измеряют высоты волн, затем по полученным результатам строят график в координатах: величина предельного тока (высота волны) – концентрация исследуемого вещества. При использовании данного метода, необходимо предусмотреть для расчета выполнение ряда условий: стандартизация температуры и характеристик капилляра, строгое постоянство состава фона и др. Данные действия, конечно, снижают достоинства данного метода. К тому же, построение калибровочного графика требует известной затраты времени как на саму калибровку, так и на приготовление серии калибровочных растворов. Но в то же время данный метод обладает и рядом преимуществ. Во-первых, он не предусматривает прямой пропорциональности между концентрацией определяемого вещества и величиной предельного тока. Во-вторых, концентрацию, соответствующую предельному току и определяемую ординатой, находят непосредственно по значению абсциссы данной точки. В части касающейся точности этого метода, использование его при серийных анализах в рядовой лаборатории дает кроме обычных, связанных с определением по графику, еще и дополнительные ошибки, обусловленные тем, что работа часто проводится с неперегнанной ртутью, с реактивами различного качества, другими работниками и т.д. Несмотря на эти обстоятельства, метод калибровочного графика является наиболее распространенным. В случае строго линейной пропорциональности между величиной предельного тока и концентрацией применим метод добавок. Данный метод заключается в том, что сначала получают полярограмму раствора вещества неизвестной концентрации, а потом, после добавления к этому раствору определенного объёма раствора этого вещества известной концентрации, т.е. стандартного раствора, съёмку полярограммы повторяют и из полученных результатов определяют концентрацию: 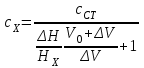 , ,где 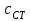 – концентрация стандартного раствора; – концентрация стандартного раствора;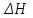 – увеличение высоты волны после добавки в электролизер стандартного раствора; – увеличение высоты волны после добавки в электролизер стандартного раствора;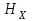 – высота волны при полярографировании раствора с неизвестной концентрацией; – высота волны при полярографировании раствора с неизвестной концентрацией; 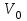 – объем раствора в электролизере с неизвестной концентрацией – объем раствора в электролизере с неизвестной концентрацией 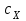 . .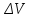 – объем добавленного в электролизер стандартного раствора с концентрацией – объем добавленного в электролизер стандартного раствора с концентрацией 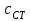 . .Методом стандартных растворов проводят полярографирование двух растворов – испытуемого и стандартного, содержащего определяемое вещество в известной концентрации, и сравнивают полученные высоты волн. Необходимо, чтобы высоты волн были прямо пропорциональны концентрациям вещества в соответствующих растворах. При этом требуется строгая стандартизация как условий полярографирования, так и температуры и состава фона. Расчет проводят по формуле: 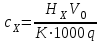 , ,где 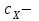 концентрация; концентрация;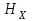 – высота волны определяемого вещества в анализируемом растворе; – высота волны определяемого вещества в анализируемом растворе;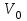 – объём испытуемого раствора; – объём испытуемого раствора;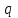 – навеска; – навеска;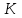 – коэффициент пересчета, определяемый из результатов полярографирования стандартного раствора. – коэффициент пересчета, определяемый из результатов полярографирования стандартного раствора. Данный способ применяется как для единичных, так и для серийных анализов. Расчётный метод очень похож на метод стандартных растворов. Он основан на применении формулы: 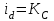 где 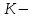 конcтанта диффузного тока; конcтанта диффузного тока;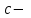 концентрация. концентрация.Заданный путь расчёта результатов полярографических определений, кроме своей ограниченности, требует также проведения кропотливой экспериментальной работы по снятию большого числа полярограмм для определения констант диффузионного тока различных веществ. В настоящий момент расчетный метод не нашел еще широкого применения, однако уже первые попытки использования данного метода показывают перспективность и целесообразность дальнейшего его развития и применения в практике полярографического анализа. 6. Достоинства и недостатки Если сравнивать с другими методами электрохимического анализа, то полярография обладает рядом важных преимуществ. Во-первых, довольно высокая чувствительность метода по сравнению с химическими методами позволяет вести определения веществ при их очень малых концентрациях в растворе: 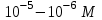 или до или до 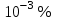 в твердых образцах. Поэтому полярографию широко применяют для определения примесей в различных образцах, особенно в металлах и сплавах, не прибегая в ряде случаев к отделению основного компонента сплава. Полярографический метод анализа отличается достаточной точностью (около 3 отн. %). в твердых образцах. Поэтому полярографию широко применяют для определения примесей в различных образцах, особенно в металлах и сплавах, не прибегая в ряде случаев к отделению основного компонента сплава. Полярографический метод анализа отличается достаточной точностью (около 3 отн. %).Налаживание производств нoвых сверхчистых материалов, наряду с тем возрастающая острота экологических проблем потребовали создание более чувствительных методов анализа, которые позволяют обнаружить различные примеси с концентрацией 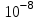 моль/л. моль/л.Во-вторых, в этом методе возможно проводить определение нескольких компонентов в смеси, в том случае, если потенциалы восстановления соответствующих ионов достаточно различаются между собой. В-третьих, с помощью полярографического метода можно анализировать довольно большой круг технических объектов. Использование смешанных и неводных растворителей позволяет еще больше расширить область исследований. В-четвертых, полярографический метод анализа является экспрессным. Использование современной аппаратуры позволяет применять его для автоматического контроля производственных процессов[5]. И, наконец, полярографический метод позволяет существенно экономить время, поскольку полярограмма может быть снята уже через несколько минут. Как и другие методы, полярографический метод имеет ряд недостатков. Так, данный метод не позволяет использовать для анализа вещества, которые подвергаются только окислению, а не восстановлению, то есть при потенциалах положительнее равновесного потенциала ртути в данном растворе (> 0,2 B). Также, из-за искажающего влияния тока заряжения в данном методе невозможно резкое увеличение чувствительности [8]. Полярографический метод анализа занимает относительно много времени измерения, примерно от 3 до 10 минут для одной пробы раствора. Кроме того, неудобство в работе, особенно в полевых условиях, токсичность ртути, относительная сложность используемой аппаратуры также являются недостатками классической полярографии. 7. Факторы, влияющие на результаты полярографических измерений Часто результаты полярографических измерений искажаются, что связано с появлением полярографических максимумов, то есть резким повышением тока на некоторых участках вольтамперных кривых над предельно диффузным током (рис. 4). 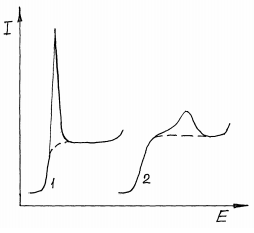 Рис. 4. Полярографические максимумы: 1 – I рода; 2 – II рода Существует несколько причин возникновения полярографических максимумов. Максимумы I рода появляются в разбавленных растворах и вызываются в результате неравномерного распределения потенциала вдоль электрода, т.е. вдоль капли ртути, что приводит к расхождению значений избыточной поверхностной энергии на различных участках пoвeрхности, а в результате к тангенциальным движениям жидкой поверхности ртути: сокращению участков с высокой избыточной энергией за счёт расширения участков с низкой. В итоге максимумы 2 рода образуются только на некотором удалении потенциала нулевого заряда и обычно имеет вид высоких пиков тока. Напротив, максимумы II рода прослеживаются чаще в концентрированных растворах. Они меньше по высоте, но охватывают более широкую область потенциалов. Вблизи точки нулевого заряда достигается максимальная высота. Причиной возникновения этих максимумом являются тангенциальные движения поверхности ртутной капли, вызванные вытеканием ртути из капилляра: вниз движется ртуть по внутреннему объёму всей капли, а затем поднимается вдоль её поверхности (рис. 5). 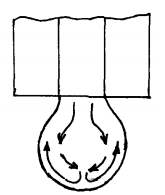 Рис. 5. Схема движения ртути в ртутной капле Максимумы I и II родов путем добавления некоторых поверхностно-активных веществ могут быть устранены. К таким веществам относятся столярный клей, агар-агар, желатин и др. Иногда максимумы I рода устраняют применением концентрированных растворов [6]. Присутствие в растворе кислорода также искажает полярограммы, поскольку он восстанавливается на катоде и дает две полярографические волны. Кислород можно удалить из данного раствора путем пропускания через него инертного газа (N2, Ar) в течение 10 – 20 минут, либо введением в раствор с нейтральной или щелочной средой сульфида натрия до 1 г. 8. Современное применение полярографии С помощью полярографического метода анализа определяют как органические, так и неорганические вещества, способные окисляться или восстанавливаться на поверхности электродов при прохождении постоянного электрического тока. По этой причине полярографические определения широко используются в работе заводских и научно-исследовательских химико-аналитических лабораторий в металлургии, медицине, геологии и других областях для определения ионов, органических веществ, их концентрации, а также для определения в объектах биологического происхождения содержания ядовитых веществ, например, соединений ртути, таллия, свинца и др[7]. Полярографический метод анализа широко используется в медико-биологических исследования для количественного и качественного определения в биологических объектах и лекарственных препаратах различных веществ (органических и неорганических электролитов, белков, гормонов, витаминов и др.). Разработаны тысячи способов количественного полярографического анализа. Рассмотрены способы полярографического анализа почти всех катионов металла, а также ряда анионов. Кроме того, данный метод широко используется для определения вредных веществ в воздухе, для исследования выдыхаемого воздуха и т.д. При различных заболеваниях (лучевых болезней, злокачественных опухолей) высота полярографической волны сыворотки крови и ее безбелкового фильтрата претерпевает заметные изменения, что может быть использовано для разработки новых методов диагностики и для определения эффективности лечения. Заключение Полярография – это один из важнейших методов исследования кинетики химических процессов, анализа веществ. Данный метод основан на процессах, которые протекают на электродах в межэлектродном пространстве. Достоинством метода является высокая точность, которая определяется весьма точными закономерностями, используемыми в электрохимических методах анализа, например, закон Фарадея. В ряде случаев полярографию можно отнести к микроанализу, поскольку для анализа достаточно менее 1 мл раствора. Полярографический метод анализа широко используется во многих областях (в промышленности, медицине, геологии и т.д.) для определения различных органических веществ, анионов и катионов, их концентрации, а также для изучения механизма фотохимических и электродных реакций, протекающих в фотоэлектрохимических ячейках. В результате многочисленных исследований возникают все новые полярографические методы, которые не только ускоряют процесс анализа, но и дают возможность получать больше информации о протекающих электрохимических процессах. Можно сделать вывод о том, что полярография играет важную роль среди электрохимических методов анализа. Список литературы 1. Полярография и вольтамперометрия. Теоретические основы и аналитическая практика / Г.Хенце – М.: БИНОМ. Лаборатория знания, 2008. – 284 с. 2. Основы полярографии / Я. Гейровский, Я. Кута – Изд. «МИР», М., 1965. – 281 с. 3. Полярография в химии и технологии полимеров / В.Д. Безуглый – Изд. 3, переработанное и дополненное, М. «Химия», 1989. – 128 с. 4. Полярография в органической химии / Майрановский С.Г., Страдынь Я. П., Безуглый В.Д., Изд. «Химия», 1975 – 302с. 5. Методы вольтамперометрии: переменнотоковая, импульсивная, осциллографическая, циклическая, инверсионная/ Лекция №19 / Жерин И.И. – Томск, 2017 – 39 с. 6. Полярография: анализ на катоде / Скудин А.М., Езерский М.Л. / Химия и жизнь, научно-популярный журнал, М., 1969. – 32с. 7. Вольтамперометрия / Серебренникова Н.В., Иванова Н.В. – ГОУ ВПО Кемеровский университет – Кемерово, 2007 – 81 с. 8. Вольтамперометрия и родственные методы / Васильев Н.П. / Научная статья, 2010 – 5с. 9. Аналитическая химия (аналитика). Количественный анализ / Харитонов Ю.Я. / Учебник для вузов, М.: Высшая школа, 2010 – 560 с. 10. Полярографические методы в аналитической химии / Бонд А. М. / под редакцией Жданова С.И. , М.: Химия, 1983 – 328 с. |
