ОТВЕТЫ ЭКЗАМЕН. Понятие атом
 Скачать 334.36 Kb. Скачать 334.36 Kb.
|
10. При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга. При рассмотрении ковалентных химических связей нередко используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация является формальным приемом, применяемым для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами. В результате гибридизации появляются новые гибридные орбитали (рис.24), которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона. Представление о гибридизации атомных орбиталей используется для изучения закономерностей изменения электронной плотности молекулы вблизи какого-либо атомного ядра в зависимости от его окружения, то есть позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны различные подходы к анализу этой связи. Если известно геометрическое расположение атомных ядер, расчет волновой функции молекулы можно свести к изучению парных взаимодействий соседних атомов. Для такого расчета выбирают одну из возможных систем гибридных орбиталей и располагают ее в пространстве так, чтобы обеспечить макс. перекрывание отдельных пар гибридных орбиталей разных атомов. Другой подход применяется в неэмпирических методах квантовой химии, в которых все взаимодействия атомов в молекулеучитываются одновременно и волновая функция молекулы не зависит от того, атомные или гибридизированные орбитали используются для расчета. В этом случае гибридные орбитали строят после определения волновой функции молекулы таким образом, чтобы в отдельных областях пространства распределение электронной плотности можно было описать одной гибридной орбитали. В обоих подходах тип гибридизации атомных орбиталей обусловлен геометрической конфигурацией молекулы и для большинства равновесных конфигураций оба подхода приводят к близким формам гибридной орбитали. В теоретической химии для систематизации экспериментальных данных о равновесных конфигурациях молекул часто применяют феноменологический подход, в рамках которого атомы данного элемента склонны к гибридизации определенного типа, а тип гибридизации определяет взаимное расположение ядер ближайшего окружения. Отклонение конфигурации молекулы от симметричной связывают с взаимодействием химических связей (напр., с отталкиванием пар электронов, образующих связь). В такой форме представления о гибридизации атомных орбиталей используются в стереохимии. 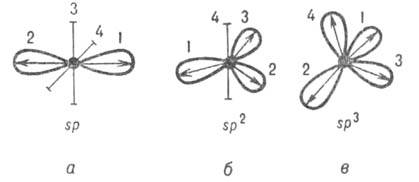 11. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле. Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы: Орбитали участвующие в гибридизации s, p. Тип гибридизации sp – гибридизация Орбитали участвующие в гибридизации s, p, p. Тип гибридизации sp2 – гибридизация  . Примеры BH3 , BF3, C2H4, AlCl3. Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4). . Примеры BH3 , BF3, C2H4, AlCl3. Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).Орбитали участвующие в гибридизации s, p, p, p. Тип гибридизации sp3 – гибридизация  . Пространственная форма молекулы Тетраэдрическая . Пространственная форма молекулы Тетраэдрическая . Примеры СH4 NH4 PO43- BF4- . Примеры СH4 NH4 PO43- BF4-12. Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи. Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда). Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны.Ионные связи — сильно полярны. Полярность молекулы – Молекула составлена из одной или более химических связей (ковалентные связи) междумолекулярным orbitals различных атомов. Молекула может быть полярной или в результате полярных связей из-за различий в electronegative как описано выше, или в результате асимметричного расположения неполярных ковалентных связей и несближающихся пар электронов, известных как полное молекулярное орбитальное.
Подобным образом, молекула может быть неполярной или потому что нет (почти) никакой полярности в связях или из-за симметрического расположения полярных связей.
13. Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора. Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы (напр., алюминий при образовании иона AlH4-) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое. Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общаяэлектронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентнымиэлектронами металла зон энергетич. уровней (см. Твердое тело), наз. зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическая связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи. 14. ВАн Дер Ваальс изучал силы межмолекулярного взаимодействия. Существование веществ в разных сосстояниях говорит о том, что между частицами возникает взаимодействие. Силы межмолекулярного взаимодействия, возникающие без передачи электронов, называют вандерваальсовские. Они универсальны, так как взаимодействуют между всеми молекулами и атомами без исключения. 3 типа: Ориентационное, Индуктивное,дисперсионное. ОРИЕНТАЦИОННОЕ (между диполями (+ -)(+ -)). ИНДУКЦИОННОЕ (происходит за счет индуцированных диполей -> при встрече неполярной молекулы и диполя, последний вызывает поляпризацию неполярной молекулы, то есть индуцирует диполь, который в свою очередь вызывает еще большую поляризацию диполя ( ( )(+ -) -> (+ -)(+ -) ). ДИСПЕРСИОННОЕ (универсально, обусловлено действием молекул друг с другом за счет образования мгновенных микродиполей, возникают вследствие движения электронов в атоме, Таким образом молекулу можно рассматривать как совокупность очень быстро меняющихся мгновенных микродиполей (Cl:Cl) ). Вандерваальсовские силы слабее ковалентной связи. 15. Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические. Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис 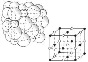 , где указывается только взаимное расположение частиц, но не их размеры. , где указывается только взаимное расположение частиц, но не их размеры.Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом. В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде. Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4 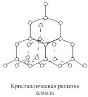 . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием. . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис . 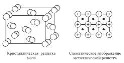 Большинство кристаллических органических соединений имеют молекулярную решетку. Большинство кристаллических органических соединений имеют молекулярную решетку.16. Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. H = U + PV Энтропи́я — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса). Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции. Например: Термохимическое уравнение разложения малахита (CuOH)2 CO3 = 2CuO + H 2 O + CO 2 - 47 кДж Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа. Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества. 17. Закон Гесса —Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. 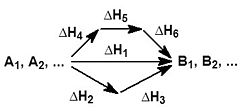 Следствия из закона Гесса: 1.Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). 2.Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν): 3.Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν): Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры. 4.Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю. 18. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида: Итак имеем два критерия возможности самопроизвольного протекания химического процесса - изменение энтальпии DН, которое отражает взаимодействие атомов, образование химических связей, т.е. определенное упорядочение системы и изменение энтропии DS, которое отражает противоположную тенденцию к беспорядочному расположению частиц. Если DS=0, то движущей силой процесса будет стремление системы к минимуму внутренней энергии, т.е. критерий процесса - уменьшение энтальпии или DН<0.Если DН=0, то критерий самопроизвольного протекания процесса DS>0.Чтобы иметь возможность количественно сопоставить эти два критерия, нужно, чтобы они выражались в одинаковых единицах. (DН- кДж, DS- Дж/K). Очевидно, чтобы выразить энтропийный фактор в единицах энергии, его нужно домножить на температуру. Это тем более логично, что повышение Т способствует увеличению беспорядка в системе. Тогда ТDS - энтропийный фактор процесса, DН - энтальпийный. В состоянии равновесия оба эти фактора должны быть равны DН = ТDS (1) 19. Скорость химических реакций - это число элементарных актов химических превращений, приводящих к образованию продуктов реакции, в единицу времени в единице объема или на единице поверхности. В любой реакции реагенты расходуются, она замедляется. Поэтому можно говорить только о скорости в данный момент времени. Очевидно, что скорость зависит от концентрации реагирующих веществ. Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Для одностадийной гомогенной реакции типа А+В ® продукты реакции этот закон выражается уравнением:v = k cA cB,где v - скорость реакции; cA и cB - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. 20. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. Уравнение, которое описывает это правило следующее: 21. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоуляхна моль), чтобы произошла реакция. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции: С повышением температуры растёт вероятность преодоления энергетического барьера. |
