K2SiO3 + НОH =>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH- => НSiO3- + 2K+ + ОН-
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S
2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН)3 + 6Н+ + S2-
рН =7
Гидролиз многокислотных солей и многоосновных кислот проходит ступенчато. Например, гидролиз хлорида железа (II) включает две ступени:
1-ая ступень FeCl2 + HOH =>Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- =>Fe(OH)+ + 2Cl- + H+
2-ая ступень Fe(OH)Cl + HOH =>Fe(OH)2 + HCl
Fe(OH)+ + Cl- + H+ + OH- =>Fe(ОН)2 + Н+ + Cl-
Гидролиз карбоната натрия включает две ступени:
1-ая ступень Nа2СО3 + HOH =>NаНСО3 + NаОН
СО32- + 2Na+ + H+ + OH- =>НСО3- + ОН- + 2Na+
2-ая ступень NаНСО3 + Н2О =>NаОН + Н2СО3
НСО3- + Na+ + H+ + OH- =>Н2СО3 + ОН- + Na+
Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Мg(ОН)2, Fe(ОН)2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота ( СН3СООН, Н2СО3 ) - со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al2S3 + 6H2O =>2Al(OH)3 + 3H2S
34. Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомыокислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Важнейшие восстановаители: Металлы,Водород,Уголь,Окись углерода (II) (CO)Сероводород (H2S),Оксид серы (IV) (SO2),Cернистая кислота H2SO3 и ее соли,Галогеноводородные кислоты и их соли,Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3,Азотистая кислота HNO2,Аммиак NH3.
Важнейшие окислители: Галогены,Перманганат калия(KMnO4),манганат калия (K2MnO4),оксид марганца (IV) (MnO2),Дихромат калия (K2Cr2O7),хромат калия (K2CrO4),Азотная кислота (HNO3),Серная кислота (H2SO4) концентрированная,Оксид меди(II) (CuO)
35. 1. Реакции межмолеулярного окисления/восстановления. Такие реации могут протекать в кислой, щелочной или нейтральной среде.
2. Реакции внутримолекулярного окисл/восстановления. Реакции, когда в одной молекуле сложного вещества один элемент проявляет свойства окислителя, а другой - восстановителя. К таким реакциям относится разложения: 2KClO3 -> 2KCl + 3O2.
3. Реакции самоокисления/самоввтановления (диспропорционирования): атомы одного и того же элемента одновременно проявляют как окислительные так и восстановительные свойства. Они протекают для элементов, имеющих промежуточную степень окисления (Cl2 + H2O -> HCl(-1) + HCl(+1)O.
К аким соединениям, проявляющим как окислительные, так и восстановытельнве, относится перекись водорода: 5Н2О2+"КMnO4+3H2SO4 -> 3MnSO4+K2SO4+O2+ H2O/восстановитель, 2MnO4+16H+5H2O2 -> 2Mn(2+)+8H2O+5O2+10H/окислитель.
СОСТАВЛЕНИЕ двумя методами:
1. Метод электронного балланса.
Mg+H2SO4->MgSO4+H2 (Mg-2e->Mg(+2) - восстановитель, 2H+2e->H2(0) - окислитель.
2. Метод полуреакций (ионно-электронный):
К2Сr2O7+3K2SO4+4H2SO4->Cr2(SO4)3+4K2SO4+4H2o (окислитель Сr2O7(2-)+14H(+)->2Cr(3+)+7H2O? восстановитель SO3(2-)+H2O->SO3(2-)+2H).
36. Качественное определение направления протекания окислительно-восстановительных процессов заключается в сравнении значений стандартных окислительно-восстановительных потенциалов различных редокс-пар. При этом исходят из следующих положений:
стандартные окислительно-восстановительные потенциалы являются количественной характеристикой как процесса восстановления, так и обратного ему процесса – окисления;
окисленная форма редокс-пары с большим значением 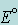 играет роль окислителя по отношению к восстановленной форме пары с меньшим значением играет роль окислителя по отношению к восстановленной форме пары с меньшим значением 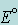 ; ;
чем больше 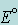 , тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность; , тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность;
окислительно-восстановительная реакция будет протекать в прямом направлении только в том случае, если электродвижущая сила реакции (ЭДС), вычисляемая как 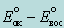 , имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция; , имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция;
окислительно-восстановительные процессы идут в направлении образования более слабых окислителей и восстановителей.
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) вокислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением: Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
37. Если пластинку металла погруженную в раствор его соли с концентрацией металла 1 моль/л соединить со стандартным водным электродом,то получим гальванический элемент. Гальванический элемент-устройство,которым энергия самопроизвольно протекающей ОВР превращается в электрическую энергию,такие устройства также называют химическими источниками тока,при работе гальванического элемента возникает разность потенциалов названная ЭДС ЭДС=ФИк-ФИа, Гальванический элемент Даниэля Якоби. Zn=Zn+2e. Cu=Cu+2e. после замыкания цепи,равновесие нарушается и избыток электронов с цинковой пластинки будет переходить на медную. Электрон будет переходить с цинковой пластинки на медную и тогда в реакции (1) равновесие сместится вправо, а в реакции (2) влево. Zn-окисляется, Cu-восстанавливается Zn(0)-2e=Zn(2+), Cu(2+)+2e=Cu(0) Zn+Cu(2+)=Cu+Zn(2+), Zn+CuSo4=Cu+ZnSo4. Между растворами электролитов также возникает разность потенциалов. В цинковом полуэлементе в результате растворения цинка образуется избыток ионов Zn(+2) а в медном полуэлементе в результате осаждения меди концентрация Cu(+2) уменьшается и создается избыток анионов. В результате перемещения ионов по солевому мостику создаетя направленное движение заряженных частиц,возникает эл.ток. В таком неравновесном режиме элемент Даниэля Якоби будет работать до тех пор,пока полностью не растворится цинковая пластинка или полностью не восстановятся ионы меди из раствора. Краткая схема записи: Zn/ZnSo4//CuSo4/Cu поскольку концентрация ионов меди постоянно изменяется то в соответсвии с уравнением Нернста будет уменьшаться потенциал катода,таким образом по мере работы гальванического элемента происходит выравнивание потенциалов. Система приходит в равновесие и гальванический элемент прекращает работу ФИк=ФИа,Эдс=0. При работе гальванического элемента совершается Aп=nFдФИ, дG=-A=-nFдФИ, дФИ=ФИк-ФИа
38. Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:2Н+ + 2e? = H2 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
39.Возможность и направление протекания ОВР.Формула Нерста
Направление ОВР такого, что из более сильных окислителя и восстановителя всегда получаются более слабые связи между фи0 и ФИ. ФИox/Red=фи0+RT/nF*Lg(a^aоx/a^bred - уравнение Нерста. F-число Фарадея, n число электронов принятых или отданных, aox- активная концентрация окислителя ared-активная концентрация восстановителя. а и в коэффициенты перед формулами в-в. Фиox/red=фи0+0,059/nLg[ox]^a/[Red]^в, если участвует водород, то он влияет на величину ФИ ..... Lg[ox]^a[H]/[Red]^в чем меньше величина ОВП(ФИ) тем более сильными восстановительными свойствами характеризуются окислительная форма. 1)Чем более отрицателен потенциал металла тем больше его восстановительная способность. 2)Каждый металл способен вытеснять восстанавливать из растворов солей те же металлы которые стоят в ряду напряжения после него. Все маталлы имеющие отрицательные значения потенциала и стоящие в ряду напряжений до водорода способны вытеснять его из растворов кислот. Чтобы предвидеть направление ОВР нужно найти дФИ реакции дФИ=ФИокисл-Фивосст, дФИ>0 то реакция протекает слева направо.
40. Электролиз - совокупность окислительно-восстановительных процессов, которые происходят на электродах в растворах или расплавах электролитов (разложение электролитов эл. током). Процесс электролиза происходит в электролитических ячейках (электролицерах). Потенциал разложения - минимальное напряжение, которое необходимо установить, чтобы электролиз шел с заметной скоростью (0,5-7В). U(разл) = [ϕ(ок)-ϕ(восст)]+U(перенапр). Потенциал перенапряжения находится экспериментально.
Закон электролиза Фарадея: зависимость количества вещества (m), образовавшееся припри электролизе, от силы тока, времени, природы электролита. m=Э*t*I/F, Э= M/n, m=kIt, Э - эквивалентная масса вещества, n- количество электронов, M-молекулрная масса, I-сила тока, t- время, F=96500 (постоянная Фарадея).
41. Для электролиза расплавов, в отличие от электролиза растворов, характерно протекание процесса при высоких температурах в специально подготовленных для этого электролизерах с инертными электродами. Например, как при электролизе расплава хлорида натрия. 2NaCl= Na(+) + Cl2(-), на катоде Na(+)+ē→Na(0)-восстановление, на аноде 2Cl(-)–2ē→Сl2- окисление).
Ячейка представляет сосбой 2 электрода, погруженных в раствор или в расплав соли и подключенных к источнику тока. Источник тока выполняет роль электронного насоса, нагнетающего электроны на 1 электрод (катод) и удаляющего электроны с анода.
|
 Скачать 334.36 Kb.
Скачать 334.36 Kb.