Навигация по странице: 33.
|
ОТВЕТЫ ЭКЗАМЕН. Понятие атом
Гомогенный катализ Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии: H2О2 + I → H2О + IO H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Диффузия реагирующих веществ к поверхности твердого вещества
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
Химическая реакция между реагирующими молекулами
Десорбция продуктов с поверхности катализатора
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
22. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы, влияющие на химическое равновесие:
1) При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль
3) При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии 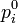 = 0,1013 МПа или 1 атм) может быть рассчитана по выражению: = 0,1013 МПа или 1 атм) может быть рассчитана по выражению: 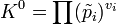 где где 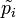 — относительные парциальные давления компонентов, — относительные парциальные давления компонентов, 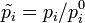
Для обратимой химической реакции константа равновесия может быть выражена через константы скорости прямых и обратных реакций, исходя из того факта, что в состоянии равновесия скорости прямой и обратной реакций равны. Например, для элементарной обратимой химической реакции первого порядка 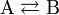 легко показать[2], что: легко показать[2], что: 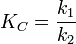 где k1 — константа скорости прямой реакции, а k2 — обратной. где k1 — константа скорости прямой реакции, а k2 — обратной.
23. Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры.
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
24. Растворами называют гомогенные однородные системы, состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения однородности. Различают растворы истинные и коллоидные . При образовании истинных растворов соединения распадаются на частицы размером 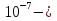 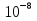 см, т. е. растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Коллоидные растворы относятся к дисперсным системам - гетерогенным системам, в которых частицы одного вещества равномерно распределены в другом. Размер частиц в дисперсных системах лежит в пределах от см, т. е. растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Коллоидные растворы относятся к дисперсным системам - гетерогенным системам, в которых частицы одного вещества равномерно распределены в другом. Размер частиц в дисперсных системах лежит в пределах от 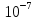 см до см до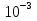 см. см.
Растворы бывают газообразными (газовые смеси), жидкими и твердыми. Газообразным раствором является, например, воздух. Морская вода - наиболее распространенный жидкий раствор различных солей и газов в воде. К твердым растворам относятся многие металлические сплавы. Наибольшее практическое значение имеют жидкие растворы. В этих растворах обычно протекает большинство реакций, так как в них создаются весьма благоприятные условия для перемещения молекул и тесного их сближения, необходимого для химического взаимодействия.
Растворы состоят из растворителя и растворенного вещества (веществ). Эти понятия условны. Если одним из составляющих растворов веществ является жидкость, а другими - газы или твердые вещества, то растворителем обычно считают жидкость. В других случаях растворителем считают тот компонент, которого больше
Способы выражения концентрации растворов
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:w(B)= m(B) / m. Обычно выражают в долях единицы или в процентах
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.C(B) = n(B) / V = m(B) / (M(B) · V),где М(B) - молярная масса растворенного вещества г/моль.Молярная концентрация измеряется в моль/л и обозначается "M".
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
25. Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя. 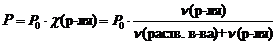 , где Р – давления насыщенного пара растворителя над раствором, Па;Р0 – давления насыщенного пара над растворителем, Па;c(р-ля) – мольная доля растворителя;n(раств. в-ва) – количество растворенного вещества, моль;n(р-ля) – количество вещества растворителя, моль. , где Р – давления насыщенного пара растворителя над раствором, Па;Р0 – давления насыщенного пара над растворителем, Па;c(р-ля) – мольная доля растворителя;n(раств. в-ва) – количество растворенного вещества, моль;n(р-ля) – количество вещества растворителя, моль.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества: 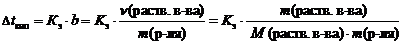 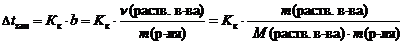 где Dtкип – повышение температуры кипения раствора, °С;Dtзам – понижение температуры замерзания раствора, °С;Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;Кк – криоскопическая константы растворителя, (кг×°С)/моль;b – моляльная концентрация, моль/кг;n(раств. в-ва) – количество растворенного вещества, моль;m(р-ля) – масса растворителя, кг;m(раств. в-ва) – масса растворенного вещества, г;М(раств. в-ва) – молярная масса растворенного вещества, г/моль. где Dtкип – повышение температуры кипения раствора, °С;Dtзам – понижение температуры замерзания раствора, °С;Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;Кк – криоскопическая константы растворителя, (кг×°С)/моль;b – моляльная концентрация, моль/кг;n(раств. в-ва) – количество растворенного вещества, моль;m(р-ля) – масса растворителя, кг;m(раств. в-ва) – масса растворенного вещества, г;М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов: tкип.(р-ра) = tкип.(р-ля) + Dtкип. tзам.(р-ра) = tзам.(р-ля) – Dtзам.
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора. 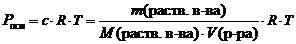 где Росм – осмотическое давление, кПа; где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;R – универсальная газовая постоянная, 8,314 Дж/(моль×К);Т – абсолютная температура, К;V(р-ра) – объем раствора, л.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы: 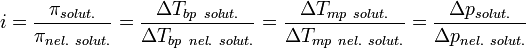 ,где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания). ,где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
26. Давление пара над растворами. В результате естественного процесса испарения над жидкостью образуется пар, давление которого можно измерить с помощью манометра. Эндотермический процесс испарения обратим: одновременно протекает экзотермический процесс конденсации. При определенных условиях устанавливается равновесие (∆G = 0). Равновесное состояние системы жидкость - пар при данной температуре характеризуется давлением насыщенного пара.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя. 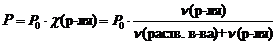 , где Р – давления насыщенного пара растворителя над раствором, Па;Р0 – давления насыщенного пара над растворителем, Па;c(р-ля) – мольная доля растворителя;n(раств. в-ва) – количество растворенного вещества, моль;n(р-ля) – количество вещества растворителя, моль. , где Р – давления насыщенного пара растворителя над раствором, Па;Р0 – давления насыщенного пара над растворителем, Па;c(р-ля) – мольная доля растворителя;n(раств. в-ва) – количество растворенного вещества, моль;n(р-ля) – количество вещества растворителя, моль.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества: 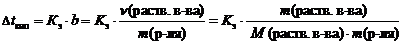 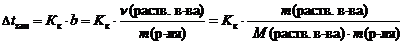 где Dtкип – повышение температуры кипения раствора, °С;Dtзам – понижение температуры замерзания раствора, °С;Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;Кк – криоскопическая константы растворителя, (кг×°С)/моль;b – моляльная концентрация, моль/кг;n(раств. в-ва) – количество растворенного вещества, моль;m(р-ля) – масса растворителя, кг;m(раств. в-ва) – масса растворенного вещества, г;М(раств. в-ва) – молярная масса растворенного вещества, г/моль. где Dtкип – повышение температуры кипения раствора, °С;Dtзам – понижение температуры замерзания раствора, °С;Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;Кк – криоскопическая константы растворителя, (кг×°С)/моль;b – моляльная концентрация, моль/кг;n(раств. в-ва) – количество растворенного вещества, моль;m(р-ля) – масса растворителя, кг;m(раств. в-ва) – масса растворенного вещества, г;М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов: tкип.(р-ра) = tкип.(р-ля) + Dtкип. tзам.(р-ра) = tзам.(р-ля) – Dtзам.
27. Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы.
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2,Ва(ОН)2). К слабым электролитам относится большинство кислот (особенно органических) и оснований.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
28. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: 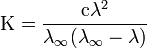 Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства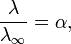 где α — степень диссоциации. где α — степень диссоциации.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%":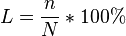 числа распавшихся на ионы молекул к общему числу растворенных молекул. числа распавшихся на ионы молекул к общему числу растворенных молекул.
Степень диссоциации 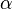 равна отношению числа диссоциированных молекул равна отношению числа диссоциированных молекул 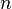 к сумме к сумме 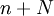 , где , где 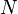 — число недиссоциированных молекул. Часто — число недиссоциированных молекул. Часто 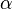 выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора. выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как например когдакомплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. В общей реакции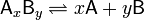 где комплекс где комплекс 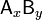 разбивается на x единиц A и y единиц B, константа диссоциации определяется так: разбивается на x единиц A и y единиц B, константа диссоциации определяется так: ![k_{d} = \frac{[a]^x \times [b]^y}{[a_x b_y]}](13442_html_236540b9.png) где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно. где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
29. Реакции обмена в растворах электролитов протекают в направлении образования слабого или более слабого электролита. Количественной оценкой «слабости» электролита являются константа диссоциации - Кдис, растворимость (Р) или произведение растворимости (ПР) труднорастворимых электролитов, константа нестойкости (диссоциации) комплексного иона и др константы, о которых еще будет сказано ниже. Необратимые реакции обмена в растворах электролитов можно разделить на три типа:
1. сильный электролит + сильный электролит = сильный электролит + слабый электролит,
ионная форма ионная форма ионная форма молекулярная форма
2. сильный электролит + слабый электролит = сильный электролит + слабый электролит,
ионная форма молекулярная форма ионная форма молекулярная форма
3. слабый электролит + слабый электролит = сильный электролит + слабый электролит.
молекулярная форма молекулярная форма ионная форма молекулярная форма
Приведем пример составления уравнений реакций обмена (1 тип):
NaC1(соль (Р),сильный электролит, ионное состояние в растворе) + АgNО3 (соль (Р),сильный электролит, ионное состояние в растворе) ↔ АgСl¯ (соль (Н),слабый электролит, молекулярное состояние в растворе) + NаNО3 (соль (Р),сильный электролит, ионное состояние в растворе) - молекулярное уравнение
Na+ + C1- + Аg+ + NО3- ↔ АgСl¯ + Nа+ NО3- полное ионно - молекулярное
Аg+ + С1‾ ↔ АgСl¯ сокращенное ионное
Сокращенное ионное уравнение отражает суть химических превращений в растворе. Для приведенного примера, сокращенное уравнение показывает, что в реакции только ионы Аg+ и С1‾ изменили свое состояние – из ионного состояния в исходном растворе (АgNО3, NaC1) перешли в молекулярное (АgСl¯). Кроме того, сокращенное уравнение говорит, что при взаимодействии любого сильного электролита, содержащего катион Аg+ с сильным электролитом, содержащим анион CI- (КCI, CaCI2, AICI3 и др.) обязательно выпадет белый творожистый осадок труднорастворимой соли АgCI↓.
30. Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде: 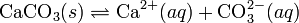
Константа этого равновесия рассчитывается по уравнению: 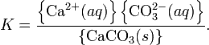
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения: ![k_{\mathrm{sp}} = \left[\mbox{ca}^{2+}(aq)\right]\left[\mbox{co}_3^{2-}(aq)\right].](13442_html_62acc6ba.png)
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению: ![k_{\mathrm{sp}} = \left[\mbox{a}^{n+}(aq)\right]^m\left[\mbox{b}^{m-}(aq)\right]^n,\,](13442_html_1de8fef0.png) где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации. где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
При проведении в растворе таких реакций, которые могут привести к выделению осадка, существует определенное требование к значению аналитических концентраций реагентов − условие выпадения осадка.
Образование осадка малорастворимого сильного электролита МxАy произойдет только тогда, когда после смешивания растворов реагентов в конечном объеме смеси будет соблюдаться соотношение
(сMy+)x · (сАx−)y > ПР(MxAy)
где в круглых скобках стоят выбранные (по условию проведения опыта) молярные концентрации катионов и анионов в конечном растворе (после смешивания растворов реагентов).
Если условие выпадения осадка не выполняется, т.е. (сMy+)x · (сАx−)y < ПР(MxAy ), то образование осадка происходить не будет.
Рассмотрим насыщенный раствор труднорастворимого сильного электролита, где содержится наряду с жидкой фазой и кристаллический осадок. Если удастся осуществить некоторые операции, в результате которых произведение концентраций ионов в растворе над осадком станет меньше произведения растворимости: (сMy+)x · (сАx−)y < ПР(MxAy ), то произойдет растворение осадка.
31. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует: 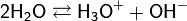
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: ![\mathsf{k=\frac{\left[h^+\right]\left[oh^-\right]}{\left[h_2o\right]}} \ \ \ (1)](13442_html_m773ef8fa.png) где: где:
[H+] — концентрация ионов гидроксония (протонов);[OH−] — концентрация гидроксид-ионов;[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как: ![\mathsf{k\left[h_2o\right]=\left[h^+\right]\left[oh^-\right] \ \ \ (2)}](13442_html_m323b5b6d.png)
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ, «пи эйч») — мера активности (в очень разбавленных растворах она эквивалентнаконцентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифмактивности водородных ионов, выраженной в молях на один литр: ![\mbox{ph} = -\lg \left[ \mbox{h}^+ \right]\!](13442_html_749e5de2.png)
32. Раствор слабой кислоты pН = ½рКА – ½lgС (кислоты) где, КА константа кислотности, C - исходная концентрации этой кислоты.
Раствор слабого основания pН = 14 – ½рКВ + ½lgС(основания) где , КВ константа основности, С- исходная концентрации этого основания
Индика́тор — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения.
Кислотно-основные индикаторы — вещества, изменяющие свою окраску при изменении водородного показателя (pH) среды. Метилоранж, фенофталеин и тд.
Окислительно-восстановительные индикаторы — вещества, способные окисляться или восстанавливаться в определённых интервалах значений окислительного потенциала и изменять при этом свою окраску. Метиленовый синий, дифениламин, крахмал.
Комплексонометрические индикаторы — вещества, образующие с определяемыми ионами окрашенные Комплексные соединения. Эриохром чёрный Т, ксиленоловый оранжевый, кислотный хром тёмно-синий.
Адсорбционные индикаторы — вещества, в присутствии которых в точке эквивалентности, устанавливаемой методом осаждения, изменяется цвет осадка. Эозин, флуоресцеин.
Хемилюминесцентные индикаторы — вещества, способные в точке эквивалентности светиться видимым светом и используемые при титровании сильно окрашенных растворов. Люминол, силоксен.
33. Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион:
FeCl2 + HOH =>Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- => FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H и другие ионы. рН раствора < 7 ( раствор приобретает кислую реакцию).
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
|
|
|
 Скачать 334.36 Kb.
Скачать 334.36 Kb.