неорганическая химия (РГР). РГР по химии. Задание для расчетнографической работы 1
 Скачать 49.76 Kb. Скачать 49.76 Kb.
|
|
Задание для расчетно-графической работы 1. Каким будет давление пара раствора при 65 °С, если он содержит сахарозу C12H22O11 массой 13,68 г в воде массой 90,00 г, а давление водяного пара при той же температуре равно 25,0 кПа? Решение: Для расчета по формуле Рауля 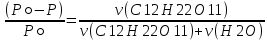 нам нужно найти количество вещества 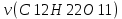 по формуле: по формуле: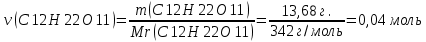 Малярная масса C12H22O11: 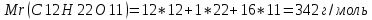 Найдем количество вещества воды: 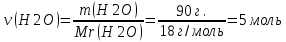 По закону Рауля найдем давление пара раствора: 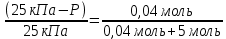 (25 – Р)*(0,04 + 5) = 0,04 * 25 (25 – Р)*5,04 = 1 126 – 5,04Р = 1 – 5,04Р = 1 – 126 Р = 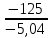 Р = 24,8 Ответ: Р = 24,8 б) Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 °С. Вычислите молекулярную массу растворенного вещества. Решение: Понижение температуры кристаллизации вещества равно 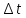 = 5,5 – 5,26 = 0,204. Масса растворённого вещества, приходящегося на 1000 г бензола равна: = 5,5 – 5,26 = 0,204. Масса растворённого вещества, приходящегося на 1000 г бензола равна: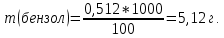 Для расчета молекулярной массы вещества используем уравнение: 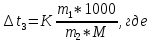 К – криоскопическая константа; m1 – масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества; Тогда 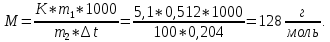 Ответ: 128 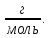 в) Осмотическое давление раствора мочевины ((NН2)2СО) при 0°С равно 6,8105 Па. Найдите ее массу в 1 дм3 раствора. Решение: Росм = 6,8*10 5 Па = 680 кПа, Т = 273К (Росм.) – это давление , которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перегородкой Росм = См * R * T 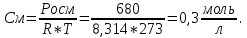 V (р-ра)= 1 дм3 =1 л Рассчитываем количество вещества по формуле: ν = См ∙ V = 0,3 ∙ 1= 0,3 моль Массу мочевины наодим из формулы 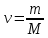 m = М ∙ ν = 60 ∙ 0,3 = 18 г Ответ: 18 г Задание для расчетно-графической работы 2. Дайте определение понятия сильного электролита и ионной силы. Сильный электролит – вещество, которое при растворении почти полностью подвергается диссоциации на ионы. Ионная сила раствора -мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Запишите формулы для расчета ионной силы, активности иона. 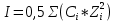 Активность – условная концентрация вещества в растворе, в соответствии с которой оно участвует в физико-химических процессах. 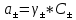 Где 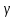 коэффициент активности, а коэффициент активности, а 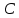 концентрация концентрацияДайте определение рН и формулу расчета рН. Водородный показатель – отрицательный десятичный логарифм концентрации катионов водорода в растворе. 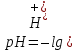 Рассчитайте ионную силу I раствора, активности ионов ai, коэффициент активности, рН системы, состоящей из сильных электролитов заданной концентрации. Раствор сильных электролитов 0,005 М H2SO4 + 0,001 M NаСl Решение: Данный раствор содержит сильные электролиты, которые диссоциируют по уравнениям: H 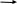 2SO4 2SO4 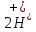 + +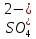 N 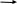 аСl аСl 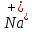 + +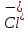 Водородный показатель такого раствора, определяется активностью иона 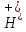 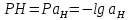 Для этого вычислим ионную силу I раствора по уравнению: 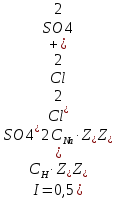 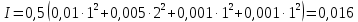 По уравнению закона Дебая-Хюккеля определяют средний коэффициент активности ионов γ± в данном растворе: 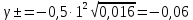 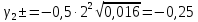 Следовательно, средний коэффициент активности ионов γ± = 0,87, а для 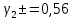 Считая коэффициент активности ионов водорода 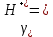 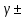 вычисляют активность ионов водорода: вычисляют активность ионов водорода: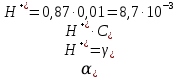 моль/л моль/л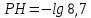 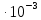 = 2,06 = 2,06Вычислим активность ионов 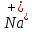 , , 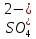 , , 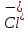 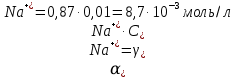 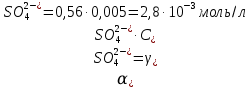 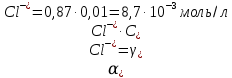 Задание для расчетно-графической работы 3. Дайте определение понятия «произведение растворимости» и сформулируйте условия выпадения и растворения осадка. Для малорастворимого электролита: а) напишите уравнение фазового равновесия в его насыщенном растворе; для константы этого равновесия приведите название, выражение (по закону действующих масс) и значение, используя данные таблиц в приложении; б) определите, можно ли приготовить раствор данного электролита указанной концентрации с1 и рассчитайте, в каком объеме воды при комнатной температуре можно растворить 0,1 г данного вещества; в) определите, как изменится его растворимость в растворе заданного электролита с указанной концентрацией с2 по сравнению с чистой водой. (Расчет провести приближенно, без учета коэффициентов активности сильного электролита). 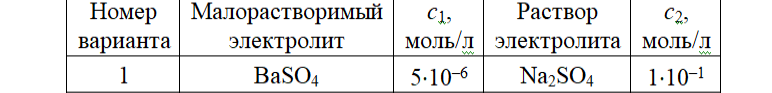 Решение: а) Малорастворимый электролит 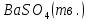 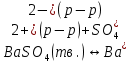 В выражение константы этого гетерогенного равновесия не входит концентрация твердой фазы: 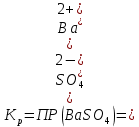 Константа равновесия здесь это произведение растворимости. б) 1)определите, можно ли приготовить раствор данного электролита указанной концентрации с1 и рассчитайте х моль х моль х моль 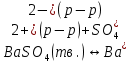 выразим катион 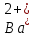 и анион и анион 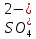 за (х) и приравняем к произведению растворимости за (х) и приравняем к произведению растворимости 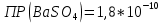 . Решаем уравнение: . Решаем уравнение: 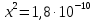 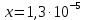 = =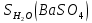 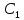 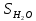 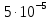 ˃ ˃ 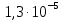 Т.к. концентрация больше растворимости, следовательно раствор приготовить нельзя. 2) в каком объеме воды при комнатной температуре можно растворить 0,1 г данного вещества 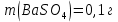 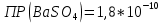 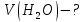 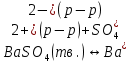 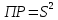 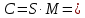 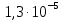 ·(233) = 30,29· ·(233) = 30,29·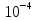 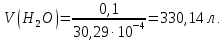 в) определите, как изменится его растворимость в растворе заданного электролита с указанной концентрацией с2 по сравнению с чистой водой. (Расчет провести приближенно, без учета коэффициентов активности сильного электролита). 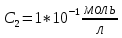 (концентрацияэлектролита (концентрацияэлектролита 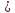 В соответствии с уравнениями диссоциации и с тем, что молярная растворимость (S) совпадает с молярной концентрацией (C) соли в растворе 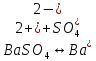  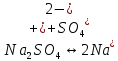 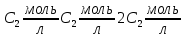 Произведение растворимости при Т=298 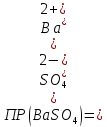 Если в 1 л растворилось S 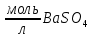 , то концентрации ионов в соответствии с уравнениями диссоциации: , то концентрации ионов в соответствии с уравнениями диссоциации: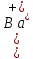 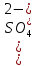 Подставляем все в ПР: 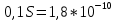 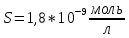 Найдем растворимость в воде и сравним полученные значения растворимостей: 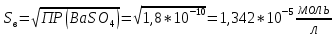 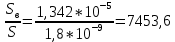 То есть в 0,1 М раствора сульфата натрия растворимость сульфата бария в 7453,6 раза меньше, чем в воде. |
