Пособие по биологии для поступающих в вузы Авторы Пименов А. В., Гончаров О. В
 Скачать 34.81 Mb. Скачать 34.81 Mb.
|
35.5. Органические веществаОрганические соединения составляют в среднем 20–30 % массы клетки живого организма. К ним относятся биологические полимеры — белки, нуклеиновые кислоты и полисахариды, а также жиры и ряд низкомолекулярных органических веществ — аминокислоты, простые сахара, нуклеотиды и т.д. Различные типы клеток содержат разное количество органических соединений. Так, растительные клетки богаты углеводами, а животные — белками (40–50 % в животной, 20–35 % в растительной). Каждая из групп органических веществ в клетках любого типа выполняет сходные функции. 35.5.1. БелкиИз органических веществ клетки по количеству и значению на первом месте стоят белки. Белки, или протеины (от греч. протос — первый, главный), — высокомолекулярные органические вещества, характеризующиеся строго определенным элементарным составом и распадающиеся при гидролизе до аминокислот. В состав белков входят (в %): углерод — 50-55, водород -6,5-7,3, азот — 15-18, кислород — 21-24, сера — до 2,4 и зола — до 5,5. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Белки обладают большой молекулярной массой: молекулярная масса альбумина (одного из белков яйца) — 36000, гемоглобина — 152000, миозина (одного из белков мышц) — 500000. Один из белков — глобулин молока — имеет молекулярную массу 42000. Его формула С1864Н3012О576N468S21. Существуют белки, молекулярная масса которых в 10 и даже в 100 раз больше. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78. Аминокислотный состав белковБелки являются полимерами, то есть состоят из нескольких структурных единиц — мономеров. Белки представляют собой непериодичные полимеры, мономерами которых являются аминокислоты.В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 26. Причем 6 из них являются нестандартными. Они образуются в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь. Поэтому обычными компонентами белков можно считать лишь 20 аминокислот. В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают:
Растения способны синтезировать все необходимые им аминокислоты, а животные же — лишь половину. Незаменимые аминокислоты должны поступать в организм вместе с пищей. В зависимости от аминокислотного состава, белки бывают:
Основная масса аминокислот, входящих в состав молекулы белка, яв- л 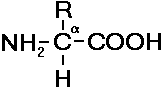 Рис. 255. Общая формула аминокислот. яется аминокислотами5. Общая формула аминокислот приведена на рисунке. Все аминокислоты содержат хотя бы одну карбоксильную группу (-СООН) и одну аминогруппу (-NH2). Остальная часть молекулы представлена R-группой (рис. 255). В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают:
Свойства аминокислот зависят не столько от количества аминогрупп и карбоксильных групп, сколько от их радикалов. Радикалы могут быть простыми и сложными, небольшими по размерам и громоздкими, гидрофильными и гидрофобными, химически инертными и высокоактивными, полярными и неполярными, заряженными положительно и отрицательно и т.д. Особенности радикалов, их число и расположение оказывают существенное влияние на структуру, химические и физические свойства полипептидов. Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах. Это зависит от рН раствора и от того, какая аминокислота: нейтральная, кислая или основная. ПептидыПептиды — органические вещества, состоящие из остатков аминокислот6, соединенных пептидной связью.Образование пептидов происходит в результате реакции конденсации аминокислот (рис. 256). При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой, между ними возникает ковалентная азот-углеродная связь, которую называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пепти- д 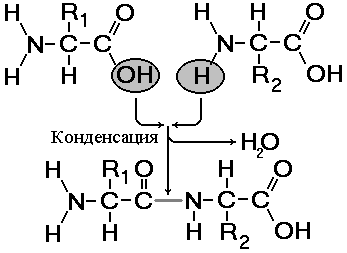 Рис. 256. Образование дипептида. а, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце молекулы находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом). В широком смысле пептиды и белки — одно и то же. В более узком — пептидами называют олигопептиды, содержащие до 10 остатков аминокислот, белками же называют полипептиды, состоящие из более чем 10 остатков. Структура белковой молекулыВыполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул. Кроме того, клетке энергетически невыгодно держать белки в развернутой форме — в виде цепочки. Поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Образование компактных конформаций возможно благодаря возникновению внутримолекулярных и межмолекулярных связей (прежде всего водородных), возникающих между различными группировками аминокислотных остатков полипептидных цепей, а также в результате гидрофобных взаимодействий между неполярными радикалами. Выделяют 4 уровня пространственной организации белков (рис. 257).Первичная структураПод первичной структурой белка понимают последовательность расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка.Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером с 1944 по 1954 год. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии. В 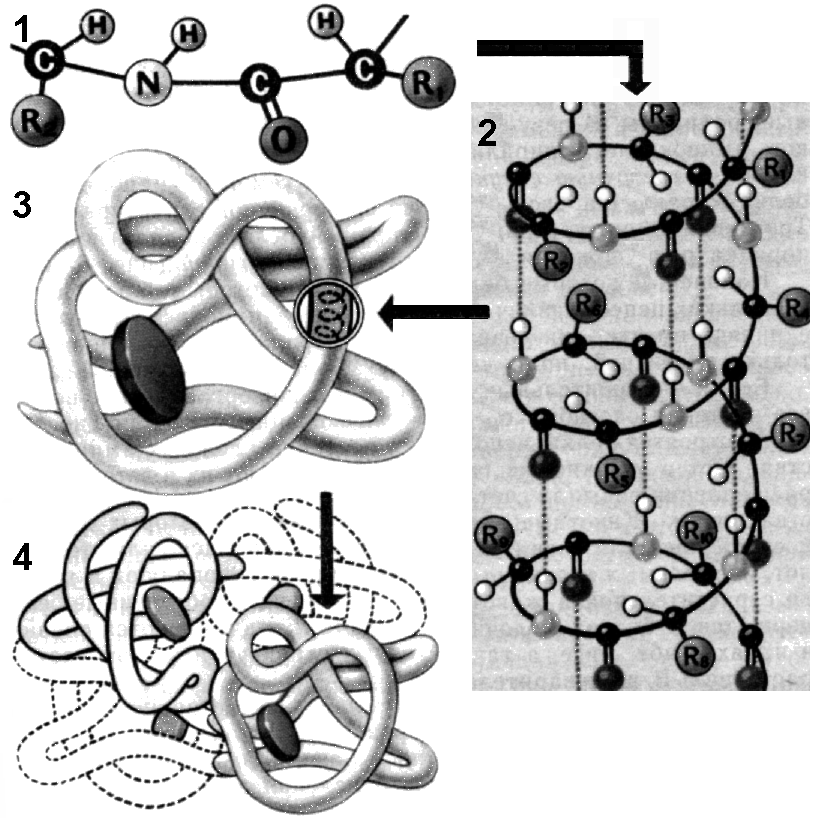 Рис. 257. Структура белковой молекулы: 1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная структуры. организме человека обнаружено порядка 10 тыс. различных белков, которые отличаются как друг от друга, так и от белков других организмов. Имея всего лишь 20 аминокислот, можно составить из них огромное количество самых разнообразных комбинацией. Так, если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислотных остатков. И 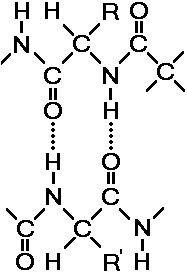 Рис. 258. Водородные связи. менно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Вторичная структураЛишь незначительное количество белков имеет строго линейную структуру. Основная масса белков подвергается дальнейшей укладке, что приводит к образованию вторичной структуры белковой молекулы. Вторичной структурой называют упорядоченное свертывание полипептидной цепи. Основным вариантом вторичной структуры является -спираль, имеющая вид растянутой пружины. Она образована одной полипептидной цепью в результате возникновения внутримолекулярных водородных связей между карбоксильными группами и аминогруппами, расположенными на соседних витках спирали (рис. 258). Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. Третичная структураБольшинство полипептидных цепей приобретает вид компактной глобулы. Третичная структура — это способ укладки полипептидных цепей глобулярных белков, возникающий в результате образования изгибов, приводящих к наложению одних участков спирали на другие, и определенных взаимодействий между этими участками. При образовании третичной структуры происходит сшивание участков в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между боковыми цепями аминокислотных остатков.О 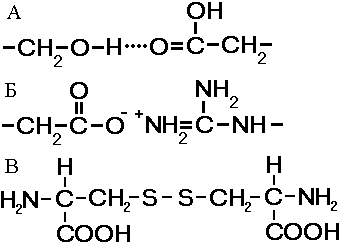 Рис. 259. Связи, стабилизирующие третичную структуру: А — водородные, Б — ионные, В — дисульфидные. сновную роль в образовании третичной структуры играют гидрофобные взаимодействия, так как во многих белках приблизительно половина аминокислотных остатков имеет гидрофобные боковые цепи (рис. 259). Поэтому в водных растворах эти цепи стремятся спрятаться от воды, группируясь внутри, в то время как гидрофильные цепи в результате гидратации (взаимодействие с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется ди- сульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. Третичная структура специфична для каждого белка. Четвертичная структураЧетвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. В одних белках субъединицы одинаковы или имеют сходное строение, в других различны. Однако они всегда образуют единое целое и располагаются в молекуле симметрично.Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя -субъединицами (141 аминокислотный остаток) и двумя -субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо. Классификация белковОбычно белки классифицируют по отдельно взятым признакам.По химическому составу различают:
По форме молекулы различают:
Денатурация и ренатурация белковВнешние факторы (изменение температуры, солевого состава среды, рН, радиация) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией (рис. 260). Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Причем первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Вместе с тем, денатурация не сопровождается разрушением полипептидной цепи. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.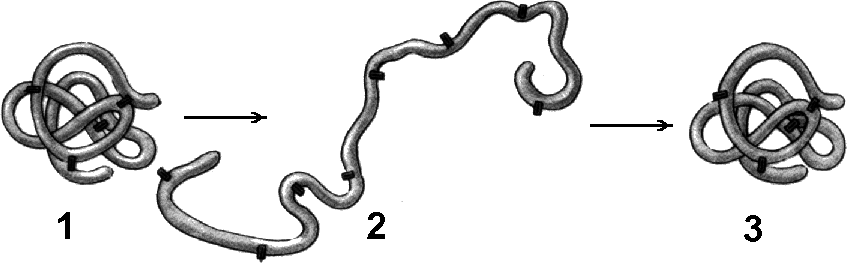 Рис. 260. Денатурация и ренатурация белка: 1 — молекула белка третичной структуры; 2 — денатурированный белок; 3 — восстановление третичной структуры в процессе ренатурации. Денатурация может быть:
Если белок подвергся обратимой денатурации, то при восстановлении нормальных условий среды он способен полностью восстановить свою структуру и, соответственно, свои свойства и функции. Процесс восстановления структуры белка после денатурации называется ренатурацией. Функции белковБлагодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом. Функции их разнообразны.Строительная (структурная) функцияОдна из важнейших — строительная. Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран, шерсти, волос, сухожилий, стенок сосудов и т.д.Транспортная функцияНекоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например, белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.Регуляторная функцияБольшая группа белков организма принимает участие в регуляции процессов обмена веществ. Такими белками являются гормоны — биологически активные вещества, выделяющиеся в кровь железами внутренней секреции. Они влияют на активность ферментов, тем самым, замедляя или ускоряя обменные процессы, изменяют проницаемость клеточных мембран, поддерживают постоянство концентрации веществ в крови и клетках, участвуют в процессах роста, размножения и т.д. Например, гормон инсулин регулирует уровень сахара в крови путем повышения проницаемости клеточных мембран для глюкозы, способствует синтезу гликогена, увеличивает образование жиров из углеводов.Защитная функцияВ ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Синтез этих белков, называемых иммуноглобулинами, происходит в лимфоцитах. Причем, практически на любой антиген, с которым клетка и организм никогда не встречались, лимфоциты способны синтезировать антитела. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.Двигательная функцияОсобые сократительные белки участвуют во всех видах движения клетки и организма: образовании псевдоподий, мерцании ресничек и биении жгутиков у простейших, сокращении мышц у многоклеточных животных, движении листьев у растений и др.Сигнальная функцияВесьма важна для жизни клетки сигнальная функция белков. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.Запасающая функцияБлагодаря белкам в организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина железо не выводится из организма, а сохраняется в селезенке, образуя комплекс с белком ферритином. К запасным белкам относятся белки яйца, белки молока.Энергетическая функцияБелки являются одним из источников энергии в клетке. При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются тогда, когда другие (углеводы и жиры) израсходованы.Каталитическая функцияОдна из важнейших функций белков. В состав клеток входит большое количество веществ, химически мало активных. Тем не менее, все биохимические реакции протекают с огромной скоростью, благодаря участию в них биокатализаторов — ферментов — веществ белковой природы.Общая характеристика ферментовКак отмечалось ранее, большинство химических реакций в организме протекает с участием катализаторов — ферментов. Ферменты7 — специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов.Сходство ферментов и неорганических катализаторов заключается в том, что они:
Но, поскольку ферменты являются белками, это придает им особые свойства:
Известно более 2000 различных ферментов, представленных белками с высокой молекулярной массой, например каталаза (М=252000). Строение ферментовНесмотря на большое количество и разнообразие ферментов, все их по особенностям строения молекул можно разделить на две группы:
У двухкомпонентных ферментов, помимо белковой части, имеется добавочная группа небелковой природы — кофактор, например многие витамины. В молекуле ферментов выделяют особую часть, представляющую собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Ее называют активным центром фермента. Именно эта часть фермента вступает в контакт с субстратом. Поскольку аминокислотные остатки, образующие каталитический центр, расположены в различных участках полипептидной цепи, он возникает только тогда, когда белковая молекула приобретает характерную для нее третич- ную структуру (рис. 261). Если под влиянием каких-либо факторов происходит изменение третичной структуры фермента, то, как правило, это приводит к деформации каталитического центра и изменению ферментативной активности. Свойства ферментовФерменты как биологические катализаторы белковой природы обладают рядом важных свойств:
Механизм действия ферментовФерментативные реакции протекают в несколько этапов:
С 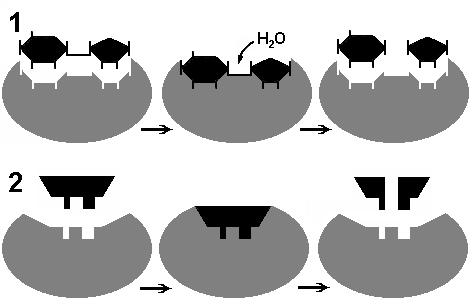 Рис. 262. Соответствие фермента и субстрата: 1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки". огласно гипотезе, выдвинутой в 1890 г. Э. Фишером, субстрат подходит к ферменту, как ключ к замку, то есть пространственные конфигурации активного центра фермента и субстрата точно соответствуют друг другу. Субстрат сравнивается с "ключом", который подходит к "замку" — ферменту. В 1959 году Д. Кошланд выдвинул гипотезу, по которой пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу называют гипотезой "руки и перчатки" (гипотезой индуцированного соответствия) (рис. 262).
Поскольку все ферменты являются белками, их активность наиболее высока при физиологически нормальных условиях:
|