химия. Пояснительная записка государственная итоговая аттестация по химии в 11х классах общеобразовательных учебных заведений проводится в письменной форме
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Сборник заданий для государственной итоговой аттестации по химии для 11 классов профильный уровень 2015 год  ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Государственная итоговая аттестация по химии в 11-х классах общеобразовательных учебных заведений проводится в письменной форме. Задания составлены согласно действующих программ по химии для общеобразовательных учебных заведений. Каждый ученик, проходящий ГИА по химии, получает индивидуальный вариант работы в виде билета, бланк ответов, подготовленный учебным заведением и листочки для выполнения работы со штампом учебного заведения. Выбор варианта билета осуществляется путём случайного выбора номерков от 1 до 20. Каждый вариант содержит задания из трёх тематических блоков: «Общая химия»: основные понятия и законы химии; растворы; периодический закон и периодическая система химических элементов Д.И.Менделеева, химическая связь. «Неорганическая химия»: - основные классы неорганических соединений; - металлические элементы; - неметаллические элементы. ІІІ «Органическая химия»: - углеводороды; - оксигенсодержащие органические соединения; - нитрогенсодержащие органические соединения; - синтетические высокомолекулярные вещества. Каждый вариант состоит из четырех частей, отличающихся степенью сложности заданий. В каждой части приведены задания разной формы. Профильный уровень предусматривает выполнение заданий частей І, III, IV, на выполнение которых отводится 120 минут. Уровень стандарта предусматривает выполнение заданий частей І, ІІ, на выполнение которых отводится 90 минут. * Задания № 1.1-1.10, 2.1-2.3, 3.1-3.6, 4.1 предусматривают выбор одного правильного ответа из четырёх предложенных. Задание считается выполненным правильно, если в бланке ответов указано только одна буква, соответствующая правильному ответу. Задание оценивается в один балл * В заданиях № 1.11, 1.12, 3.7 предусматривается выбор нескольких правильных ответов из пяти предложенных. Правильное выполнение каждого задания оценивается в два балла; нахождение только одного правильного ответа оценивается в один балл. * В заданиях № 1.13, 3.8, 3.9, требуется установить соответствия. Для каждого из заданий, обозначенных буквами, необходимо подобрать один правильный вариант ответа, обозначенный цифрой; записать цифры в таблицу, прилагающуюся каждому заданию, и перенести их в бланк ответов. В каждом из заданий необходимо установить по четыре соответствия из четырёх или пяти возможных. Правильное установление всех соответствий оценивается в два балла. За меньшее количество правильных ответов баллы не насчитываются! * Задания № 1.14, 3.10, 4.2, требуют определения правильной последовательности. Необходимо разместить определённые действия (понятия, формулу, характеристики) в правильной последовательности, записать соответствующие буквы в таблицу, прилагающуюся к каждому заданию, и перенести их в бланк ответов. К каждому из заданий необходимо определить правильную последовательность из четырёх элементов. Правильное выполнение заданий оценивается в два балла; определение последовательности из двух или трёх элементов – в один балл . За меньшее количество правильных элементов последовательности баллы не насчитываются! * Задания № 1.15, 1.16, 2.4, 2.5, 3.11 -3.14, 4.3 требуют развернутого ответа: ученик должен непосредственно выполнить указания к заданию, решить расчетную задачу. Задание считается выполненным правильно, если ученик привел полную запись решения задания или задачи. Правильное решение этих заданий оценивается соответственно таблице 1: 1
Таблица 2. Критерии оценивания задания 1.15
Таблица 3. Критерии оценивания задания 3.11
Если ученик правильно записал формулы для вычисления, но допустил математические ошибки, то такое задание считается выполненным частично правильным и не оценивается максимальным количеством баллов. Сумму баллов, насчитанную за все правильно выполненные учеником задания, переводят в оценку по 5-балльной системе оценивания учебных достижений учеников по таблице 8.
Бланк ответов содержит специально отведенную часть для внесения изменений в ответы такие исправления не ведут к потери баллов. Если же исправления внесены в основную часть бланка ответов, то баллы за такое задание не насчитываются. Вовремя проведения ГИА по химии ученикам запрещается пользоваться какими-либо материалами или пособиями, кроме таблиц: - « Периодическая система химических элементов Д.И.Менделеева»; - «Растворимость кислот, солей , оснований и амфотерных гидроксидов в воде»; - «Ряд активности металлов». Данные таблицы должны быть приложены в качестве дополнительного материала к билетам № 1-16. Вариант 1 Часть первая В заданиях № 1.1-1.10 выберите правильный, по вашему мнению, ответ и отметьте его в бланке ответов. 1.1. Укажите правильное окончание утверждения: « Относительная атомная масса-это…» А число, которое показывает, во сколько раз масса данного атома больше 1/12 массы атома Водорода; Б число, которое показывает, во сколько раз масса данного атома меньше 1/12 массы атома Углерода; В число, которое равно 1/12 массы атома Углерода-12; Г число, которое показывает, во сколько раз масса данного атома больше 1/12 массы атома Углерода-12;. 1.2. Укажите основной оксид: A СaO: Б Al2O3: В ZnO: Г CO. 1.3. Укажите уравнение качественной реакции на хлорид-ионы: A Cl- + H + = HCl Б Ba2+ + 2 Cl- = BaCl2  В Ag+ + Cl- = AgCl↓ В Ag+ + Cl- = AgCl↓ Г Na+ + Cl- = NaCl/ 1.4. Назовите самый распространенный металлический элемент на земле: A Na; Б Cu;  В Fe; В Fe;Г Al. 1.5. Определите тип химической связи в молекуле S8: А ковалентная полярная; Б ионная; В ковалентная неполярная; Г металлическая. 1.6. Укажите вещество, которое имеет молекулярную кристаллическую решетку: А графит; Б глюкоза; В калия бромид; Г силиций (IV) оксид. 1.7. укажите металл, который не взаимодействует с водой: А Ag; Б Fe; В Cu; Г Li. 1.8. Укажите общую формулу гомологического ряда алканов: А CnH2n+2 Б CnH2n В CnH2n-2 Г CnH2n-6. 1.9. Укажите тип реакции, с помощью которой получают капрон: А полимеризация; Б поликонденсация В соединения; Г дегидротация. 1.10. Укажите основной недостаток природного каучука: А эластичность; Б термолабильность; В хрупкость; Г влагонепроницаемость. В заданиях №1.11-1.12 выберите несколько правильных. по вашему мнению, ответов и отметьте их в бланке ответов. 1.11 Укажите электролиты: А NaOH; Б C2H5OH; В NaNO3 Г H2O Д O2 1.12. Укажите вещества, которые являются гомологами: А CH3CH2CH2COOH Б CH3CH2CHO В HCOOH Г HOOCCH2CH2COOH Д CH3COOCH3 1.13. Установите соответствие между реагентами и продуктами реакций: Реагенты: Продукты реакций: А CH4 + Cl2 → 1 CHCl=CHCl Б CH2= CH2 + Cl2 → 2 CH3Cl + HCl В CH3- CH3 + Cl2 → 3 CH2Cl – CH2Cl Г CH≡ CH + Cl2 → 4 CH3- CH2Cl 5 CH3 – CH2Cl +HCl В задании 1.14 расположите определенные действия (понятия, формулы, характеристики) в правильной, по вашему мнению, последовательности перенесите ее в бланк ответов 1.14. Расположите соединения в ряд по увеличению размера их молекул: А глюкоза; Б целлюлоза; В крахмал; Г сахароза. Задания № 1.15 – 1.16 предусматривают непосредственное выполнение задания, решение задач. 1.15. Составьте уравнения реакций в молекулярной и ионных формах: Сульфатная кислота + натрий гидроксид → . 1.16. К раствору массой 150 грамм с массовой долей сахарозы 2% добавили сахарозу массой 20 грамм. Вычислите массовую долю растворенного вещества в полученном растворе. Часть третья В заданиях 3.1 – 3.6 выберите правильный, по вашему мнению, ответ и отметьте его в бланке ответов. 3.1.Электронная формула данного элемента имеет вид 1S22S22P63S13P3. Этот атом : А находится в невозбужденном состоянии; Б принадлежит к S –элементам; В имеет 3 неспаренных электрона в невозбужденном состоянии; Г находится в возбужденном состоянии. 3.2.Укажите вещество, с которым фосфор не реагирует: А Zn; Б Cl2; В HCl; Г O2. 3.3. Укажите промышленный способ получения негашеной извести: А термическое разложение известняка; Б термическое разложение гашеной извести; В сжигание кальция; Г термическое разложение кальций нитрата. 3.4. Укажите значение, которое соответствует углу между гибридными орбиталями атома углерода в молекуле этена: А 109◦ 28' Б 120◦ В 180◦ Г 90◦ 3.5. Укажите промышленный способ получения этанола: А восстановление этаналя; Б гидролиз эстеров; В гидролиз этеров; Г гидратация этена; 3.6. Укажите правильное окончание утверждения «Особенностью метановой кислоты является ее взаимодействие с …»: А металлами; Б аммиачным раствором аргентум (І) оксида; В щелочами; Г основными оксидами. В задании № 3.7. выберите несколько правильных, по вашему мнению, ответов и отметьте их в бланке ответов. 3.7. Укажите продукты реакции разложения аргентум нитрата, которые пропущены в схеме: AgNO3 А AgNO3 Б Ag В NO2 Г NO Д N2 В заданиях №3.8-3.9 к каждому из заданий обозначенных буквой подберите правильный вариант ответа, обозначенный цифрой. Перенесите последовательность цифр в бланк ответов. 3.8. Установите соответствие между реагентами и продуктами реакций: Реагенты: Продукты реакций: А HCOOH +Ag2O Б HCOOH + Zn → 2 CO2↑ + H2O + Ag В HCOOH + Na2CO3 → 3 HCOONa + CO2 ↑+ H2O Г HCHO + Ag2O 5 HCOONa + H2O 3.9. Установите соответствие веществ и условий буквам в схеме превращений: 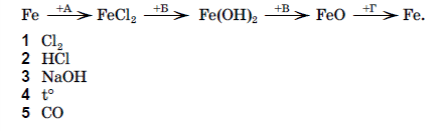 В задании 3.10 расположите определенные действия (понятия, формулы, характеристики) в правильной, по вашему мнению, последовательности перенесите ее в бланк ответов 3.10. Установите последовательность увеличения количества неспаренных электронов на внешнем энергетическом уровне атомов в возбужденном состоянии: А S; Б P; В Cl; Г C. Задания № 3.11 – 3.14 предусматривают непосредственное выполнение заданий, решение задач. 3.11. Составьте уравнение реакции, коэффициенты подберите методом электронного баланса: Fe + Cl2 → … 3.12. Составьте уравнения реакций по данной схеме: 3.13. Составьте уравнения реакций по данной схеме: 3.14. Для взаимодействия с трехвалентным металлом массой 8,1 грамма понадобился раствор массой 450 грамм с массовой долей HCl 7,3 %. Определите металл. | ||||||||||||||||||||||||||||||||||||||||||||||||||||
