практикум строев. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
|
После этого смесь в пробирках снова встряхивают и отмечают помутнение раствора. В каждую пробирку добавляют по 2 мл этилового спирта и оценивают степень мутности проб. Оформление работы. Результаты оформить в виде таблицы, отмечая степень мутности раствора до и после добавления этилового спирта по пятибальной шкале: 1 – отсутствие помутнения, 2 – слабое, 3 – умеренное, 4 – сильное, 5 – очень сильное.
В выводе отметить ИЭТ казеина и возможность ее практического использования для выделения этого белка. Практическое значение работы. Нахождение изоэлектрической точки для индивидуальных белков позволяет подобрать условия для осаждения их из биологических экстрактов, содержащих смесь разных белков, и при очистке белковых препаратов в фармации. Работа 6. Исследование денатурации белковВещества, нарушающие структурную организацию белковой молекулы (т.е. четвертичную, третичную и даже вторичную структуры), приводят к изменению физико-химических и биологических свойств белка. Это явление называется денатурацией. Денатурирующие факторы делятся на химические, физические и биологические. Наиболее обширны группы химических факторов (кислоты, тяжелые металлы, алкалоиды, поверхностно-активные вещества и т.д.) и физических факторов (температура, ионизирующая радиация, ультразвук и т.д.). Биологическую денатурацию могут вызвать протеолитические ферменты (например, трипсин), которые разрушают высшие уровни организации молекулы белка перед тем, как гидролизовать ее пептидные связи. Денатурация изменяет физико-химические свойства белка, в частности, его растворимость. При этом белок становится менее гидрофильным и легко осаждается. Денатурация чаще всего необратима, но в ряде случаев удаление денатурирующих агентов приводит к восстановлению исходной конформации молекулы белка и его природных свойств – ренатурация. Реактивы. Азотная кислота, конц.; сульфат меди, 5%-ный раствор; сульфат свинца, 5%-ный раствор; трихлоруксусная кислота, 10%-ный раствор; хлорная кислота, 10%-ный раствор; этиловый спирт, 96%-ный; ацетон. Оборудование. Штатив с простыми пробирками; пипетки; водяная баня. Материал. Раствор яичного белка (приготовление см. работу 1). а. Денатурация белка концентрированными минеральными кислотами. Метод основан на способности минеральных кислот вызывать нейтрализацию зарядов и разрушение пространственной структуры белка, что приводит к его денатурации и осаждению. Ход определения. В пробирку наливают 10 капель концентрированной азотной кислоты и осторожно, держа пробирку под углом 45˚, наслаивают на кислоту 5 капель раствора яичного белка. Отметить изменения на границе двух слоев жидкостей (кольцо денатурированного белка). б. Денатурация белка органическими кислотами. Метод основан на способности органических кислот нейтрализовать заряд молекулы белка и разрушать ее пространственную структуру, что приводит к денатурации и осаждению белка. Ход определения. В две пробирки наливают по 10 капель раствора яичного белка. Добавляют в одну из них 2 капли трихлоруксусной кислоты, а в другую – 2 капли хлорной кислоты, отмечают произошедшие изменения. в. Денатурация белка солями тяжелых металлов. Метод основан на связывании ионов тяжелых металлов с функциональными группами боковых радикалов аминокислот в молекулу белка, в результате чего разрушается ее пространственная структура и происходит осаждение денатурированного белка. При добавлении избытка солей тяжелых металлов (кроме AgNO3 и HgCl2) происходит растворение первоначально образующегося осадка из-за адсорбции иона металла и приобретении вследствие этого белковой молекулой положительного заряда. Ход определения. В две пробирки вносят по 10 капель раствора яичного белка. В первую из них добавляют 1-2 капли раствора сульфата меди, а во вторую – 1-2 капли раствора ацетат свинца. Наблюдают за выпадением осадка белка. Прибавляют в каждую из пробирок по несколько капель соответствующего осадителя и наблюдают за растворением осадка. г. Денатурация белка органическими растворителями. Метод основан на способности органических растворителей (спирт, хлороформ) нарушать гидрофобные взаимодействия внутри белковой молекулы и вызывать ее денатурацию, что приводит к снижению растворимости и выпадению денатурированного белка. Ход определения. В три пробирки наливают по 10 капель раствора белка и добавляют равные объемы органических растворителей: в первую – этиловый спирт, во вторую – ацетон, в третью – хлороформ. Наблюдают за выпадением белка. Оформление работы. Особенности действия денатурирующих веществ указать в протоколах по каждой реакции осаждения. В выводах отметить причину денатурации белка. Практическое значение работы. Явление денатурации белков используется в клинике, фармации и биохимических исследованиях: а) для осаждения белка в изучаемом биологическом материале с целью дальнейшего определения в нем низкомолекулярных субстратов; б) для выявления присутствия белка в различных биологических экстрактах и жидкостях и количественного его анализа (в частности, качественное и количественное определение белка в моче основано на реакции денатурации белка азотной кислотой); в) для связывания солей тяжелых металлов белком при лечении отравлений или их профилактике на производстве; г) для обеззараживания отходов в санитарно практике; д) для дезинфекции кожи и слизистых покровов. Работа 7. Исследование высаливания белков (на примере белков сыворотки крови) Высаливание – процесс осаждения белков солями щелочных и щелочно-земельных металлов, который является обратимым и сохраняет нативные свойства белков. Высаливание можно проводить не только солями щелочных и щелочно-земельных металлов (Na2SO4, NaCl, KCl, MgSO4, MgCl2 и др.), но и нейтральными солями, например (NH4)2SO4. Все вещества этого типа нейтрализуют заряд белковых частиц и вызывают их дегидратацию, что ведет к осаждению белка. При растворении осажденного белка в воде происходит восстановление его исходных физико-химических и биологических свойств. Белки отличаются друг от друга зарядом и гидрофильностью, поэтому можно разделить белки, используя для их осаждения разные концентрации солей или органических растворителей в среде. Реактивы. Сульфат аммония, насыщенный раствор; сульфат аммония, кристаллический, тонко измельченный; биуретовый реактив*. Оборудование. Штатив с пробирками; пипетки; воронки для фильтрования; бумажные фильтры. Материал. Сыворотка крови. Метод основан на способности сульфата аммония нейтрализовывать заряд молекул белков и вызывать их дегидратацию, что приводит к осаждению белка (высаливанию); при полунасыщении осаждаются глобулины, а при полном насыщении – альбумины сыворотки крови. Это связано с тем, что глобулины менее гидрофильны и имеют большую молекулярную массу, чем альбумины. Ход определения. В пробирку вносят 20 капель сыворотки крови и добавляют равный объем насыщенного раствора сульфата аммония (получается полунасыщенный раствор). Выпадает осадок глобулинов. Через 5 мин осадок отфильтровывают. К фильтрату прибавляют тонко измельченный порошок сульфата аммония до тех пор, пока он не перестает растворяться (полное насыщение). Выпадает осадок альбуминов. Осадок отфильтровывают. Фильтрат проверяют на отсутствие белка, проделывая биуретовую реакцию (см. работу 1). Оформление работы. Результаты оформить в виде таблицы:
В выводе указать на возможность разделения белков методом высаливания, принцип его и отличия от осаждения путем денатурации. Практическое значение работы. Метод высаливания используют в клинических лабораториях для разделения альбуминов и глобулинов и определения их соотношения в сыворотке крови. Осажденную фракцию белка можно отделить центрифугированием, растворить и количественно определить содержание ее с помощью различных методов. В норме соотношение альбумин/глобулин в сыворотке крови человека колеблется в пределах 1,5-2,3 и может меняться при патологии, например, при воспалительных заболеваниях, когда увеличивается содержание глобулинов. Высаливание применяют также для очистки и получения кристаллических препаратов белков. 3. Количественный анализ белков Для количественного определения белков в биологическом материале или лекарственных препаратах чаще всего употребляются азотометрия, фотоколориметрия, фотонефелометрия и спектрофотометрия. Азотометрия основана на определении содержания азота белка после минерализации исследуемого образца. Поскольку белки содержат в среднем 16% азота, то найденное количество его умножают на 6,25 (так как 100:16=6,25) и получают содержание белка в пробе. Эти методы (к ним относится классический метод Кьельдаля и его модификации) очень трудоемки и не всегда надежны, так как процентное содержание азота в разных белках колеблется от 14 до 19. Фотоколориметрические методы основаны на так называемых «цветных» реакциях на функциональные группы белков. Среди них наибольшее применение нашли биуретовая реакция на пептидные группы и реакция Фолина на ароматические радикалы аминокислот (тирозин, триптофан). Биуретовый метод более специфичен, так как пептидные связи имеются только в белках и пептидах. Он широко применяется в клинико-биохимических исследованиях. Метод Лоури, основанный на реакции Фолина, высокочувствительный, но малоспецифичный, поскольку сходную окраску дают свободные ароматические аминокислоты и многие другие соединения, содержащие фенольную группу. Фотонефелометрические методы определения содержания белка основываются на оценке степени мутности его взвеси в растворах. Эти методы не получили широкого распространения. Спектрофотометрические методы делятся на прямые и косвенные. Последние представляют собой боле чувствительный и точный вариант фотоколориметрического. После проведения цветной реакции на белки проводят спектрофотометрию окрашенного раствора и по светопоглощению его в монохроматическом свете рассчитывают содержание белка. Прямой метод состоит в измерении светопоглощения раствора белка в ультрафиолетовой области при 200-220 нм (в этой области абсорбируют пептидные группы белка) и при 280 нм (зона поглощения ароматических радикалов аминокислот, в основном триптофана и тирозина). Эти методы весьма удобны и не требуют предварительного образования окрашенных комплексов. Более специфична спектрофотометрия при 200-220 нм, чем при 280 нм, так как в последнем случае мешает светопоглощение различных низкомолекулярных ароматических соединений, содержащихся в биологическом материале. Работа 8. Количественное определение белка в сыворотке кровиРеактивы. Биуретовый реактив*; хлорид натрия, 0,9%-ный раствор. Оборудование. Микропипетки и пипетки вместимостью 1 и 5 мл; штатив с пробирками; стеклянные палочки; фотоэлектроколориметр (ФЭК); спектрофотометр (СФ). Материалы. Сыворотка крови; альбумин, 10%-ный раствор. а. Биуретовый метод определения содержания белка в сыворотке крови. Метод основан на способности пептидных связей белков и полипептидов образовывать с ионами Cu2+ в щелочной среде комплексное соединение фиолетового цвета, интенсивность окраски которого пропорциональна содержанию белка в среде. Ход определения. Для определения содержания белка в сыворотке крови или в других объектах, содержащих белок, необходимо построить калибровочный график. Для этого применяют стандартный белок – кристаллический альбумин сыворотки крови. Схема разведения альбумина для построения калибровочного графика приведена в таблице:
Из каждой пробирки с разведенным стандартным раствором альбумина берут по 0,1 мл раствора и добавляют по 5 мл биуретового реактива. Содержимое смешивают встряхиванием. Через 30 мин измеряют экстинкцию каждой пробы на ФЭКе против контрольного раствора (0,1 мл 0,9%-ного раствора NaCl + 5,0 мл биуретового реактива) в кювете толщиной 1 см, длина волны 540-560 нм (светофильтр зеленый). По полученным данным строят калибровочную кривую, откладывая по оси ординат значения экстинкции, по оси абсцисс – концентрацию белка. Берут 2 пробирки – в одну наливают 0,1 мл исследуемой сыворотки, в другую (контрольную) – 0,1 мл раствора хлорида натрия. В обе пробирки добавляют по 5 мл биуретового реактива. Содержимое смешивают встряхиванием. Через 30 мин измеряют экстинкцию исследуемого раствора на ФЭКе в кювете толщиной 1 см при длине волны 540-560 нм (зеленый светофильтр) против контрольного раствора. Содержание белка в сыворотке крови находят по калибровочной кривой. б. Спектрофотометрический метод определения содержания белка в сыворотке крови. Метод основан на светопоглощении при 280 нм ароматических радикалов тирозина, триптофана и в меньшей степени фенилаланина, содержащихся в белке. Однако при данной длине волны поглощают и нуклеиновые кислоты, хотя их максимум абсорбции приходится на 260 нм. Поэтому измерение экстинкции раствора проводят при 260 и 280 нм, чтобы сделать поправку на примесь нуклеиновых кислот и нуклеотидов. Метод неприменим к материалу, где содержание нуклеиновой кислоты превышает 20%. Ход определения. В пробирку вносят 0,1 мл сыворотки крови и добавляют 9,9 мл раствора хлорида натрия. Содержимое перемешивают стеклянной палочкой. Измеряют экстинкцию исследуемого раствора против контрольного раствора хлорида натрия на спектрофотометре в кювете толщиной 1 см при двух длинах волн – 260 и 280 нм. Расчет можно проводить по формуле, эмпирически полученной Калькаром (поэтому можно не прибегать к калибровочному графику): х = 1,45Е280 – 0,74Е260, где х – концентрация белка в растворе, г/л. Оформление работы. По калибровочной кривой рассчитать содержание белка. Сравнить результаты, полученные биуретовым методом и спектрофотометрическим. Сделать вывод о наличии отклонения концентрации белка в исследуемой сыворотке крови от нормы и о возможных его причинах. Практическое значение работы. Сыворотка крови содержит смесь белков, различных по физиологическому значению, структуре и физико-химическим свойствам (более 100 различных белков плазмы крови). Нормальное содержание белка в сыворотке крови (нормопротеинемия) составляет 65-85 г/л. Определение общего белка в сыворотке крови находит широкое применение в практической медицине, так как по изменению его нормального содержания можно судить о различных нарушениях в организме. Повышенное содержание белка (гиперпротеинемия) относительно редко: при сгущении крови из-за потери жидкости (длительная рвота, усиленное потоотделение, холера, тяжелые ожоги и т.п.), при некоторых хронических воспалительных процессах вследствие образования антител (ревматизм, полиартрит). Пониженное содержание белка в крови (гипопротеинемия): при недостаточном поступлении белка с пищей (голодание, нарушение проходимости кишечного тракта), при нарушении образования белка в органах (при поражении печени химическими веществами, опухолями, микроорганизмами и т.д.), при потере белка организмом (кровотечения, повышенная проницаемость сосудов, заболевания почек, беременность и т.д.). В фармацевтической практике количественные методы определения белка необходимы для контроля белковых лекарственных средств (вакцин, сывороток, γ-глобулина, белковых препаратов крови и т.д.). 4. Состав и свойства сложных белков Сложные белки являются представителями смешанных макромолекул, которые содержат как минимум два разных химических компонента, соединенных ковалентными или слабыми (ионными, водородными, вандерваальсовыми) связями. К сложным белкам относят кофакторпротеиды (гемпротеиды, хлорофиллпротеиды, флавопротеиды и др.), гликопротеиды и протеогликаны, липопротеиды и протеолипиды, металлопротеиды, фосфопротеиды и нуклеопротеиды. Особенность строения этих макромолекул позволяет использовать при обнаружении и количественном определении их в биологическом материале методы анализа как на белковый фрагмент молекулы, так и на простетическую группу. Поскольку последняя специфична для каждого класса сложных белков, реакции на нее применяются чаще. Работа 9. Химическая природа гемпротеидов К гемпротеидам относят гемоглобин, миоглобин, цитохромы и ферменты – каталазу и пероксидазу. Они состоят из белковой части и гема, представляющего собой тетрапиррольное соединение, связанное с атомом железа (II). При действии на гемоглобин концентрированной уксусной кислоты в присутствии NaCl гем переходит в гемин, в котором железо трехвалентно и его третья валентность связана с хлором. При действии на гемоглобин щелочей гем переходит в гематин, в котором атом железа также трехвалентен, и третья его валентность связана с гидроксильной группой. Гем, входящий в гемоглобин, ускоряет реакцию окисления субстратов (S·H2) пероксидом водорода, т.е. действует подобно ферменту пероксидазе: S·H2 + H2O2 – S + 2H2O. Это объясняется сходством строения простетических групп гемоглобина и пероксидазы. Однако в отличие от фермента гемоглобин сохраняет каталитические свойства при кипячении и действии сильных кислот, которые вызывают денатурацию белка. Если в исследуемом материале содержится кровь, то ее присутствие можно обнаружить по способности геминовой группы катализировать окисление подходящих субстратов (бензидин, гвояковая смола) пероксидом водорода. Реактивы. Пероксид водорода, 3%-ный свежеприготовленный раствор; бензидин, 5%-ный свежеприготовленный раствор в ледяной уксусной кислоте; гваяковая смоляная кислота, 1%-ный раствор на 95%-ном этиловом спирте, свежеприготовленный; азотная кислота, конц.; соляная кислота, не содержащая железа, 10%-ный раствор; гексацианоферрат (II) калия, 2,5%-ный раствор; роданид аммония, 1%-ный раствор; гидроксид натрия, 3%-ный раствор; биуретовый реактив*; ацетон, подкисленный соляной кислотой (3 мл 2 М раствора HCl на 1 л ацетона, рН≈2), охлажденный в холодильнике. Оборудование. Полоски фильтровальной бумаги шириной 1 см; глазные пипетки; пипетки вместимостью 1 и 10 мл; штатив; простые и центрифужные пробирки; водяная и песчаная бани; центрифуга с центрифужными весами; тигель фарфоровый и тигельные щипцы. Материал.
а. Бензидиновая проба на геминовую группу гемоглобина. Метод основан на способности геминовой группы гемоглобина катализировать реакцию окисления бензидина в дифенохинондиимин пероксидом водорода 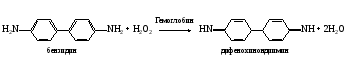 Дифенохинондиимин конденсируется с молекулой неокисленного бензидина с образованием окрашенного комплекса сине-зеленого цвета. Дифенохинондиимин конденсируется с молекулой неокисленного бензидина с образованием окрашенного комплекса сине-зеленого цвета.В пробирку наливают 1 мл цельной крови, разведенной в 5000 раз, кипятят несколько минут на водяной бане, охлаждают и добавляют по 2 капли раствора бензидина и пероксида водорода. Отмечают появление окрашивания. б. Гваяковая проба на геминовую группу гемоглобина. Метод основан на способности геминовой группы гемоглобина катализировать реакцию окисления гваяковой смоляной кислоты пероксидом водорода до ее озонида, окрашенного в синий цвет. Ход определения. В пробирку вносят несколько капель цельной крови (разведенной в 5000 раз) и кипятят ее в течение 1 мин на водяной бане. После охлаждения приливают к пробе 1-2 капли спиртового раствора гваяковой смоляной кислоты и 3 капли раствора пероксида водорода. Отмечают развитие окрашивания. в. Проба с гексацианоферратом (II) калия и роданидом аммония на железо гемоглобина. Метод основан на способности железа, входящего в гемоглобин, образовывать с гексацианоферратом (II) калия в присутствии соляной кислоты сине-зеленое комплексное соединение – берлинскую лазурь: 4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 + 12KCl , гексацианоферрат (II) берлинская калия лазурь а с роданидами – роданид железа розового или красного цвета: FeCl3 + 3NH4CNS → Fe(CNS)3 + 3KCl роданид роданид аммония железа Ход определения. Несколько капель дефибринированной крови помещают в фарфоровую чашечку (тигель) и выпаривают досуха на песчаной бане. Сухой остаток озоляют, добавляют 2-3 капли концентрированной азотной кислоты и продолжают нагревание (под тягой). При этом железо гемоглобина переходит в состав золы. Сухой остаток переносят в пробирку, добавляют 10 капель раствора соляной кислоты до растворения золы. Разливают содержимое примерно поровну в две пробирки. В одну из них добавляют 2 капли раствора гексацианоферрата (II) калия. Наблюдают за появлением характерного окрашивания. Во вторую пробирку приливают 2 капли раствора роданида аммония и отмечают развитие специфического окрашивания. г. Разделение гемоглобина на гем и глобин. Метод основан на способности ацетона, подкисленного соляной кислотой, разрывать связи между гемом и глобином, причем отщепившийся гем растворяется в ацетоне, а глобин выпадает в осадок. Ход определения. В пробирку наливают 10 мл подкисленного ацетона и медленно добавляют 10 капель раствора гемоглобина. Наблюдают появление беловатой взвеси (глобин), которая постепенно оседает. Содержимое пробирки перемешивают стеклянной палочкой, переливают в центрифужные пробирки и центрифугирую при 1500 об/мин в течение 5 мин. После центрифугирования в верхний слой (ацетоновый) осторожно опускают две полоски фильтровальной бумаги и проделывают реакции на наличие геминовой группировки. Для этого на одну полоску наносят по капле бензидина и раствора пероксида водорода (бензидиновая проба), на вторую –по две капли спиртового раствора гваяковой смоляной кислоты и раствора пероксида водорода (гваяковая проба). Отмечают постепенное появление характерного окрашивания на обеих полосках бумаги. Верхний слой жидкости осторожно сливают, а к оставшемуся осадку добавляют 1 мл 3%-ного раствора гидроксида натрия. Перемешивают содержимое и добавляют 10 капель биуретового реактива. Наблюдают появление характерного окрашивания. Оформление работы. Результаты оформить в виде таблицы.
В выводах указать на возможность обнаружения гемоглобина в исследуемом материале с помощью проделанных качественных реакций и разделения его компонентов действием кислых растворов ацетона; отметить значение реакций для практики. Практическое значение работы. Основная часть гемпротеидов крови находится в виде гемоглобина эритроцитов. В сыворотке или плазме крови содержится лишь незначительное количество гемпротеидов, появляющихся при значительном распаде эритроцитов (гемолизе). В сыворотке крови железо находится в виде ферротрансферина, являющегося сложным белком (металлопротеидом), который переносит железо между тканями и органами. Качественные реакции на простетические группы протеидов позволяют выявить структурные компоненты: геминовую группировку и входящее в состав гема железо. Для обнаружения следов крови очень чувствительные бензидиновая и гваяковые пробы используются в клинике и судебно-медицинских исследованиях. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
