Лабораторный практикум. Практикум по курсу химия гетероциклических соединений Лабораторная работа хгс 1 синтез пиррола по кнорру
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
Лабораторная работа ХГС 4СИНТЕЗ 6,7-ДИФТОР-2-МЕТИЛХИНОЛИН- 4-КАРБОНОВОЙ КИСЛОТЫ Теоретическая часть Синтез производных хинолин-4-карбоновой кислоты по Пфитцингеру заключается в щелочном гидролитическом раскрытии пятичленного кольца изатина и последующей конденсации образующегося аниона орто-аминофенилглиоксиловой кислоты с кетонами. 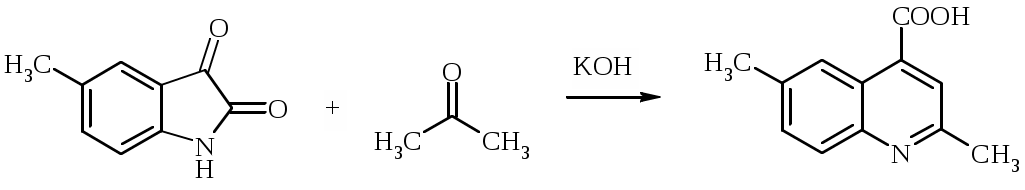 Методика синтеза Исходные вещества: 5,6-дифторизатин, гидроксид калия, ацетон, 10%-ная соляная кислота. К 2.25 г (12.3 ммоль) дифторизатина добавляют раствор 5.5 г (98 ммоль) гидроксида калия в 11 мл воды, перемешивают при температуре 25 0С в течение 5 мин, после чего смесь приобретает зеленый цвет и загустевает. К содержимому колбы добавляют 18 мл ацетона и нагревают 6 часов при температуре 90 0С. После охлаждения реакционной массы проводят нейтрализацию до рН 5−6 добавлением 10%-ной соляной кислоты, выпавший осадок отфильтровывают. Вопросы к коллоквиуму Вопросы по теории: Механизм реакции изатина с карбонильными соединениями в щелочной среде. Различие в реакционной способности двух карбонильных групп в изатине. Электрофильное замещение, протекающее по бензокольцу изатина. Алкилирование по атому азота в присутствии основания. Вопросы по методике синтеза: Почему нельзя допускать превышения установленной температуры при взаимодействии дифторизатина с гидроксидом калия? Техника безопасности при работе со щелочью. Лабораторная работа ХГС 5 СИНТЕЗ 2,3-ДИМЕТИЛИНДОЛА Теоретическая часть В препаративной практике получения индола распространен метод Э. Фишера, который в образовании соединения ряда индола из арилгидразона. 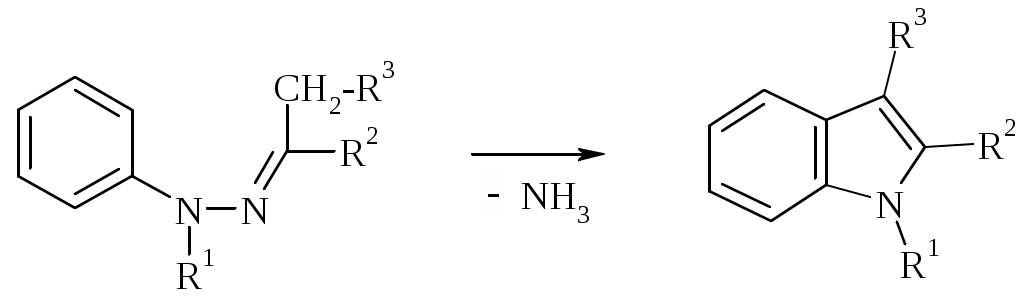 Исходным веществом для незамещенного по положениям 2 и 3 индола служит фенилгидразон пировиноградной кислоты. При действии конденсирующего агента (ZnCl2) происходит образование пиррольного цикла и выделяется молекула аммиака. 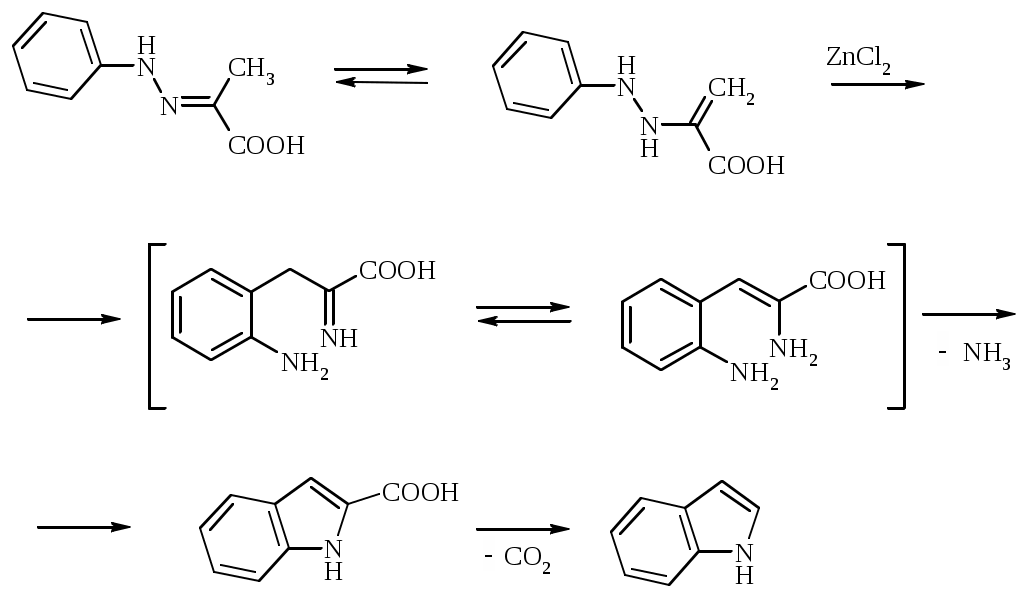 Ключевой стадией процесса является кислотно-катализируемая перегруппировка енгидразинной формы арилгидразона по схеме 3,3-сигматропного сдвига (так называемая 3,4-диазаперегруппировка Коупа). Экспериментами с соединениями, меченными 15N, показано, что при замыкании кольца отщепляется тот атом азота продукта [3,3]-перегруппировки, который не находится непосредственно у ароматического кольца. Образование индола происходит за счет метиленовой группы. Если оба заместителя при углероде N=C связи содержат метиленовую группу, образуется смесь двух продуктов. 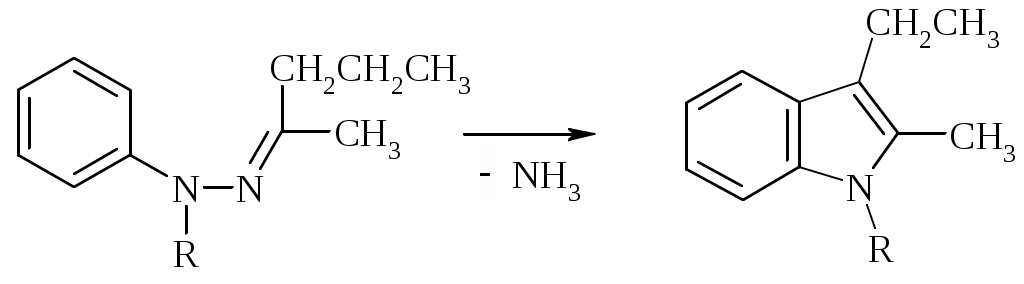 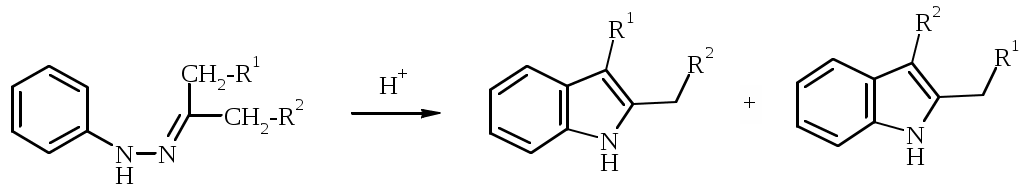 Методика синтеза Исходные вещества: метилэтилкетон, фенилгидразин солянокислый, ледяная уксусная кислота, 10%-ная соляная кислота, диэтиловый эфир, 5%-ный раствор гидроксида натрия. В двугорлую колбу с обратным холодильником и термометром помещают 4,5 г метилэтилкетона, 25 мл ледяной уксусной кислоты и 7,5 г солянокислого фенилгидразина и нагревают до 90 оС. Через 15-20 мин смесь разогревается сама и вскипает. После того как самопроизвольное вскипание прекращается, нагревают еще 30 мин при 90 оС. Смесь охлаждают, выливают на лед (75 г), отфильтровывают, осадок промывают на фильтре 125 мл воды, растворяют в 75 мл эфира. Эфирный раствор промывают 20 мл 10%-ной соляной кислотой, двумя порциями по 20 мл 5%-ного гидроксида натрия и двумя порциями воды по 20 мл. Эфирный экстракт высушивают безводным сульфатом натрия, эфир отгоняют. Вопросы к коллоквиуму Вопросы по теории: Механизм реакции Фишера, зависимость структуры продукта от природы исходных арилгидразина и кетона. Реакции электрофильного замещения в индоле. Другие методы построения индольного кольца. Механизм образования гидразона при кислотном катализе. Биологически важные соединения индольного ряда. Вопросы по методике синтеза: На какой стадии синтеза продукт отделяют от образовавшегося хлорида аммония? Техника безопасности при отгонке диэтилового эфира. Зачем используют промывку раствором соляной кислоты, затем раствором гидроксида натрия? Лабораторная работа ХГС 6 СИНТЕЗ ИНДОЛА Теоретическая часть Одним из методов получения незамещенного индола является внутримолекулярная конденсация формил-о-толуидина в присутствии т-бутоксида калия либо амида натрия.  К такому же результату может привести и внутримолеклярная конденсация других о-замещенных анилинов. 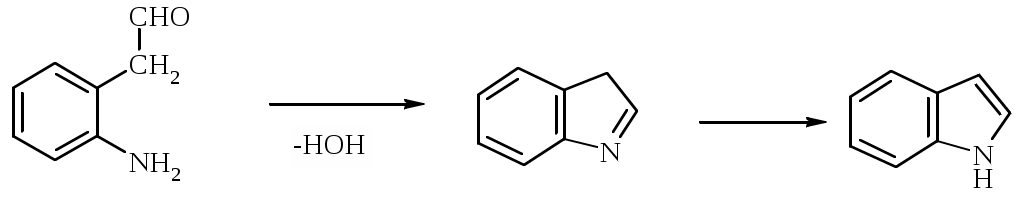 Методика синтеза Исходные вещества: t-бутанол, N-формил-о-толуидин, металлический калий. Трехгорлую круглодонную колбу емкостью 0.5 л снабжают обратным холодильником и стеклянной трубкой для ввода газа, которую присоединяют к баллону с азотом. Третье горло колбы закрыто пробкой. Верхнюю часть холодильника соединяют с ловушкой, которая состоит из двух колб для отсасывания емкостью по 50 мл, соединенных последовательно. Первая колба пуста; вторая содержит 10 мл парафинового масла, причем вводная трубка в этой колбе оканчивается несколько ниже поверхности масла. В реакционную колбу помещают трет-бутиловый спирт (60 мл) и вытесняют из нее воздух сухим азотом. Затем к спирту прибавляют по частям металлический калий (2.9 г). Смесь нагревают на водяной бане до тех пор, пока не растворится весь калий, после чего прибавляют N-формил-о-толуидин (6.8 г) и переводят его в раствор. Обратный холодильник меняют на обращенный вниз; в качестве приемника применяют колбу для отсасывания. Приемник предохраняют от доступа воздуха, соединяя его с ловушкой, которая применялась в начале процесса. Реакционную колбу погружают в металлическую баню и избыток спирта отгоняют. Остаток нагревают около 20 мин. до 350-360 °С (при этом выделяются горючие газы), затем ему дают охладиться в токе азота. Остаток разлагают, прибавляя к нему 30 мл воды, и смесь перегоняют с водяным паром, чтобы отделить индол. Дистиллят экстрагируют последовательно 30 мл и 10 мл эфира и соединенные вместе эфирные вытяжки взбалтывают с холодным разбавленным раствором 5%-ной соляной кислоты для удаления остатков о-толуидина. Эфирные вытяжки промывают 10 мл воды, затем 10 мл 5%-ного раствора соды и сушат над 2 г сернокислого натрия. Эфир отгоняют и остаток перегоняют в вакууме. Индол переходит при 142−144 °С (27 мм рт. ст.) [128 °С (10 мм рт. ст.), 121 °С (5 мм рт. ст.)] в виде бледно-желтого масла, которое затвердевает, а затем плавится при 52−53 °С. Затвердевший индол перекристаллизовывают из смеси 10 мл петролейного и 1 мл диэтилового эфиров. Вопросы к коллоквиуму Вопросы по теории: Строение индола. Механизм циклизации формил-о-толуидина в присутсвии сильного основания. Методы синтеза индола: синтез Рейсерта и Лемгрубера-Бачо Вопросы по методике синтеза: Каким образом вводят газ в органическую реакцию? Как проводят перегонка при пониженном давлении? Как выбирают экстрагент? Техника безопасности при работе с диэтиловым эфиром. Сущность метода перекристаллизации, правила проведения, выбор растворителя для перекристаллизации. Лабораторная работа ХГС 7 СИНТЕЗ 3,5-ДИМЕТИЛПИРАЗОЛА Теоретическая часть Известно несколько общих метода синтеза циклической системы пиразола. Наиболее популярный среди них − реакция гидразина и его производных, например арил- или алкилгидразинов, семикарбазида или аминогуанидина с 1,3-дикарбонильными соединениями. При взаимодействии 1,3-дикарбонильных соединений с гидразингидратом образуется незамещенный по атому азота пиразол. 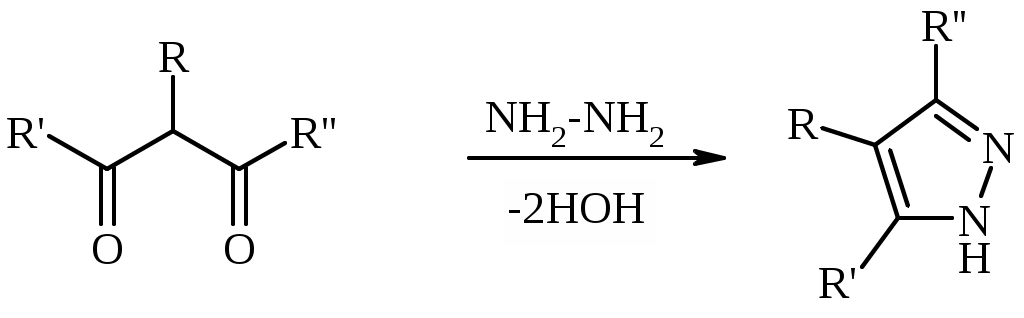 В случае использования фенилгидразина образуется 1-фенил-3,5-диметилпиразол. 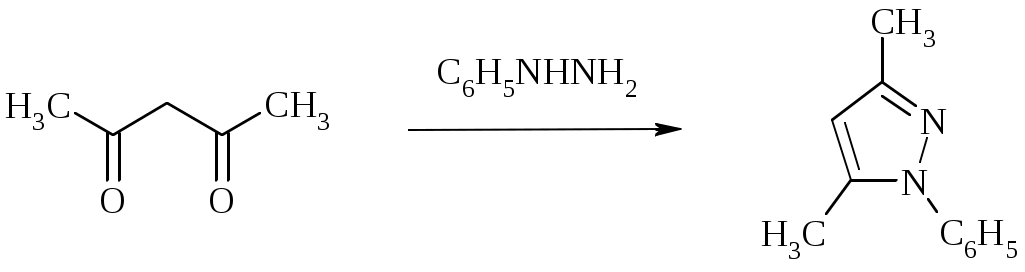 Аналогичен синтез пиразолонов из β-кетоэфиров.  Реакция гидразинов с α,β-ненасыщенными карбонильными соединениями позволяет получать 3,5-дизамещенные пиразолы либо пиразолины. 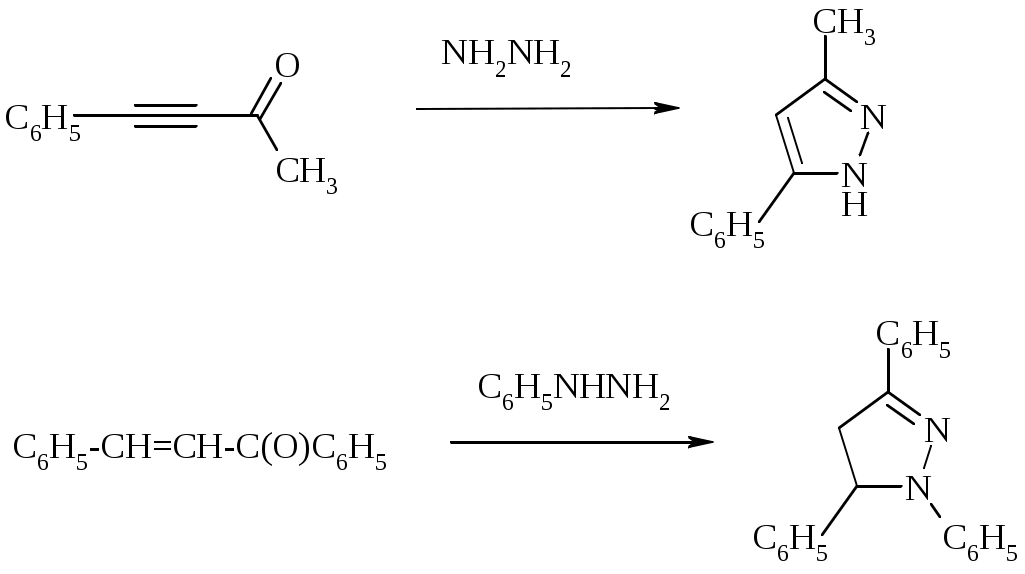 Методика синтеза Исходные вещества: сернокислый гидразин, ацетилацетон. В трехгорлой литровой колбе, снабженной капельной воронкой, термометром и мешалкой (Не допускать герметичности прибора!), готовят раствор сернокислого гидразина (6.5 г) в 40 мл 10%-ного раствора NaOH и, помещая колбу в баню со льдом, охлаждают его до 15° С. Поддерживая эту температуру, к раствору в течение 30 мин прибавляют по каплям ацетилацетон (5 г), после чего смесь перемешивают при 15° С еще 1 ч. Затем прибавляют 20 мл воды для растворения осадка неорганических солей и переносят в литровую делительную воронку, экстрагируя образовавшийся пиразол один раз 13 мл эфира, а затем еще четыре раза порциями по 5 мл. Эфирные вытяжки объединяют, промывают насыщенным раствором NaCI и сушат безводным поташом. После отгонки эфира получают 3,5-диметилпиразол в виде белых или слегка желтоватых кристаллов. Вопросы к коллоквиуму Вопросы по теории: Строение -амфотерных гетероциклов. Методы получения пиразола и имидазола, оксазола и изоксазола. Применение дикарбонильных соединений в синтезе пятичленных гетероциклов. Реакции электрофильного замещения в пиразоле, имидазоле, оксазоле, изоксазоле. Взаимодействие пиразола, имидазола и друних пятичленных гетероциклов с алкилирующими агентами. Вопросы по методике синтеза: Прибор для органического синтеза, работа с капельной воронкой. С какой целью перед выделением 3,5-диметилпиразола в реакционную массу добавляют воду? Как проводится экстракция 3,5-диметилпиразола Какой осушитель применяют для 3,5-диметилпиразола? Как провести отгонку эфира? Лабораторная работа ХГС 8 СИНТЕЗ ДИЭТИЛОВОГО ЭФИРА 2,6-ДИМЕТИЛ- 4-ФЕНИЛПИРИДИН-2,6-ДИКАРБОНОВОЙ КИСЛОТЫ Теоретическая часть Важнейшим препаративным методом синтеза производных пиридина является синтез Ганча, который заключается во взаимодействии -кетоэфиров с альдегидами и аммиаком и последующем окислении образующихся 1,4-дигидропиридинов. Сначала при взаимодействии ацетоуксусного эфира с аммиаком образуется енамин, а с формальдегидом – продукт кротоновой конденсации – ,-непредельный кетон. 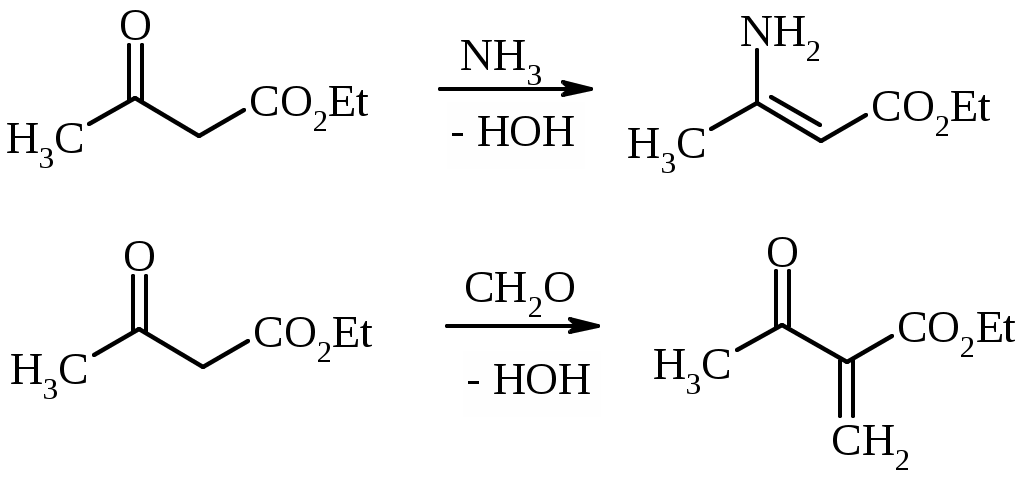 Далее происходит присоединение по Михаэлю енамина к активированной кратной связи непредельного кетона. Цикл замыкается в результате нуклеофильной атаки атома азота по образующейся карбонильной группе. После отщепления молекулы воды образуется производное дигидропиридина, которое окисляют нитрующей смесью либо 20%-ной азотной кислотой. Гидролиз сложноэфирных групп и декарбоксилирование, протекающее при нагревании с СаО, завершает образование 2,6-диметилпиридина. 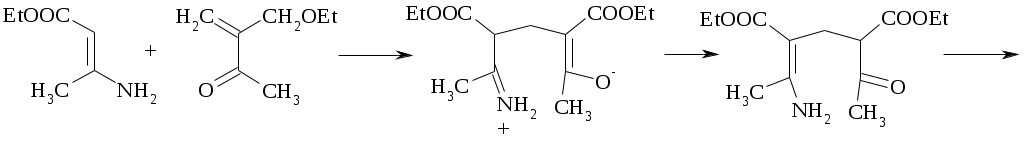 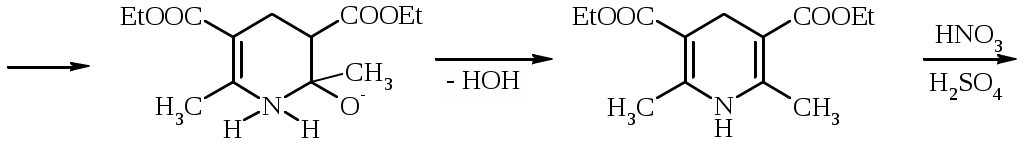 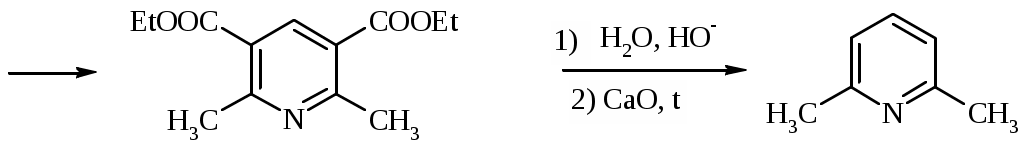 Методика синтеза Исходные вещества: бензальдегид, ацетоусксуной эфир, водный раствор аммиака (25 %), азотная кислота. Стадия 1 В колбу последовательно помещают 25 мл этилового спирта, 2.12 г бензальдегида, 5.21 г этилового эфира ацетоуксусной кислоты и при легком ручном перемешивании прикапывают 1.7 мл 25% раствора аммиака. Колбу закрывают обратным холодильником и кипятят в течение 1 часа. Затем содержимое колбы охлаждают и переносят в стакан со 100 мл ледяной воды. Полученную суспензию оставляют в холодильнике на 30 минут, после чего выпавший осадок отфильтровывают и сушат в сушильном шкафу при 35 0С в течение ночи. Высушенный продукт взвешивают и рассчитывают выход. Стадия 2 ВНИМАНИЕ: ДАННЫЙ СИНТЕЗ ПРОВОДЯТ ПОД ТЯГОЙ! ВЫДЕЛЯЮТСЯ НИТРОЗНЫЕ ГАЗЫ! Полученный дигидропиридин переносят в колбу, содержащую 40 мл 20%-ного раствора азотной кислоты, и кипятят с обратным холодильников в течение 1 часа. Затем раствор охлаждают и нейтрализуют добавлением твердого карбоната натрия до прекращения выделения углекислого газа. Продукт трижды экстрагируют диэтиловым эфиром по 20 мл. Объединенные фракции сушат сульфатом натрия (5 г) и испаряют на воздухе. Остаток растворяют в 5 мл спирта, после чего высаживают 5 мл воды и отфильтровывают. Продукт сушат в сушильном шкафу при 35 0С в течение ночи и определяют выход. Вопросы к коллоквиуму Вопросы по теории: Строение -дефицитных гетероциклов. Синтез пиридина по Ганчу: механизм, зависимость строения пиридина от природы исходных реагентов. Химические свойства пиридина. Влияние природы и положения заместителей на основность пиридина. Вопросы по методике синтеза: Техника безопасности при работе с раствором аммиака и азотной кислотой. Почему для нейтрализации на последней стадии нельзя использовать раствор щелочи? Особенности проведения экстракции диэтиловым эфиром. |
