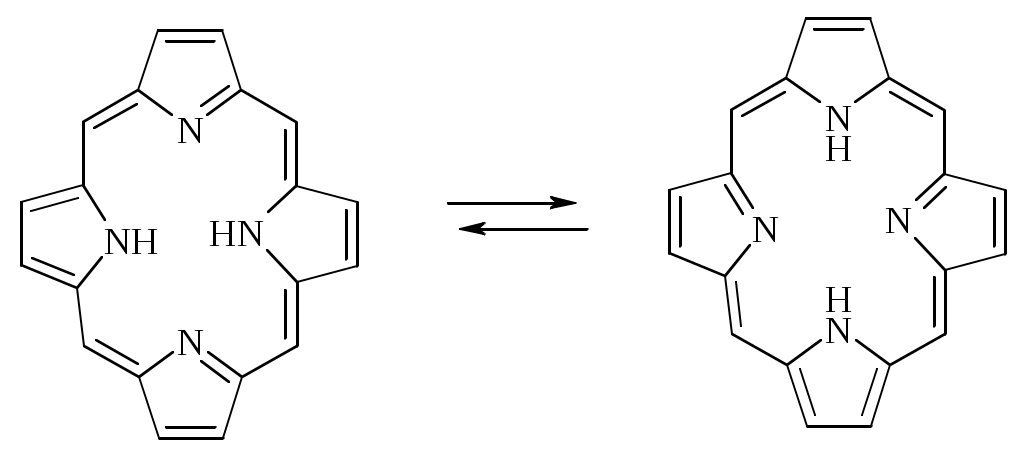
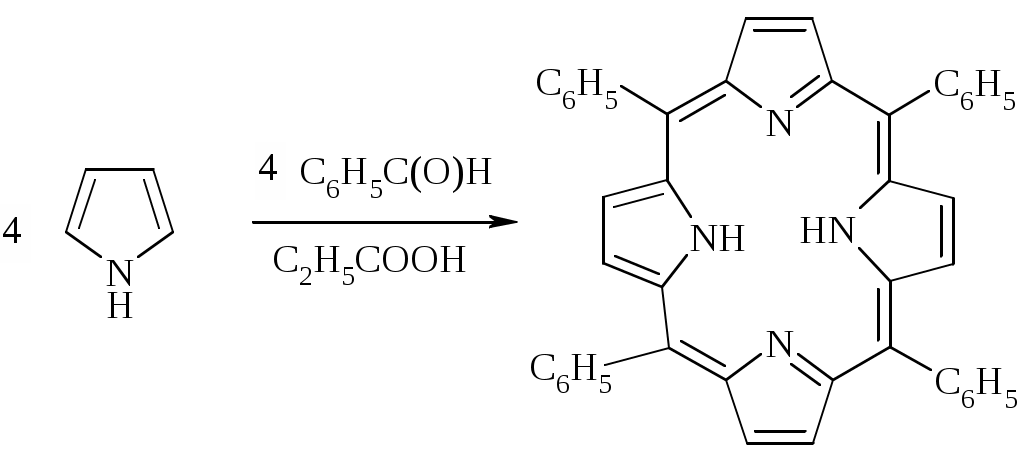
Лабораторный практикум. Практикум по курсу химия гетероциклических соединений Лабораторная работа хгс 1 синтез пиррола по кнорру
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
30−40 мл. Выпавшие фиолетовые кристаллы отфильтровывают, промывают гексаном. Выход сырого продукта 1.22 г (52.5%). По данным тонкослойной хроматографии (силикагель, CH2Cl2-петролейный эфир, 1:1) полученный продукт (Rf 0.29) содержит лишь незначительную примесь с Rf 0.40. Ее можно отделить перекристаллизацией вещества из смеси дихлорметана с метанолом.
50 мл, и остаток выливают в фарфоровую чашку на тщательно перемешанную смесь 10 г силикагеля (40/100 меш) и 2,5 г ВаСО3 (тонко измельченный порошок). Полученную пасту оставляют на ночь сушиться на воздухе. После высушивания она представляет собой темно-серый порошок. Его помещают наверх хроматографической колонки, заполненной смесью, состоящей из 90% силикагеля (40/100 меш) и 10% тонкоизмельченного карбоната бария (толщина колонки 2,8 см, высота слоя наполнителя 40 см). Колонку элюируют смесью дихлорметан-гексан (3:1), вымывая всю фиолетовую зону (перед фиолетовой зоной следует собрать и отбросить небольшой (20 мл) бесцветный предгон). После полного вымывания мезо-тетрафенилпорфирина в хроматографической колонке остается весьма обширная травянисто-зеленая зона, а также небольшая черно-коричневая зона на старте, на что идет Лабораторная работа ХГС 9СИНТЕЗ ХИНОКСАЛИНА Теоретическая часть К бензоаннелированным диазинам относятся циннолин, фталазин, хиназолин, хиноксалин. Хиноксалин представляет собой бензоаннелированный пиразин.  циннолин фталазин хиназолин хиноксалин Важнейший метод получения хиноксалина − конденсация о-фенилендиамина с 1,2-дикарбонильным соединением при нагревании. Для получения хиноксалина, не замещенного по положениям 2 и 3 применяют глиоксаль или его бисульфитное производное.  Методика синтеза Исходные вещества: глиоксаль (30%-ный водный раствор), метабисульфит натрия, о-фенилендиамин. Для получения аддукта глиоксаля с гидросульфитом натрия 30%-ный водный раствор глиоксаля (18 мл) прибавляют к раствору метабисульфита натрия (20.9 г) в 100 мл воды. Смесь нагревают до 70° С, после чего ее приливают к раствору о-фенилендиамина (10.8 г) в 150 мл горячей воды, выдерживают 15 мин, охлаждают до комнатной температуры и подщелачивают раствором карбоната натрия (45 г в 100 мл воды). Продукт реакции экстрагируют эфиром (3×50 мл). Объединенные эфирные вытяжки сушат сульфатом магния и после отгонки эфира остаток (он иногда закристаллизовывается) перегоняют в вакууме. Хиноксалин гонится в виде почти бесцветной жидкости с т. кип. 109-111°С (12 мм рт. ст.), которая затвердевает при охлаждении с образованием напоминающих лед кристаллов. Вопросы к коллоквиуму Вопросы по теории: Строение пиридазина, пиримидина, пиразина и их бензоаннелированных производных. Методы получения циннолина, хиназолина и хиноксалина. Химические свойства хиноксалина и его изомеров (циннолина, хиназолина). Применение производных хиноксалина. Вопросы по методике синтеза: Чем подщелачивают реакционную смесь перед экстракцией? Как проводят экстракцию хиноксалина? Какой осушитель используют для эфирного экстракта хиноксалина? Как проводят отгонку эксрагента? Как перегоняют хиноксалин при пониженном давлении? Лабораторная работа ХГС 10 СИНТЕЗ ПИРАЗИН-2,3-ДИКАРБОНОВОЙ КИСЛОТЫ Теоретическая часть Хиноксалин легко вступает в реакции нуклеофильного присоединения и восстановления.  Электрофильное замещение протекает по бензольному кольцу хиноксалина в жестких условиях, например, нитрование смесью конц. HNO3 и олеума при 90 °С (в течение суток) приводит к образованию смеси 1.5% 5-нитро- и 24% 5,6-динитрохиноксалина.  Хиноксалин инертен к окислению HNO3 и К2Сr2О7, однако окисление КМnО4 в щелочном растворе сопровождается расщеплением бензольного кольца с образованием 2,3-пиразиндикарбоновой кислоты, окисление персульфатом аммония (NH4)2S2O8 дает 2,3-дигидроксихиноксалин (выход 30%).  Хиноксалин легко превращается в N-оксиды, например, окисление 1 эквивалентом надуксусной к-ты приводит к 1-оксиду, избытком к-ты - к 1,4-диоксиду. Дальнейшее восстановительное хлорирование моно- или ди-N-оксидов хиноксалина действием РОСl3 идет с образованием соответственно 2-хлор- и 2,3-дихлорпроизводных хиноксалина.  Методика синтеза Исходные вещества: хиноксалин, перманганат калия. В трехгорлой круглодонной литровой колбе, снабженной мешалкой, капельной воронкой и обратным холодильником, суспендируют хнноксалин (7.25 г) в 200 мл воды. Суспензию нагревают до 90 0С и при хорошем перемешивании прикапывают теплый раствор перманганата калия (52.5 г) в 450 мл воды. Скорость добавления перманганата регулируют таким образом, чтобы смесь все время кипела. После прибавления окислителя, на что требуется около 45 мин, смесь перемешивают еще 15 мин, затем слегка охлаждают и фильтруют через воронку Бюхнера. Двуокись марганца на фильтре тщательно промывают горячей водой (100 мл), объединенные водные фильтраты упаривают до объема |
Методы получения пиразина.
Реакции нуклеофильного замещения в пиразине.
Окисление хинолина, хиноксалина и других бензоаннелированных гетероциклов.
Как отделяют продукт от неорганических примесей?
Типы мешалок, прибор для органического синтеза с мешалкой.
Как провести экстракцию пиразин-2,3-дикарбоновой кислоты из реакционной смеси?
Техника безопасности при работе с перманганатом калия.
Как провести перекристаллизацию пиразин-2,3-дикарбоновой кислоты?
Техника безопасности при работе с нитритом натрия и бромом.
Как добавляют бром к реакционной массе.
Как проводят экстракцию 2-бромпиридина?
Как осуществляют сушку 2-бромпиридина?
Как проводят перегонку продукта под вакуумом с применением елочного дефлегматора?