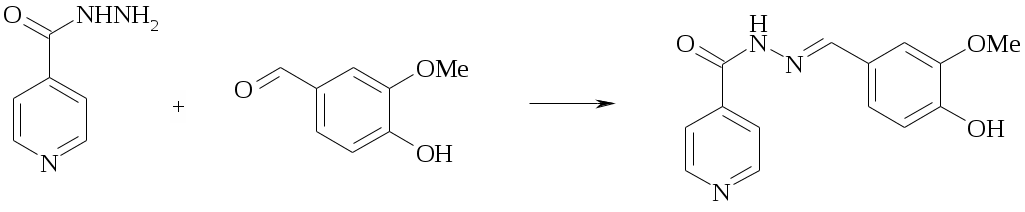1. Как провести синтез мезо-тетрафенилпорфирина в атмосфере азота?
2. Как приготовить раствор эфирата трехфтористого бора.
3. Как подготовить дихлорметан для синтеза мезо-тетрафенилпорфирина?
4. Проведение колоночной жидкостной хроматографии для окончательной очистки продукта.
5. Упаривание реакционной смеси на ротационном испарителе.
Лабораторная работа ХГС 13
СИНТЕЗ ХИНОЛИНА
Теоретическая часть
Синтез Скраупа – один из наиболее известных методов синтеза хинолина. В качестве исходных веществ используют анилин и акролеин. Акролеин легко полимеризуется, поэтому часто синтез ведут из глицерина, который при действии серной кислоты подвергается дегидратации в акролеин, затем акролеин присоединяется к молекуле анилина. Образующийся в кислой среде карбокатион вступает в реакцию электрофильного замещения и после дегидратации интермедиата получается дигидрохинолин. Последняя стадия заключается в дегидрировании дигидрохинолина в хинолин при помощи нитробензола как дегидрирующего агента. Для получения других производных хинолина используют хлоранил в качестве дегидрирующего агента.

методика синтеза
Исходные вещества: анилин, нитробензол, глицерин, сернокислое железо, серная кислота концентрированная.
В полулитровую круглодонную колбу вносят исходные вещества в следующем порядке: сернокислое железо (8 г), глицерин (68−70 мл), анилин (23 мл) и нитробензол (15 мл). Порциями добавляют концентрированную серную кислоту (43 мл), смесь тщательно перемешивают и, соединив колбу с обратным воздушным холодильником, нагревают на воздушной или песчаной бане до кипения (при этом начинается реакция), затем нагревание прекращают, и реакция идет самопроизвольно. Как только жидкость перестанет кипеть, начинают нагревание и кипятят реакционную смесь 2.5 часа. После этого смеси дают охладиться до 100 0С, переливают в большую колбу и отгоняют с паром непрореагировавший нитробензол. В колбу осторожно приливают 130 мл 30% раствора едкого натра до щелочной реакции на фенолфталеин и продолжают перегонку с водяным паром. При этом перегоняется хинолин вместе с непрореагировавшим анилином. Дистиллят подкисляют 28 мл концентрированной серной кислоты, охлаждают до 5 0С и приливают 10% раствор нитрита натрия до синего пятна на йодкрахмальную бумагу.
Реакционную массу нагревают на водяной бане до прекращения выделения пузырьков. Раствор подщелачивают концентрированным раствором едкого натра и ведут перегонку с водяным паром. Дистиллят насыщают поваренной солью, экстрагируют эфиром и сушат эфирные вытяжки едким натром. Отгоняют эфир и перегоняют хинолин.
Вопросы к коллоквиуму
Вопросы по теории:
Механизм реакции Скраупа, взаимосвязь заместителей в анилине, непредельном альдегиде и структуры образующегося хинолина.
Какую роль играет нитробензол в реакции Скраупа?
Химические свойства хинолина: электрофильное и нуклеофильное замещение, окисление и гидрирование.
Основные свойства, образование солей.
Вопросы по методике синтеза:
Почему исходные реагенты вносятся в указанном порядке?
Почему при первой перегонке с водяным паром отгоняется только нитробензол?
Для чего добавляется в перегонную колбу щелочь?
Что происходит при приливании к подкисленному дистилляту нитрита натрия и для чего это делается?
Что представляет собой иодкрахмальная бумага? Как она используется при определении конца реакции диазотирования?
Пузырьки какого газа выделяются при нагревании колбы на водяной бане?
Какой эфир применяется для экстракции и почему?
Какова температура кипения числого хинолина? На какой установке проводится его перегонка?
Техника безопасности при работе с диэтиловым эфиром.
«ХИМИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ»
Лабораторная работа ХБАВ 1
СИНТЕЗ СТРЕПТОЦИДА
Теоретическая часть
Сульфаниламиды (сульфонамиды) − группа синтетических антимикробных препаратов широкого спектра действия в отношении как грамположительных, так и грамотрицательных микроорганизмов, введенных в медицинскую практику еще до открытия пенициллинов.
Сульфонамидные препараты являются производными сульфаниламида (п-аминобензолсульфонамида), структурного аналога п-аминобензойной кислоты – компонента, необходимого бактериям для синтеза фолиевой кислоты (последняя − предшественник синтеза пурина, нуклеиновых кислот и, особенно, ДНК).

Аминобензолсульфамид (белый стрептоцид) простейшее соединение класса сульфаниламидов применяется в медицине до сих пор. Один из важнейших методов синтеза сульфаниламидных препаратов включает стадии сульфохлорирования ациланилида действием хлорсульфоновой кислоты, амидирования и снятия защитной группы. Для проведения синтеза необходимо использовать ациланилид из-за того, что в растворе хлорсульфоновой кислоты, в отличие от раствора в апротонном растворителе, анилин протонирован на 100% так же как и в серной кислоте. Выбор защитной ацильной группы обусловлен экономическими причинами. По сравнению с ацетил-, форманилидом или фенилуретаном существенно дешевле использовать фенилуретилан, который синтезируют из анилина и метилового эфира хлоругольной кислоты. Гидролиз карбометоксигруппы на третьей стадии ведут в концентрированной щелочи при температуре 100-120 С, затем подкисляют реакционную массу.
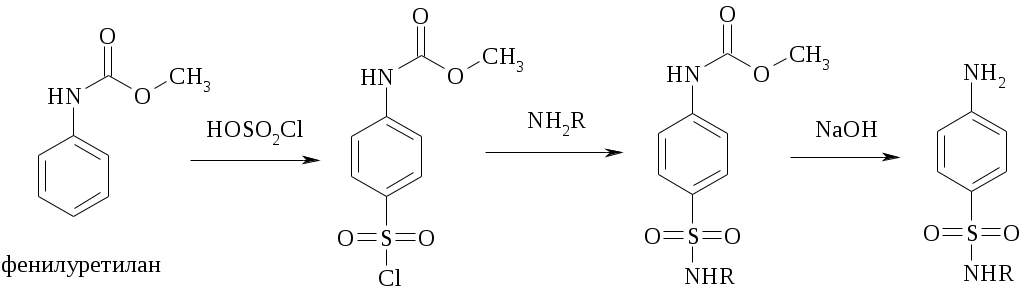
В лаборатории часто для синтеза сульфаниламидов используют ацетанилид. В синтезе стрептоцида на второй стадии проводят реакцию сульфохлорида с 25%-ным раствором аммиака.
методика синтеза
Исходные вещества: ацетанилид, хлорсульфоновая кислота, 25%-ный водный раствор аммиака, 20%-ная серная кислота.
Стадия 1. Получение пара-ацетиламинобензолсульфохлорида
Хлорсульфоновую кислоту (30 мл) осторожно выливают в сухой фарфоровый стакан с отогнутыми краями, закрепленный в кольце и опущенный в смесь воды со льдом. В хлорсульфоновую кислоту при помешивании стеклянной палочкой вносят небольшими порциями ацетанилид (9 г). Температура реакционной массы не должна превышать 20-25 0С, ее регулируют скоростью прибавления ацетанилида. По окончании прибавления ацетанилида баню медленно нагревают до тех пор, пока температура реакционной массы станет равной 65-70 0С. При этой температуре содержимое стакана выдерживают в течение 30 минут, после чего охлаждают до комнатной температуры и выливают осторожно, медленно, тонкой струйкой в фарфоровую чашку на 100 г толченого льда. При этом необходимо энергично перемешивать лед, а в случае его исчезновения добавить еще. Выделившийся осадок отфильтровывают и промывают 3-4 раза холодной водой. На этой стадии работу прекращать нельзя, необходимо провести следующую.
Стадия 2. Получение пара-ацетиламинобезолсульфамида.
Полученную влажную пасту пара-ацетиламинобензолсульфохлорида вносят постепенно частями в стакан, содержащий 75 мл 25%-ного раствора аммиака, при перемешивании стеклянной палочкой. Затем смесь оставляют стоять в течение 30 минут, периодически перемешивая. Осадок отфильтровывают и промывают 2-3 раза холодной водой.
Стадия 3. Получение пара-аминобензолсульфамида (стрептоцида)
В круглодонной колбе емкостью 250 мл с обратным холодильником нагревают до слабого кипения 20% серную кислоту (80 мл). Затем убирают холодильник и вносят частями п-ацетиламинобензолсульфамид в виде влажной (или сухой) пасты. После растворения осадка смесь кипятят с холодильником в течение 30 минут. Охлаждают до 10-15 0С и при непрерывном помешивании и охлаждении нейтрализуют 25% раствором аммиака до появления слабого запаха последнего (избыток аммиака ведет к потере продукта). Выделившийся стрептоцид отфильтровывают, промывают 1 раз очень небольшим количеством холодной воды и перекристаллизовывают из воды. Определяют температуру плавления стрептоцида (после его сушки).
Вопросы к коллоквиуму
Вопросы по теории:
Схема синтеза сульфаниламидов, основанная на реакции сульфохлорирования и замещения атома хлора на амино- или гетериламиногруппу.
Другие подходы к синтезу сульфаниламидов (циклоконденсация интермедиатов, содержащих при SO2 остаток тиомочевины или гуанидина, с 1,2- или 1,3-диэлектрофильными реагентами; нуклеофильное замещение галогена в гетероядре на сульфаниламидную группу.
Почему нельзя проводить реакцию хлорсульфирования с анилином при получении стрептоцида?
Механизм бактериостатического действия сульфаниламидов.
Вопросы по методике синтеза:
Почему используется избыток хлорсульфоовой кислоты?
Почему реакционная масса после нагревания ацетанилида с хлорсульфоновой кислотой выливается осторожно на лед таким образом, чтобы температура была низкая?
Почему нельзя оставлять влажный сульфохлорид до следующего дня работы?
Почему избыток аммиака при выделении стрептоцида ведет к потере продукта?
Какие меры предосторожности нужно предпринимать при работе с хлорсульфоновой кислотой, с 25%-ным раствором аммиака?
Лабораторная работа ХБАВ 2
СИНТЕЗ ИЗОНИАЗИДА
Теоретическая часть
Изониазид (гидразид изоникотиновой кислоты, тубазид) – противотуберкулезное средство, используется в медицинской практике с 1952 г. Механизм действия изониазида связан с угнетением синтеза миколевой кислоты в клеточной стенке Mycobacterium tuberculosis (МБТ).
Изониазид получают действием гидразингидрата на этиловый эфир изоникотиновой кислоты.

Другой способ получения изониазида основан на гидролизе 4-цианопиридина до амида изоникотиновой кислоты, из которого затем синтезируют гидразид [3].

методикасинтеза
Исходные вещества: изоникотиновая кислота, тионилхлорид, этанол, 20%-ный раствор гидроксида натрия, гидразингидрат.
Стадия 1. Получение гидрохлорида изоникотиноилхлорида.
Тионилхлорид (5 г, 42 ммоль) в течение 30 минут приливают к 3.582 г (29 ммоль) изоникотиновой кислоты. Температура при этом повышается до 60−70 0C, и изоникотиновая кислота переходит в раствор. Реакционную массу нагревают 1.5 часа при 74−76 0C, затем избыток тионилхлорида отгоняют в вакууме (350 мм рт. ст). Полученный гидрохлорид никотиноилхлорида без выделения используется на следующей стадии.
Стадия 2. Получение этилового эфира изоникотиновой кислоты.
Безводный этанол (2.8 г) добавляют при температуре не выше 75−80 0C к продукту, полученному на предыдущей стадии. Реакционную массу кипятят 1 час, охлаждают до 15−20 0C, добавляют 5 г льда и нейтрализуют 20%-ным раствором едкого натра (
3 мл) до исчезновения кислой реакции (контроль по универсальному индикатору), при этом температуру реакционной массы поддерживают не выше 20 0C. Затем прибавляют в течение 1 часа 8 мл 20%-ного раствора соды до рН 10-11, водно-щелочной раствор экстрагируют дихлорэтаном (3×15 мл). Экстракт сушат над сульфатом натрия, отгоняют растворитель, затем перегоняют этиловый эфир изоникотиновой кислоты в вакууме (120-122 0C при 20 мм рт. ст.).
Стадия 3. Получение гидразида изоникотиновой кислоты.
К 4.346 г (28.75 ммоль) этилового эфира изоникотиновой кислоты в течение 10 минут при 15−20 0C и перемешивании приливают 1.791 г (30.06 ммоль) 85%-ного гидразингидрата. Температура массы при этом повышается до 60-70 0C. Реакционную массу оставляют на 4 часа, добавляют 2 мл этанола, нагревают до разжижения и сливают для кристаллизации. Выпавший изониазид отфильтровывают, промывают 1.5 мл этанола и высушивают. Из спиртового раствора выделяют дополнительное количество продукта. Весь изониазид перекристаллизовывают из воды с применением активированного угля.
Вопросы к коллоквиуму
Вопросы по теории:
Приведите примеры противотуберкулезных средств с различными механизмами действия.
Амфотерность пиридинкарбоновых кислот
Механизм превращения хлорангидрида в сложный эфир, сложного эфира в гидразид.
Вопросы по методике синтеза:
Установка для перегонки при пониженном давлении.
Почему на второй стадии только к начале нейтрализации используют гидроксид натрия, а затем – соду?
Перекристаллизация с применением активированного угля.
Лабораторная работа ХБАВ 3
СИНТЕЗ ФТИВАЗИДА [(4-ГИДРОКСИ-3-МЕТОКСИБЕНЗИЛИДЕН)-ИЗОНИКОТИНОВОЙ КИСЛОТЫ ГИДРАЗИДА]
Теоретическая часть
Несколько противотуберкулезных препаратов являются производными изониазида. Метазид (1,1-метилен-бис-изоникотиноилгидразин) считается менее токсичным, чем изониазид, но более токсичным, чем фтивазид. Ларусан (изоникотиноилгидразон фурфуральацетона) по лечебным качествам сходен с фтивазидом.
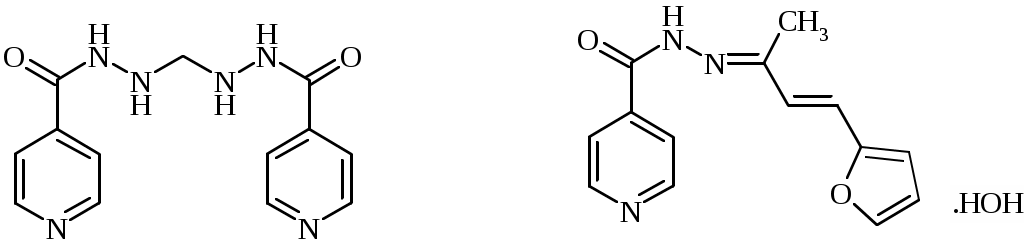
метазид ларусан
Салюзид – изоникотиноилгидразон 2-карбокси-3,4-диметоксибензальдегида. Особый интерес представляет его диэтиламмониевая соль, хорошо растворимая в воде, получившая название салюзида растворимого. Он применяется для введения в места локализации туберкулезных поражений с целью создания там высокой концентрации препарата. Салюзид растворимый используется для введения в спинномозговой канал при туберкулезном менингите.
Для получения фтивазида проводят взаимодействие изониазида с 3-метокси-4-гидроксибензальдегидом (ванилином).
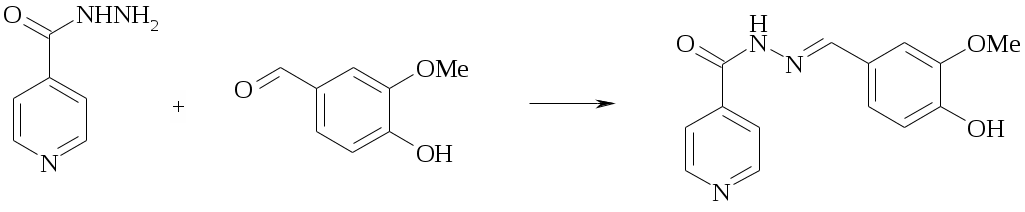
Методика синтеза
Исходные вещества: изониазид, ванилин.
Вариант 1 – синтез в этаноле
К раствору 1.37 г (10 ммоль) гидразида изоникотиновой кислоты в 30 мл этанола добавляют 1.52 г (10 ммоль) ванилина, кипятят с обратным холодильником в течение 3 часов, затем реакционную массу охлаждают, желтый осадок отфильтровывают и перекристаллизовывают из этанола. Выход 1.84 г (68%); т. пл. 238–240 0C.
Вариант 2 – синтез в воде
К нагретому до 50 0С раствору 4.17 г (27.3 ммоль) ванилина в 83 мл воды приливают в течение 15-20 минут нагретый до 50 0С раствор 3.77 г (26.6 ммоль) изониазида в 20 мл воды. Реакционную массу выдерживают 3 часа при 60 0С, затем охлаждают до 20 0С, отфильтровывают фтивазид, промывают 15 мл нагретой до 70 0С воды и сушат при 60 0С.
Вопросы к коллоквиуму
Вопросы по теории:
Механизм взаимодействия гидразида с карбонильными соединениями.
Противотуберкулезные средства – производные изониазида.
Вопросы по методике синтеза
Как отделить фтивазид от непрореагировавших изониазида и ванилина?
Почему фтивазид имеет желтую окраску, в то время как изониазид бесцветный?
Лабораторная работа ХБАВ 4
СИНТЕЗ БАРБИТАЛА
Теоретическая часть
Барбитураты – группа лекарственных средств, производных барбитуровой кислоты, оказывающих угнетающее влияние на центральную нервную систему. Барбитураты применяются в качестве снотворных и успокаивающих препаратов. Ниже приведена схема синтеза двух барбитуратов на основе малонового эфира и мочевины.

R = C2H5 (барбитал), CH2CH2CH(CH3)2 (барбамил)
Методика синтеза
Исходные вещества: диэтилмалоновый эфир, мочевина, металлический натрий, абсолютный этанол.
Синтез проводится в трехгорлой колбе, снабженной термометром и обратным холодильником с хлоркальциевой трубкой, на магнитной мешалке. В колбу загружают 34.5 мл абсолютного этанола и 2.54 г металлического натрия (маленькими порциями), поддерживая равномерное кипение смеси при 73-80 0С, до полного растворения металла. К охлажденному до 40 0С раствору прибавляют 11.9 мл диэтилмалонового эфира. Массу перемешивают в течение 30 мин при 40 0С, прибавляют 4.4 г мочевины, смесь выдерживают при комнатной температуре в течение 1 ч. Отгоняют этиловый спирт, остаток растворяют в 53 мл воды, раствор фильтруют, отстаивают 30 мин, отделяют от слоя органических примесей, охлаждают до 10-15 0С, подкисляют концентрированной соляной кислотой до рН 4−4.5 и перемешивают 1.5 часа. Осадок отфильтровывают, промывают водой до нейтральной реакции и высушивают.
Вопросы к коллоквиуму
Вопросы по теории:
Механизм циклоконденсации малонового эфира с мочевиной при катализе этилатом натрия.
Биологически активные вещества – производные пиримидина
Вопросы по методике синтеза:
1. Техника безопасности при работе с металлическим натрием.
2. Почему важно поддерживать рН 4−4.5 при выделении продукта?
Лабораторная работа ХБАВ 5
СИНТЕЗ ФУРАЦИЛИНА
Теоретическая часть
Группа соединений нитрофуранового ряда, первым представителем которых является фурацилин, эффективна в отношении грам-положительных, грам-отрицательных бактерий (стрептококков, стафилококков, шигелл, сальмонелл и др.), а также лептоспир, трихомонад, кокцидий, лямблий и других микроорганизмов. В небольших концентрациях такие лекарственные средства проявляют бактериостатическую активность, в то время как при высоких концентрациях – бактерицидную. Бактериостатический эффект происходит за счет образования производными нитрофуранов комплексов с нуклеиновыми кислотами, вследствие чего нарушается ДНК возбудителя и угнетается синтез мембранных и энергетических белков бактерий. Бактерицидный эффект реализуется за счет того, что после восстановления нитрогруппы происходит связывание протонов от клеточных структур возбудителя, угнетаются ферменты цепи дыхания, ингибируется цикл Кребса; и гибель возбудителя наступает вследствие разрушения микробной клетки.
Общий подход к синтезу антибактериальных средств нитрофуранового ряда заключается во взаимодействии 5-нитрофурфурола с активной аминогруппой гидразидного или 1-аминогетерильного фрагмента.
Для получения фурацилина фурфурол нитруют азотной кислотой в присутствии уксусного ангидрида (защищающего альдегидную группу от окисления), а затем проводят реакцию с семикарбазидом.

Методика синтеза
Исходные вещества: 5-нитро-2-фуральдегида диацетат, серная кислота, семикарбазид.
Стадия 1. Получение 5-нитрофурфурола
К нагретой до кипения смеси 2.7 мл воды и 1.08 г (10.4 ммоль) 94%-ной серной кислоты добавляют 1.55 г (5.7 ммоль) 5-нитро-2-фуральдегида диацетата. Кипятят 10 минут, добавляют 13.5 мл воды и снова кипятят при 94−95 0С до полного растворения образовавшегося 5-нитрофурфурола, раствор обрабатывают углем и фильтруют.
Стадия 2. Получение семикарбазона 5-нитрофурфурола
К горячему отфильтрованному раствору, полученному на предыдущей стадии, при перемешивании тонкой струйкой в течение 45 минут добавляют профильтрованный раствор 0.66 г (5.86 ммоль) семикарбазида в 8 мл воды, при этом выпадают кристаллы фурациллина. Реакционную массу охлаждают до 18−20 0С и через 2 часа отфильтровывают продукт, отмывают от сульфат-иона 13−15 мл воды и сушат при 60−70 0С.
Вопросы к коллоквиуму
Вопросы по теории:
Лекарственные препараты нитрофуранового ряда
Механизм взаимодействия альдегитда с семикарбазидом.
Почему для нитрования фурфурола целесообразно использовать смесь азотной кислоты и уксусного ангидрида?
Направления реакции электрофильтного замещения в пятичленных гетероатоматических соединениях с одним гетероатомом.
Вопросы по методике синтеза:
От какого сульфата отмывают продукт в конце синтеза?
Насколько различаются по растворимости в воде фурацилин и семикарбазид?
Лабораторная работа ХБАВ 6
СИНТЕЗ ДИБАЗОЛА
Теоретическая часть
Гипотензивный препарат дибазол (бендазол) является производным бензимидазола. Соединение оказывает непосредственное спазмолитическое действие на гладкие мышцы кровеносных сосудов и внутренних органов. Дибазол получают циклоконденсацией о-фенилендиамина и фенилуксусной кислоты.

Методика синтеза
Исходные вещества: о-фенилендиамин, фенилуксусная кислота, соляная кислота.
Смешивают 2.295 г (20.8 ммоль) о-фенилендиамина и 2.89 г (20.8 ммоль) фенилуксусной кислоты и нагревают до 140 0С, при этом смесь расплавляется. Температуру повышают до 190 0С и перемешивают 3 часа с постепенным повышением температуры до 200 0С. Массу охлаждают до 110−120 0С, приливают 5.6 мл воды и 3.2 г 27.5%-ной соляной кислоты. Смесь нагревают до 96 0С и перемешивают до полного растворения плава (1 час). Из водного раствора при перемешивании и охлаждении до 20 0С выпадает гидрохлорид 2-бензил-бензимидазола, который отфильтровывают и перекристаллизовывают из воды.
Вопросы к коллоквиуму
Вопросы по теории:
Почему циклоконденсация о-фенилендиамина с карбоновой кислотой протекает при повышенной температуре?
Биологически активные вещества – производные бензимидазола.
Вопросы по методике синтеза:
На какой бане следует проводить синтез для поддержания необходимой температуры?
Перекристаллизация: принцип, этапы, выбор подходящего растворителя.
Лабораторная работа ХБАВ 7
СИНТЕЗ МЕРКАПТОПУРИНА
Теоретическая часть
6-Меркаптопурин − цитостатичкский препарат из группы антиметаболитов. Синтез осуществляют обработкой гипоксантина (6-гидроксипурина) пентасульфидом фосфора. Гипоксантин, в свою очередь, получают по методу Фишера, который заключается в реакции 5-аминобарбитуровой кислоты с изоциануровой кислотой и циклизации образовавшегося интермедиата при нагревании в соляной кислоте [4].



Методика синтеза
Исходные вещества: гипоксантин, пентасульфид фосфора, пиридин, соляная кислота, аммиак.
Смесь 0.29 г (2.13 ммоль) гипоксантина, 5.7 г безводного пиридина и 0.696 г (3.13 ммоль) пентасульфида фосфора кипятят 3 часа. Затем отгоняют пиридин в вакууме (200−300 мм рт. ст.) и температуре 70−80 0С. К охлажденному до комнатной температуры остатку приливают 6 мл воды и после 10−12 часов нагревают 4 часа при 80 0С. Отфильтровывают технический меркаптопурин, промывают водой, затем смешивают с нагретым до 90 0С раствором 0.87 мл соляной кислот в 29 мл воды. Смесь кипятят до полного растворения продукта (40−60 минут) и 20−30 минут после добавления активированного угля. После фильтрации раствор нейтрализуют аммиачной водой до рН 4, охлаждают до 10 0С и повторно очищают перекристаллизацией с углем из 45 мл воды, подкисленной соляной кислотой до рН 4.
Вопросы к коллоквиуму
Вопросы по теории:
Лекарственные препараты-антиметаболиты, применяемые в качестве противоопухолевых средств.
Механизм реакции тионирования.
Реакционная сапособность 2,6,8-трихлорпурина, синтез аденина и гуанина.
Постровение пурина по Траубе и Фишеру.
Вопросы по методике синтеза:
Почему для очистки меркаптопурина используют кислую среду?
Как очищают продукт от комплекса пиридина с пентасульфидом фосфора?
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Юровская М. А. Химия ароматических гетероциклических соединений (Учебник для высшей школы) // М.: БИНОМ. Лаборатория знаний, 2015.
Kollmar M., Parlitz R., Oevers S. R., Helmchen G. 2-Amino-3-fluorobenzoic acid // Organic Syntheses. 2002. V. 79. P. 196.
Sycheva T. P., Pavlova T. N., Shchukina M. N. Synthesis of isoniazid from 4-cyanopyridine // Pharmaceutical Chemistry Journal. 1972. V. 6 № 11. P. 696–698.
Vardanyan R. S., Hruby V. J. Synthesis of Essential Drugs. Elsevier, 2006. P. 392.
Список РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРы
Бунев А. С. Химия гетероциклических соединений: лабораторный практикум / А. С. Бунев, В. Е. Стацюк. Изд-во ТГУ, 2013. – 86 с.
Великородов А.В. Реакции, методы синтеза и идентификации в практикуме по органической химии. Учебное пособие. Астрахань, 2006.
Гитис С. С. Практикум по органической химии. Органический синтез / С. С. Гитис, А. И. Глаз, А. И. Иванов. М.: Высшая школа, 1991, 303 с.
Джилкрист Т. Химия гетероциклических соединений. Пер. с англ. – M.: Мир, 1996.
Джоуль Дж. Химия гетероциклических соединений. / Дж. Джоуль, К. Миллс. М.: Мир. 2004.
Иванский В. И. Химия гетероциклических соединений. М.: Мир. 1978.
Исляйкин М.К. Химия и технология химико-фармацевтических препаратов. Методические указания для самостоятельной работы студентов. Ивановская гос. хим.-технол. академ.: Иваново, 1998.
Кери Ф. Углубленный курс органической химии / Ф. Кери, Р. Сандберг. М. Химия. 1981, кн. 1.
Лабораторный практикум по синтезу промежуточных продуктов и красителей. под ред. А.В. Ельцова. Л.: Химия. 1985.
Марч Дж. Органическая химия. Углубленный курс для университетов и химических вузов, в 4 томах. М.: Мир, 1987.
Органикум: В 2-х т. Пер. с нем. 4-е изд. – М.: Мир, 2008. Т. 1 – 504 с. Т. 2 – 488 с.
Пожарский А.Ф. Теоретические основы химии гетероциклов. М.: Химия. 1985.
Пожарский А. Ф., Анисимова В. А., Цупак Е. Б. Практические работы по химии гетероциклов. Ростов-на-Дону: Изд-во РГУ, 1988, 158 с.
Рубцов М. В. Синтетические химико-фармацевтические препараты: Справочник. Отв. редактор А. Г. Натрадзе / М. В. Рубцов, А. Г. Байчиков М.: Медицина, 1971.
Свойства органических соединений. Справочник. Под ред. А.А. Потехина. Л.: Химия, 1984, 520 с.
Титце Л. Препаративная органическая химия. Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории. Перевод под ред. Ю.Е. Алексеева / Л. Титце, Т. Айхер. М.: Мир, 1999, 704 с.
Шарп Дж. Практикум по органической химии. Перевод с англ. под ред. В.В. Москвы / Дж. Шарп, И. Госни, А. Роули М.: Мир, 1993, 240 с.
Яхонтов Л.Н. Синтетические лекарственные средства / Л. Н. Яхонтов, Р. Г. Глушков. М.: Медицина,1983. - 272 с.
ОГЛАВЛЕНИЕ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО КУРСУ
«ХИМИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ»………………………1
Синтез пиррола по Кнорру………………………………………………………1
Синтез пиррола…………………………………………………………………..4
Синтез 5,6-дифторизатина………………………………………………………6
Синтез 6,7-дифтор-2-метилхинолин-4-карбоновой кислоты…………………9
Синтез 2,3-диметилиндола…………………………………………………….10
Синтез индола…………………………………………………………………..13
Синтез 3,5-диметилпиразола…………………………………………………..15
Синтез диэтилового эфира 2,6-диметил-4-фенилпиридин-
2,6-дикарбоновой кислоты…………………………………………………..17
Синтез хиноксалина……………………………………………………………19
Синтез пиразин-2,3-дикарбоновой кислоты………………………………….21
Синтез 2-бромпиридина……………………………………………………….23
Синтез мезо-тетрафенилпорфирина………………………………………….25
Синтез хинолина………………………………………………………………28
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО КУРСУ
«ХИМИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ»………………….31
Синтез стрептоцида……………………………………………………………31
Синтез изониазида……………………………………………………………..34
Синтез фтивазида………………………………………………………………36
Синтез барбитала………………………………………………………………38
Синтез фурацилина……………………………………………………………39
Синтез дибазола………………………………………………………………..41
Синтез меркаптопурина……………………………………………………….42
|
 Скачать 0.58 Mb.
Скачать 0.58 Mb.