химия в быту. Практикум учебнометодические рекомендации для студентов химикобиологического факультета
 Скачать 0.97 Mb. Скачать 0.97 Mb.
|
|
ИЗМЕРЕНИЕ КОНЦЕНТРАЦИИ ФТОРА В ЗУБНЫХ ПАСТАХ ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ Фторсодержащие соединения вводятся в зубные пасты в качестве противокариозного компанента. К фторсодержащим агентам, используемых в зубных пастах чаще всего применяют фторид натрия, монофосфат натрия и аминофториды. Оптимальная концентрация фтора в зубной пасте – 0,1% или не более 1500 мг/кг. ОБОРУДОВАНИЕ: Иономер Хлорсеребряный электрод Колбы плоскодонные (100мл) – 5 шт. Стакан химический (100 мл) – 1 шт. Баня водяная Часовое стекло Колба мерная (100 мл) – 1 шт. Магнитная мешалка Стеклянная палочка РЕАКТИВЫ: Фторид натрия (0,1 М) Кислота соляная (2 н) ХОД РАБОТЫ: Приготовление градуировочных растворов фторида натрия (см. приложение № 1). Подготовка иономера к работе (см. приложение № 2). 1. Подготовка проб зубной насты к определению фтора при введении его в виде фторида натрия К навеске пасты 1 г добавляют 50 мл дистиллированной воды, смесь гомогенизируют на магнитной мешалке или вручную при перемешивании стеклянной палочкой, переносят в мерную колбу объемом 100 мл. Стаканчик многократно смывают дистиллированной водой. Смывные воды сливают в мерную колбу, объем доводят дистиллированной водой до метки. Раствор перемешивают, осадку дают осесть на дно. 2. Подготовка проб зубной пасты к определению фтора при введении его в виде монофторфосфата натрия, смеси фторида и монофторфосфата натрия, при отсутствии указаний на этикетке о виде фтористого соединения К навеске пасты 1 г прибавляют 20 мл дистиллированной воды, смесь гомогенизируют. Для выделения фтора в виде фтор-иона из иона РО3F2- содержащего фтор в связанном виде, к гомогенизату прибавляют 20 мл соляной кислоты концентрацией 2 моль/л (2 н), прикрывают стакан часовым стеклом и нагревают на кипящей водяной бане 10 мин. После охлаждения до комнатной температуры смесь в стакане нейтрализуют 40% раствором гидроксида натрия по индикаторной бумаге до нейтральной реакции. Нейтрализованный раствор переносят в мерную колбу объемом 100 мл. Стакан многократно смывают дистиллированной водой, сливая смывы в мерную колбу. Объем доводят дистиллированной водой до метки. Каждую пробу зубной пасты готовят в трех повторностях. Полученные показания иономера в единицах рF сравнивают с таблицей пересчета значений рF в мг/л фторидов и находят концентрацию фтора в мг/л. Расчет содержания фтора в мг/кг пасты ведут по формуле: 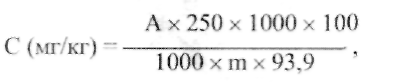 где А – концентрация фтора в полученном водном растворе зубной пасты, мг/л; т – навеска пасты, взятая для анализа, г; 100 – объем раствора зубной пасты, мл; 1000 (числитель) – коэффициент для пересчета содержания фтора в 1 кг пасты; 93,9 – степень обнаружения фтора в пастах, %; 100 – коэффициент, учитывающий полное содержание фтора в зубной пасте, в %; 1000 (знаменатель) – коэффициент, переводящий 1 л в мл. За окончательный результат принимают среднее арифметическое трех параллельных определений, расхождение между максимальным и минимальным результатами которых не должно превышать 21,7% по отношению к среднему значению. II. АНАЛИЗ СТАРАЛЬНЫХ ПОРОШКОВ ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ПЕРОКСИД-ИОНОВ В СТИРАЛЬНЫХ ПОРОШКАХ МЕТОДОМ ПЕРМАНГАНАТОМЕТРИИ Кислородосодержащий (или химический) отбеливатель – это окислители, производные перекиси (пероксида) водорода (пероксокарбонат или пероксоборат натрия). Выше 70° С (при кипячении белья) они выделяют активный атомный кислород, а это способствует удалению пятен растительного происхождения (фрукты, вино, чай, трава). Кроме этого, отбеливает и освежает ткани. ГОСТ Р 52488 – 2005 устанавливает содержание активного кислорода в стиральных порошках от 6% до 14 %. 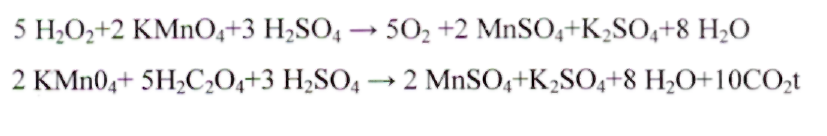 ОБОРУДОВАНИЕ: 1. Бюретка (25 мл) – 1 шт. 2. Пипетка (10 мл) – 1 шт. 3. Мерная колба (100 мл) – 1 шт. 4. Мерная пробирка – 1 шт. 5. Колба коническая (250 мл) – 2 шт. РЕАКТИВЫ: 1. Перманганат калия (0.1н) 2. Серная кислота (20%) 3. Дистиллированная вода. ХОД РАБОТЫ: Бюретку ополаскивают и заполняют титрантом KMnO4. Нулевой уровень титранта устанавливают по верхнему краю мениска. Также делают в дальнейшем отсчеты по шкале бюретки. Приготовить в стаканчике навеску порошка 5-10г. В коническую колбу для титрования поместить навеску стирального порошка 5г. Добавить 60 мл дистиллированной воды, 10 мл раствора серной кислоты, тщательно перемешать и оттитровать раствором перманганата калия до появления розового окрашивания, не исчезающего в течение 1 минуты Вычислить массовую долю активного кислорода в процентах по формуле: 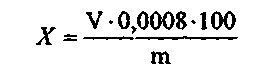 где V - объем раствора перманганата калия, израсходованного на титрование, мл; 0,0008 - масса активного кислорода, соответствующая I мл раствора перманганата калия 0,1 н, m - масса средства, г СПЕКТРОФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ФОСФАТОВ В СТИРАЛЬНЫХ ПОРОШКАХ Фосфаты – самый дешевый и очень эффективный умягчитель воды. Кроме того, они спасают стиральную машину от отложений накипи – нерастворимых солей магния и кальция, которые оседают из воды в виде трудноудаляемого налета. В этом необходимость фосфатов. Нежелательность и даже вред этих соединений связаны с проблемой эвтрофикации. Под этим термином понимают излишнее зарастание водоемов из-за чрезмерного поступления в воду биогенных элементов – азота и фосфора. Система очистки бытовых сточных вод не обеспечивает удаление фосфатов, попадающих из порошка вместе с водой в канализацию. Так фосфаты оказываются в водоемах и содействуют превращению рек в болота. Госстандарт не устанавливает единых нормативов на содержание фосфатов в стиральных порошках. Содержания фосфатов - зачастую больше 40% (указывается 15-30%). Сейчас во многих порошках концентрация фосфатов снижена до 10-12%. Сущность метода заключается в переводе фосфорсодержащих соединений в желто-окрашенный фосфорномолибденовый комплекс и фотометрическом измерении оптической плотности этого комплекса при длине волны λ= 430 - 450 нм относительно контрольного раствора, не содержащего Р2О5. ОБОРУДОВАНИЕ: Спектрофотометр Весы Электроплитка Муфельная печь Колба мерная (100 мл) – 1 шт. РЕАКТИВЫ: 1. Дигидрофосфат калия 2. Молибденовый реактив ХОД РАБОТЫ: Навеску стирального порошка 1 г. взвешивают на весах в тигле, озоляют на плитке и прокаливают в муфельной печи при температуре 550-600° С в течение 1 часа. Построение градуировочного (см. приложение № 6). В стакан на 200 мл вносят прокаленную пробу, приливают 100 мл воды, 15 мл азотной кислоты и кипятят в течение 30 мин. Раствор охлаждают и количественно переносят в мерную колбу на 250 мл. Доводят объем раствора водой до метки и перемешивают. Мутные растворы отстаивают или фильтруют. 1 мл полученного раствора переносят в мерную колбу, объемом 100 мл, добавляют 30мл дистиллированной воды, 25 мл молибденового реактива и доводят объем раствора водой до метки и тщательно перемешивают. Через 10 мин измеряют оптическую плотность анализируемого раствора. Массовую долю фосфорносодержащих соединений в пересчете на Р2О5, вычисляют по формуле: Х = (m1 · V · 100) : (V1·m · 1000) m1 – масса Р2О5, найденная по градуировочному графику, мг; V – объем мерной колбы, мл; V1 – объем раствора, используемого для анализа, мл; m – масса навески средства, г. ОПРЕДЕЛЕНИЕ ВОДЫ В ПОРОШКООБРАЗНЫХ МОЮЩИХ СРЕДСТВАХ МЕТОДОМ ВЫСУШИВАНИЯ Метод высушивания основан на высушивании пробы испытуемого моющего средства до постоянной массы при температуре 100-105° С и распространяется на порошкообразные синтетические моющие средства, не содержащие термонестабильные добавки (перборат натрия, перкарбонат натрия, гидрокарбонат натрия) ОБОРУДОВАНИЕ: 1. Весы 2. Шкаф сушильный 3. Эксикатор с осушителем 4. Стакан химический (бюкс) – 1 шт. ХОД РАБОТЫ: В чистый, высушенный бюкс, взвешивают 2 г стирального порошка и равномерно распределяют его по дну. С бюкса снимают крышку и помещают его вместе с крышкой в сушильный шкаф. Сушат 2 часа при температуре 105° С, затем перенося в эксикатор и охлаждают и охлаждают до температуры 20° С.Массовую долю воды порошкообразных синтетических моющих средств, по формуле: Х = (m2 – m3) : (m2 – m1) · 100 Х – массовая доля воды m1 – масса высушенного пустого бюкса m2 – масса бюкса с испытуемым порошком до высушивания m3 – масса бюкса с испытуемым порошком после высушивания ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СИЛИКАТА НАТРИЯ Экологические стиральные порошки не содержат фосфатов, которые используются для умягчения воды. Для этих целей производители используют натрия дисиликат, который связывает часть солей жесткости воды и тем самым повышает эффективность стирки. Натрия дисиликат используется не только в качестве смягчителя, он ингибирует коррозию, препятствуя отложению солей на внутренних конструкциях стиральных машин, а также может выступать в качестве структурообразующего компонента порошка. Обладая высокой абсорбционной способностью по отношению к жидким компонентам, дисиликат натрия играет роль каркасного компонента и благодаря диспергирующему действию повышает моющую способность ПАВ. Наибольший эффект достигается при стирке порошком, который содержит от 15-55% натрия дисиликата. ОБОРУДОВАНИЕ: 1. Спектрофотометр 2. Электроплитка 3. Стакан химический (150мл) – 1шт. 4. Стакан химический (600мл) – 1 шт. 5. Стакан химический (300мл) – 1 шт. 6. Колба мерная (100 мл) – 1 шт. 7. Колба мерная (250 мл) – 1 шт. 8. Чашка фарфоровая – 1 шт. РЕАКТИВЫ: 1. Силикат натрия 2. Гидроксид натрия 3. Кислота серная, раствор (1:4) 4. Кислота щавелевая (10%) 5. Кислота лимонная(10%) 6. Смесь сульфат марганца и щавелевой кислоты (см. прил. №8) 7. Молибденат аммония (10%) 8. Нитрат натрия 9. Перманганат калия (0.1 н) ХОД РАБОТЫ: Построить градуировочный график (см. приложение № 7) Определение содержания силиката натрия колориметрическим методом в порошках без перекисных солей Навеску синтетического моющего средства 1 г помещают в стакан вместимостью 150 мл, прибавляют 100 мл горячей воды (температура 90-95°С), нагревают на водяной бане, периодически помешивая стеклянной палочкой до полного растворения (для лучшего растворения добавляют 2-3 г. гидроксида натрия). Стакан помещают на плитку, покрытую асбестом, и нагревают раствор с момента закипания 1-2 мин., периодически помешивая палочкой. Раствор переносят в мерную колбу вместимостью 250 мл, тщательно промывая стакан 70-80 мл горячей воды (80° С), охлаждают до комнатной температуры (18-20°С) и доводят объем раствора водой до метки. Аликвотную часть раствора отбирают в количестве 10 мл, помещают в мерную колбу вместимостью 100 мл. Доводят объем раствора водой до 50 мл, добавляют 1 мл раствора серной кислоты, 5 мл раствора молибденовокислого аммония, тщательно перемешивают и дают развиться окраске в течение 3 мин. Затем добавляют 5 мл раствора лимонной кислоты, перемешивают и доводят объем раствора водой до 100 мл. Оптическую плотность испытуемого раствора измеряют через 5 мин, считая с момента разбавления, по отношению к контрольному раствору. Определение содержания силиката натрия колориметрическим методом в порошках с перекисными солями Навеску порошка массой около 0,5 г, помещают в стакан вместимостью 300 мл, прибавляют 150 мл горячей воды (температура 90-95°С), нагревают на водяной бане, периодически помешивая до полного растворения порошка (для лучшего растворения порошка добавляют 1-1,5 г гидроксида натрия). Раствор охлаждают до комнатной температуры, переносят в мерную колбу вместимостью 250 мл, доводят водой до метки. Отбирают аликвотную часть раствора в количестве 10 мл и переносят в мерную колбу вместимостью 100 мл. Объем раствора доводят водой до 50 мл, добавляют 1 мл раствора серной кислоты и по каплям добавляют раствор марганцовокислого калия до слабо-розовой окраски, не исчезающей в течение 1 мин при перемешивании. Затем по каплям добавляют раствор щавелевой кислоты и сернокислого марганца до исчезновения бледно-розовой окраски раствора и 5 мл молибденовокислого аммония. Раствор тщательно перемешивают, и дают развиться окраске в течение 3 мин, затем добавляют 5 мл раствора лимонной кислоты, перемешивают и доводят объем раствора до 100 мл. Оптическую плотность испытуемого раствора измеряют через 5 мин, считая с момента разбавления, по отношению к контрольному раствору, к которому добавляют раствор марганцовокислого калия и раствор смеси щавелевой кислоты и сернокислого марганца в таком количестве, в каком они были добавлены к испытуемому раствору. Определение содержания силиката натрия весовым методом Навеску синтетического средства массой 2-2,5 г помещают в стакан, вместимостью 600 мл, приливают 50 мл серной кислоты и добавляют 2,5 г нитрата калия или натрия. Стакан закрывают фарфоровой чашкой, нагревают на плитке, покрытой асбестом, добавляя небольшими порциями нитрата калия или натрия, пока жидкость не станет бесцветной или светло-желтой и прозрачной Если; часть органических веществ плавает на поверхности, то добавляют еще I г азотнокислого натрия и вновь нагревают. Температура нагревания должна быть 160-170°С. Если раствор не станет светлым, то его охлаждают и добавляют около 1 г перхлората калия или натрия и вновь нагревают до получения светло-желтого раствора. Затем раствор охлаждают, осторожно добавляют 100 мл холодной дистиллированной воды (температура 15-30°С) и выделяющиеся окислы азота удаляют непродолжительным нагреванием раствора. Теплый, раствор фильтруют через обеззольный фильтр «розовая или белая лента», осадок переносят на этот же фильтр и промывают дистиллированной водой до отрицательной реакции на сульфат-ион. Фильтр с осадком подсушивают и переносят в фарфоровый тигель, прокаленный до постоянной массы, осторожно озоляют на плитке и прокаливают в муфельной печи при 800°С в течение 30 мин, затем охлаждают и взвешивают. Последующие взвешивания проводят через каждые 30 мин прокаливания до получения постоянной массы. Примечание. Сжигание пробы серной кислотой и удаление оксидов азота необходимо проводить под тягой Массовую долю силиката натрия в пересчете на SiО2 (X) в процентах, определяемую колориметрическим методом, вычисляют по формуле: Х = (m1 · 250 · 1000) : (m · 10 · 1000) = (m1 · 5) : m m1 – масса силиката натрия в пересчете на SiO2, найденная по градуировочному графику, мг; m – масса навески синтетического моющего средства, г. Массовую долю силиката в пересчете на SiО2 (Х1) в процентах, определяемую весовым методом, вычисляют по формуле: Х1= (m2· 100) : m m – масса навески синтетического моющего средства, г; m2 – масса остатка после прокаливания, г. ОПРЕДЕЛЕНИЕ ПЕННОГО ЧИСЛА И УСТОЙЧИВОСТИ ПЕНЫ СТИРАЛЬНЫХ ПОРОШКОВ Показатели этого пункта оценивались на соответствие ГОСТу 22567.1. Порошки для ручной стирки имеют ненормированное пенообразование, то есть высота столба пены не ограничена. Более того, многие хозяйки любят порошки с обильной пеной и считают, что чем выше пена, тем лучше стирает порошок. По результатам тестирования мы можем сказать, что прямой связи между пенообразованием и моющим действием нет. Критерий оценки устойчивости пены прост - чем выше устойчивость, тем лучше. Порошки-автоматы ограничены по одному из двух параметров: либо высота пены не должна превышать 200 мм, либо ее стабильность должна быть меньше 0,3. По интенсивности пенообразования при стирке можно косвенно судить о наличии -ПАВ в стиральном порошке. Чем выше пена, тем выше концентрация -ПАВ. ОБОРУДОВАНИЕ: 1. Весы лабораторные. 2. Химический стакан (150 мл) 3. Цилиндр мерный (250 мл) 4. Колба мерная (100 мл) 5. Электроплитка. 6. Секундомер механического типа РЕАКТИВЫ: Вода жесткая (приложение № 9) ХОД РАБОТЫ: Взвешивают 1 г стирального порошка на весах в стакане. В стакан добавляют 10 мл жесткой воды и нагревают, помешивая до полного растворения, при температуре не выше 65 °С. Полученный раствор помещают в мерную колбу на 100 мл и доводят объем раствора жесткой водой до 100 мл и перемешивают, избегая пенообразования. 25 мл приготовленного раствора, нагретого до температуры 50-90° С переносят в цилиндр (250 мл), закрывают пробкой и встряхивают в вертикальном положении в течении 30 с, совершая 90 встряхиваний. Встряхивание прекращают, открывают пробку и через 30 секунд замеряют объем образовавшейся пены. Для определения устойчивости пены объем пены замеряют через 5 мин. Пенное число (Х1), в кубических сантиметрах, вычисляют по формуле: Х1 = 2 · V0 Устойчивость пены (Х2), в процентах, вычисляют по формуле: Х2 = V1 : V2 V1 - объем пены, измеренный через 1 минуту, см; Vo - объем пены, измеренный через 30 с, см . За окончательный результат принимают среднее арифметическое двух параллельных измерений, расхождение между которыми при доверительной вероятности не должно превышать 10 мм. |
