Предпосылки возникновения аппликационных лекарственных форм
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
Испытания
Описание: в фармакопейной статье или нормативной документации описывают форму трансдермального пластыря, цвет внешнего покровного слоя, матрицы и/или адгезива с указанием геометрических размеров площади подачи (высвобождения) действующего вещества с допустимыми отклонениями [3].Растворение: определяют скорость высвобождения действующего вещества из трансдермального пластыря или скорость его подачи через полимерную мембрану в выбранную среду растворения. Испытание проводят в соответствии с требованиями ОФС «Растворение для трансдермальных пластырей» [3].Остаточные органические растворители: при использовании в производстве трансдермальных пластырей органических растворителей определяют их предельное содержание в лекарственном препарате согласно ОФС «Остаточные органические растворители» [3].Однородность массы: для трансдермальных пластырей проводят определение однородности массы в соответствии с требованиями ОФС «Однородность массы дозированных лекарственных форм». Если предусмотрено определение однородности дозирования, определение однородности массы не требуется [3].Однородность дозирования: для трансдермальных пластырей проводят определение однородности дозирования в соответствии с требованиями ОФС «Однородность дозирования» [3].Количество пластырной массы: раздел вводят, если содержание лекарственного вещества выражают на грамм пластырной массы. Определение проводят гравиметрическим методом. Результат выражают в г/м2 [6] .Масса (объём) содержимого упаковки: раздел вводят для пластырей без подложки. Испытание проводят в соответствии с требованиями ОФС «Масса (объём) содержимого упаковки» [6].
Отклонение содержания действующего вещества/веществ в трансдермальном пластыре от заявленного не должно превышать ±15 % [3]. Для пластырей с носителем результат определения выражают как содержание действующего вещества в миллиграммах на пластырь, грамм пластырной массы или на грамм прокладок [6]. Для пластырей без носителя результат определения выражают в процентах [6]. Свинцовые пластыри дополнительно контролируют по показателям «Посторонние примеси» (пероксид свинца, карбонат свинца и оксид свинца) и «Потеря в массе при высушивании» (должна быть не более 1,0 %) [6]. Определение содержания посторонних примесей в свинцовом пластыре проводят по следующей методике: 1 г препарата с 10 г теплого очищенного скипидара должен давать опалесцирующий раствор, из которого через 5 мин выпадает осадок светло-желтого или светло-серого цвета (свинцовая соль жирных кислот), но не белый осадок (пероксид свинца, карбонат свинца и оксид свинца) [6]. Жидкие пластыри (кожные клеи) дополнительно контролируют по показателям «Растворимость», «pH» (фильтрат должен иметь нейтральную реакцию), «Потеря в массе при высушивании» (от 3,8 до 4,2 %) [6]. Если указано в фармакопейной статье или нормативной документации, пластыри контролируют по дополнительным показателям («Цинка оксид», «Сопротивление отслаиванию» и др.) [6].
Хранение: в соответствии с требованиями ОФС «Хранение лекарственных средств». В упаковке, обеспечивающей стабильность в течение указанного срока годности лекарственного препарата, в защищенном от света месте при температуре от 8 до 15°С, если нет других указаний в фармакопейной статье или нормативной документации [6]. В последнее время применение комбинированных оральных контрацептивов сопровождается рядом неудобств, таких как необходимость ежедневного приема, что требует высокой мотивации поведения, колебание уровня гормонов на протяжении суток, метаболизм в желудочно-кишечном тракте и др. Некоторые побочные явления отмечаются и при применении внутриматочных противозачаточных средств [12]. Использование контрацептивного пластыря – прекрасная альтернатива. Гормональный контрацептив для трансдермального применения — это последнее достижение медицины в контрацепции [14]. Он представляет собой тонкий гладкий лейкопластырь, размерами примерно 5х4, общей площадью примерно 20 кв. см. Наклеивается такой пластырь один раз в неделю на лопатку, ягодицы, плечо или живот. На Рисунке 14 показаны способы применения более наглядно. В течение одного менструального цикла используются три пластыря, каждый из которых накладывается на 7 дней. Заменять пластырь необходимо в один и тот же день недели [14]. В России самым популярным является контрацептивный пластырь Евра® (Рисунок 15). Он выделяет такие вещества, как этинилэстрадиол и норелгестромин. Благодаря этим веществам гормональное средство контрацепции воздействует на яичник таким образом, что он перестает вырабатывать пригодные для оплодотворения яйцеклетки [13]. Эффективность трансдермальной системы не зависит от места аппликации пластыря (живот, ягодицы, верхняя часть руки или торс, исключение — молочные железы). На нее практически не влияют повышенная температура окружающей среды, влажность воздуха, физические нагрузки, погружение в холодную воду [12]. Известно, что применение КОК ассоциируется с рядом побочных реакций (головная боль, тошнота, масталгия и мастодиния). Но трансдермальное введение стероидов позволяет уменьшить выраженность указанных эстрогензависимых побочных эффектов, в отличие от оральных препаратов [14]. Противозачаточные средства в виде пластыря обладают целым рядом дополнительных преимуществ:
Однако есть и недостатки в использовании контрацептивного пластыря:
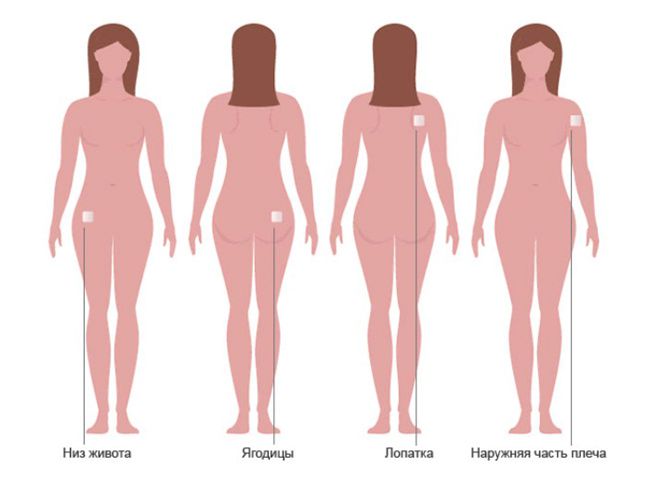 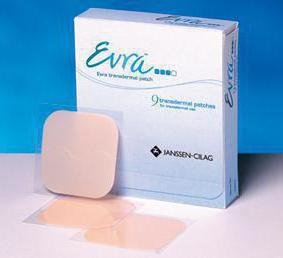 Рисунок 14. Способы нанесения ТТС Евра® Рисунок 15. ТТС Евра®
В ходе работы были преодолены следующие задачи:
|
