ПРОЦЕССЫ КОРРОЗИИ МЕТАЛЛОВ. Реферат Коррозия Металлов. Процессы коррозии металлов
 Скачать 227.43 Kb. Скачать 227.43 Kb.
|
|
ПРОЦЕССЫ КОРРОЗИИ МЕТАЛЛОВ Процесс коррозии представляет собой самопроизвольное разрушение металлов и сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой. Цель данной работы: на основании теоретического материала расширить теоретические представления о коррозии металлов и причинах их возникновения, а также рассмотреть существующие методы борьбы с ними. Можно выделить 3 признака, характеризующих коррозию металлов[1]: 1. С химической точки зрения это процесс окислительно-восстановительный, в результате которого металлы переходят в окисленную форму и теряют свои свойства. 2. При наличии постоянного контакта с окружающей средой это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл + компоненты окружающей среды. 3. Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла. Виды коррозии металлов 1. По площади повреждения Коррозия металлов имеет свои характерные черты по форме и глубине поражения металла, так различают равномерную (рисунок 1а, 1б), местную (рисунок 1в – 1ж) и межкристаллическую (рисунок 1з, 1и).  Рисунок 1 – Виды коррозионного разрушения металла по форме: а – равномерное; б – неравномерное; в – структурно – избирательное; г – пятнами; д – язвами; е – точками; ж – подповерхностное; з – межкристаллическое; и – внутрикристаллическое Данный рисунок характеризует коррозию металлов как непрерывно протекающий процесс разрушающий металл по площади, поражающий в определённых очагах возникновения, либо на структурном уровне. Особенно опасна межкристаллическая коррозия, которая, не разрушая металл с поверхности, распространяется вглубь по границам зерен кристаллов, в результате чего ослабевают связи между зернами структуры сплава. 2. По механизму возникающих процессов А) Химическая коррозия Химическая коррозия металлов – это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь. Характерна для сред, не проводящих электрический ток. В этом случае происходит непосредственное взаимодействие металла с составными частями среды (окислителями) – с газами (O2, Cl2, HCl, H2S и т. д.) и неэлектролитами (безводный спирт, бензол). Химическая коррозия металлов бывает газовой и коррозией в неэлектролитах: Газовая химическая коррозия развивается под действием агрессивных газов, таких как H2, Cl2, F2, оксидов азота и др. Например, 2Fe+3Cl2=2FeCl3 Или же под действием газов, входящих в состав атмосферы, таких как O2, N2, CO2 и т. д. при высоких температурах. Например, 2Zn+O2=ZnO С повышением температуры скорость окисления многих металлов сильно возрастает. На железе видимые признаки коррозии появляются при температуре 250-300 °С: 2Fe+O2=FeO При 600 °С и выше вся поверхность металла покрывается слоем окалины, содержащей FeO, Fe3O4, Fe2O3. Этот слой не плотен, имеет трещины и поры, через которые кислород продолжает поступать к металлу. Поскольку окалина не защищает железо от дальнейшей коррозии, при нагревании до 800 °С и выше скорость его разрушения заметно растет. Разрушение металлов на воздухе значительно ускоряется в присутствии сернистого газа (SO2), углекислого газа (CO2) и водяных паров (H2O): Fe+CO2+H2O=FeCO3+H2º Вероятно, при этом образуется еще более пористая пленка оксидов, в том случае, когда металл непосредственно взаимодействует только с кислородом. Коррозия металлов в неэлектролитах т. е. в жидких средах, не обладающих электропроводностью (нефть, нефтепродукты и другие органические соединения), представляет опасность для резервуаров, трубопроводов и другого оборудования в системе транспорта и хранения нефти. Входящие в состав нефти и моторных топлив углеводороды в чистом виде, и при отсутствии воды неактивны по отношению к металлам. Опасными в коррозионном отношении они становятся при наличии в них сернистых соединений (меркаптанов, сероводорода, сернистого газа и т. п.) [1, 2]. Сероводород образует сульфиды с железом, свинцом, медью и их сплавами. При взаимодействии меркаптанов с никелем, серебром, медью и свинцом получаются производные тиолов – тиолаты. Сера взаимодействует с медью и серебром с образованием сульфидов. Повышение температуры ускоряет коррозию металлов в нефти, а наличие воды в нефти резко ускоряет процесс, вызывая электрохимическую коррозию [1, 2]. Однако довольно часто на поверхности металла в качестве продукта коррозии образуется защитная оксидная пленка. Она препятствует проникновению к металлу как газов, так и жидкостей. Коррозия замедляется или вовсе прекращается. Чем эта пленка плотнее, тем выше ее защитные свойства. Металл становится химически неактивным и переходит в пассивное состояние. Защитная пленка всегда есть на алюминии. Железо легко пассивируется азотной кислотой. Вещества, которые способствуют возникновению на металле защитной активной пленки, называются пассиваторами. Некоторые вещества, наоборот, вызывают разрушение или рыхление защитной пленки и тем самым усиливают коррозию. Такие вещества называют активаторами коррозии. В первую очередь к ним относятся вещества, содержащие ионы (Cl-) [3]. При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью[4]. Б) Электрохимическая коррозия Электрохимическая коррозия – разрушение металла в среде электролита вследствие перехода электронов от одних участков металла к другим с возникновением внутри системы электрического тока. При таком типе коррозии атом удаляется из кристаллической решетки в результате двух сопряженных процессов: Анодного – металл в виде ионов переходит в раствор. Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель). Такую коррозию называют еще гальванической коррозией, поскольку разрушение металла происходит под действием возникающих гальванических пар. Причины возникновения гальванических элементов на поверхности металла, погруженного в электролит – разность потенциалов между отдельными участками его поверхности. Эта разность потенциалов возникает по разным причинам. 1. Контакт с электролитом двух разных металлов (например, между алюминиевой и медной частями детали); 2. Различное состояние поверхности металла (например, микропара на поверхности металла, покрытого пленкой, в которой имеются поры); 3. Различие в составе электролита, соприкасающегося с металлом; 4. Различный уровень механических напряжений в одной и той же детали. Например, при коррозии железа, находящегося в контакте с медью в растворе соляной кислоты, возникает гальванический элемент. Как известно, при работе гальванических элементов имеет место поляризация электродов. В результате поляризации катодного участка на нем скапливается избыток электронов, его потенциал становится более отрицательным (Ek) и в конце концов может почти сравняться с потенциалом анода. Это вызывает уменьшение коррозионного тока, замедление коррозии. То есть, в случае коррозии поляризация электродов играет положительную роль. И если бы в электролите отсутствовали вещества, способные принимать электроны (деполяризаторы), процесс коррозии мог почти совсем прекратиться. Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества, способствующие отводу – деполяризаторами. Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией. K(+) 2H++2е-=H2; K(+) O2+2H2O+4e-=4OH-. Водородная деполяризация имеет место в растворах кислот с высокой концентрацией ионов Н+. В случае коррозии луженого железа в среде HCl при нарушении покрытия возникает гальванический элемент: (-) Fe /HCl/ Sn (+). Более активный металл (с более отрицательным потенциалом) – железо окисляется, посылая электроны к атомам олова, и переходит в раствор в виде ионов Fe2+: A(+) Fe-2e-=Fe2+ (анодный процесс) На олове восстанавливаются ионы водорода: K(+) 2H++2e-=H2 (катодный процесс) Приток электронов к катоду поляризует его, а ионы H+, связывая электроны, выполняют функцию деполяризатора. Суммарное уравнение: Fe+2H+=Fe2++H2; Fe+2HCl=FeCl2+H. На коррозию в этом случае влияет скорость реакции выделения водорода, которая зависит от природы металла и вида поверхности, а также pH и температуры. Коррозия с кислородной деполяризацией протекает в слабо кислых, нейтральных средах. Например, при контакте железа и меди, находящихся во влажном воздухе или в водной среде, образуется гальваническая пара: (-) Fe /H2O, O2/ Cu (+). Здесь протекают следующие процессы: A(-) 2Fe-4e-=2Fe2+ (анодный процесс) K(+) О2+2H2O+4e-=4OH- (катодный процесс) На коррозию в этих условиях влияет скорость диффузии кислорода, которая усиливается при перемешивании раствора. Возрастает коррозия и при увеличении концентрации растворенного кислорода. Молекулы растворенного кислорода являются окислителями, поэтому связывают электроны, которые посылает к катоду железо. Ионы Fe2+ соединяются с ионами OH-: Fe2++2OH-=Fe(OH)2 Образующаяся гидроокись Fe(OH)2 окисляется кислородом воздуха до Fe(OH)3: 4Fe(OH)2+O2+ 2H2O=4Fe(OH)3, которая частично отщепляет воду, образуя соединение, отвечающее по составу бурой ржавчине: Fe(OH )3=FeOOH+H2O. В конечном итоге железо разрушается, покрываясь рыхлым слоем ржавчины, состав которой сложен и выражается формулой: xFe*yFe2O3*zH2O. Чаще всего процессы электрохимической коррозии сопровождаются кислородной деполяризацией. Причиной образования гальванических элементов может быть различная концентрация кислорода на разных участках металла. Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии: Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде. Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии. Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее. Разрушение подземных сооружений: свай, газо-, водо- и нефтепроводов, металлических конструкций – обусловлено наличием в почве влаги, содержащей кислород. Однако при очень большой влажности коррозия почти прекращается, так как вода заполняет поры в почве и препятствует доступу кислорода. Коррозии способствует хорошая электропроводность почвы и низкое значение pH. Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала. Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ. Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла. Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов[4]. Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов: Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы – кадмий. Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители. Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом. В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах. Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием. Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители. Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей. Рисунок 2 иллюстрирует процесс электрохимической коррозии, которая вызывается блуждающими токами, исходящими от электроустановок, работающих на постоянном токе (трамвай, метро и т.д.). Блуждающие токи разрушают металлические сооружения, находящиеся в земле, вызывая появление на них участков входа и выхода постоянного тока. Места выхода тока – анодные зоны подвергаются разрушению. 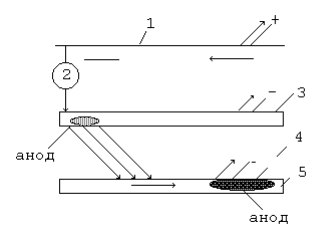 Рисунок 2 - Коррозия под воздействием блуждающих токов: 1 – провод; 2 – электродвигатель трамвая; 3 – рельс; 4 – влажный грунт; 5 – труба. Процесс в анодных зонах: A(-) Feº-2e-=Fe2+. Процессы в катодных зонах: F(+) 2H++2e-=H2или K(+) О2+2H2O+4e-=4OH- Блуждающие токи достигают сотен ампер и могут действовать в радиусе нескольких километров. Количественной характеристикой коррозии является скорость коррозии. Ее выражают либо через потерю массы образца с единицы площади поверхности, либо через уменьшение толщины металла в единицу времени. На скорость коррозии во всех случаях оказывают влияние различные факторы, так или иначе приводящие к изменению условий поляризации электродов: 1. Скорость коррозии тем больше, чем дальше в ряду напряжений стоят друг к другу металлы, образующие гальваническую пару. 2. Коррозия значительно ускоряется с повышением температуры. 3. Коррозия протекает тем быстрее, чем выше кислотность электролита. 4. Коррозия значительно ускоряется с повышением влажности, как в воздухе, так и в почве, пока вода не начинает препятствовать доступу кислорода. На электрохимическую коррозию, так же, как и на химическую, оказывают влияние продукты самой коррозии. Если они покрывают металл плотной оксидной пленкой, которая препятствует проникновению газов и жидкостей, коррозия прекращается (Al, Zn, Cr). На железе продукты коррозии откладываются в рыхлой форме. Они проницаемы для окислителей, поэтому не обладают защитными свойствами. Коррозионные процессы являются необратимыми, наносят большой вред народному хозяйству. Поэтому защита металлов от коррозии имеет первостепенное значение. Методы защиты металлов от коррозии Противокоррозионной защитой называют процессы или средства, применяемые для уменьшения или прекращения коррозии металла. [5] Большинство широко применяемых металлов неустойчивы в окружающей среде и корродируют. Меры противокоррозионной защиты помогают сэкономить миллионы тонн металла и тем самым сократить расходы на его производство. Важнейшими методами защиты металлов от коррозии являются: защита покрытиями, создание сплавов с антикоррозионными свойствами (добавление к стали Si, Ni, Co, C), электрохимические методы, изменение состава среды. 1. Защитные покрытия Защитные покрытия изолируют металл от внешней среды. Это основное условие защиты. Покрытия могут быть металлическими и неметаллическими. Неметаллические покрытия 1. Лаки, краски, эмали, полимерные покрытия и т. д. 2. Покрытия в виде защитных оксидных и труднорастворимых пленок (оксидирование, фосфатирование и т. д.). Нанесение пленок осуществляется чаще всего либо химическим путем, либо электрохимическим. Пример химического оксидирования – воронение стали. Процесс идет около часа, при температуре 140°С в растворе, содержащем NaOH, NaNO3, NaNO2, после этого металл обрабатывают веретенным маслом. Пример электрохимического оксидирования – анодирование алюминия. Металл на 20 минут помещают в раствор H2SO4 и подключают к положительному полюсу источника тока. Анодный процесс в этом случае: SO42-+H2O-2e-=SO42-+2H++O; 2Al+3O=Al2O3. В электролит можно добавлять красители и получать пленки разного цвета. Металлические покрытия также наносят или химическим, или электрохимическим способом. Покрытия могут быть анодными и катодными. В качестве покрывающих выбирают такие металлы, на поверхности которых имеется оксидный слой, обуславливающий их химическую пассивность (Al, Zn, Sn, Cr, Pb), или заведомо пассивные металлы (Au, Ag, Cu). Анодным называют покрытие, если его потенциал более отрицателен, чем у защищаемого металла. Например, цинковое покрытие на железе. 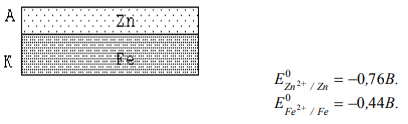 При нарушении покрытия разрушается не железо, а цинк, как более активный металл. А если целостность покрытия не нарушена, цинк тоже не корродирует, поскольку его поверхность покрыта защитной оксидной пленкой. Катодные покрытия создаются металлом с более положительным потенциалом, чем у защищаемого металла. Например, покрытие оловом железа. 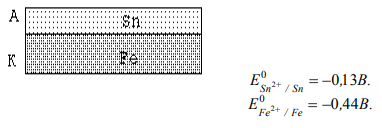 При нарушении катодного покрытия коррозия металла протекает гораздо быстрее, чем на чистом металле. Степень такой защиты определяется прочностью покрытия. 2. Сплавы Сплавами называют системы, состоящие из двух или более металлов, а также из неметаллов. Сплавы получают смешением металлов в расплавленном состоянии, при последующем охлаждении они затвердевают, образуя различные структуры. В состав сплава входят металлы, кристаллизующиеся в однотипных решетках и имеющие близкие по размерам атомы, например, Ag – Cu, Cu – Ni, Ag – Au. При охлаждении таких расплавов получают твердые растворы. По сравнению с исходными металлами, твердые растворы характеризуются более высокой прочностью, твердостью и химической стойкостью; они пластичны и хорошо проводят электрический ток. Легирование или обработка материала конструкции в массе в процессе металлургической обработки другими металлами или специальными добавками, способными увеличить его сопротивление коррозионному износу (разрушению). Например, добавка к обычной углеродистой стали 18 % хрома и 8 % никеля дает возможность получить нержавеющую сталь. Такой сплав обладает высокими антикоррозионными свойствами не только в любых атмосферных условиях, но и во многих агрессивных средах. Сплавы на основе меди Бронза – медь (до 90%) и различные металлы: олово, алюминий, свинец, кремний и др. Бронзы обладают ценными механическими свойствами. Латунь – медно-цинковые сплавы (медь – от 50 до 96%, цинк – от 50 до 4%). Латунь является более твердой, чем исходные металлы. Мельхиор – сплав меди с никелем (медь от 80 до 70%, никель – от 20 до 30%). Сплавы на основе алюминия Силумин – сплав алюминия с кремнием (кремний – до 23%). Для силумина характерны значительная прочность, высокое механическое сопротивление и большая, чем у алюминия, химическая стойкость. Купроалюмин – алюминий (92 – 98%), медь (8 – 12%). Дюралюминий – сложный сплав: Al (93%), Cu (4%), Mg (1%), Si (1%), Mn (1%). Дюралюминий по твердости приближается к стали. Сплавы на основе никеля Нихромы – сплавы никеля с хромом и другими металлами. Более устойчивы к окислению, сохраняют высокие механические качества при сильном нагревании. Сплавы на основе железа Сталь – сплав железа с углеродом и металлургическими примесями. Обладает большей твердостью по сравнению с железом. Чугун – сплав железа с углеродом и металлургическими примесями. Тверд и хрупок по сравнению с железом. 3.Электрохимические методы защиты Электрохимические методы защиты применимы только для конструкций, находящихся в среде электролита. Протекторная защита (рисунок 3) применяется, например, для защиты подземных трубопроводов, находящихся в почвенных водах. Защищаемую конструкцию соединяют с протектором из более активного металла, чем сама конструкция. Протектор в процессе коррозии является анодом и разрушается, предохраняя тем самым от разрушения конструкцию, на которой идет процесс восстановления окислителя. При защите стали применяют протектор из магния, алюминия, цинка. 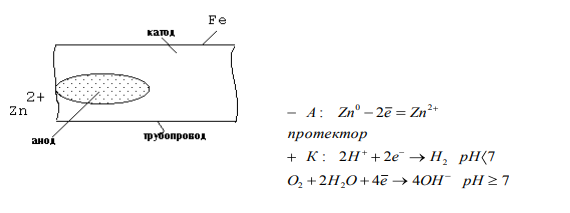 Рисунок 3 – Принцип протекторной защиты от коррозии Катодная электрозащита (рисунок 4). Конструкцию подсоединяют к отрицательному полюсу источника тока (в качестве катода). К положительному полюсу присоединяют бросовый кусок железа, который разрушается при работе системы. 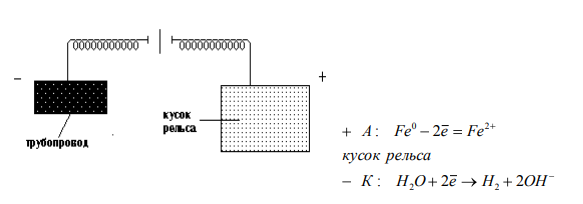 Рисунок 4 – Принцип катодной защиты от коррозии 3. Изменение состава среды Для защиты от коррозии возможны два случая изменения состава среды: а) удаление вредных примесей, усиливающих коррозию (например, удаление растворенного кислорода из воды); б) введение специальных веществ, замедляющих коррозию – ингибиторов. Эти вещества, введенные в незначительном количестве в коррозионную среду, значительно снижают скорость коррозии, препятствуют ее протеканию. В зависимости от природы металла, условий эксплуатации применяют различные ингибиторы. По характеру действия и свойствам ингибиторы подразделяют на две большие группы: нелетучие ингибиторы и летучие ингибиторы. В качестве ингибиторов применяют как неорганические, так и органические вещества. В качестве неорганических ингибиторов коррозии широко применяют соли натрия и калия, нитриты, хроматы, бихроматы, фосфаты, силикаты (NaNO2, Na2CrO4, Na2Cr2O7, Na3PO4, Na2SiO3). Эти соли являются пассиваторами, т. е. образуют на поверхности металла нерастворимую в условиях коррозии защитную пленку из оксидных соединений. Неорганические ингибиторы тормозят анодную реакцию, что замедляет анодное растворение металла. В качестве органических ингибиторов применяют вещества, принадлежащие к различным классам органических соединений: к альдегидам, гетероциклическим соединениям, белкам и т. д. Органические ингибиторы прочно адсорбируются на поверхности металла, образуя тонкие пленки, при этом они выводят из строя коррозионные микропары, препятствуя анодному или катодному процессу или обоим вместе. Замедлителями коррозии в кислотах являются в большинстве случаев органические вещества, содержащие азот (уротропин C6H16N4 и др.). За счет не поделённой пары электронов азота такие соединения адсорбируются на поверхности металла, изолируя ее от окружающей среды. Третий, наиболее распространенный и универсальный, способ антикоррозионной защиты состоит в создании непроницаемого барьера между конструкционным материалом и коррозионной средой в виде различных защитных покрытий [4]. Литература: 1. Кузнецов М.В., Противокоррозионная защита трубопроводов и резервуаров - М: Недра, 1992. — 240 c. 2. Макаренко В.Д. и др. Основы коррозионного разрушения трубопроводов - Тюмень: ТюмГНГУ, 2009. — 404 с. 3. Федосова Н.Л. Антикоррозионная защита металлов. – Иваново, 2009. – 187 с. 4. Федосова Н.Л., Румянцева В.Е., Румянцева К.Е. и др. Антикоррозионная защита металлов в строительстве. Иваново: ИГАСУ, 2010. 188 с. 5. Жарский И.М., Иванова Н.П., Куис Д.В., Свидунович Н.А. Коррозия и защита металлических конструкций и оборудования - Учеб. пособие. - Минск: Выш. шк., 2012. - 303 с. 6. Фримантл М. Химия в действии. В 2-х ч. М., Мир, 1991; 7. http://www.rmnt.ru - Коррозия металла -- причины возникновения и методы защиты. |
