Реферат на тему: Процессы теплопередачи при рафинировании хрома. теплопередача. Процессы теплопередачи при рафинировании хрома
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
Электролитический хром и способ его производстваХром впервые был открыт во Франции в 1797 году химиком Л. Н. Вокленом, который выделил новый тугоплавкий металл с примесью карбидов. Он прокалил зелёный оксид хрома Cr2O3 с углём, а сам оксид получил разложением «Сибирского красного свинца» — минерала крокоита PbCrO4, добытого на Среднем Урале, в Березовском золоторудном месторождении, и впервые упомянутого в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда. Современный способ получения чистого хрома (с 1894 г.) отличается от способа Воклена только видом восстановителя. Процесс электролитического покрытия железа хромом разработан в 20-х годах XX в. Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений. Простое вещество хром — твёрдый блестящий металл голубовато-белого цвета, как представлено на рисунке 1. Хром иногда относят к чёрным металлам. Данный материал плавится при температуре 1875 °С и имеет плотность 7,16 г/ 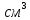 . При обыкновенной температуре хром стоек к воде и воздуху. Разбавленная серная и соляная кислоты растворяют хром с выделением водорода. Но в холодной азотной кислоте хром, подобно алюминию, нерастворим и после обработки азотной кислотой становится пассивным. . При обыкновенной температуре хром стоек к воде и воздуху. Разбавленная серная и соляная кислоты растворяют хром с выделением водорода. Но в холодной азотной кислоте хром, подобно алюминию, нерастворим и после обработки азотной кислотой становится пассивным.  Рисунок 1. Простое вещество хром. Хром относится к металлам шестой группы периодической системы Д.И. Менделеева. Обозначается символом Cr (лат. Chromium). Таблица 1
Наружный слой атомов элементов подгруппы хрома содержит один или два электрона, что обуславливает металлический характер этих элементов и их отличие от элементов главной подгруппы. Вместе с тем их максимальная положительная валентность равна шести, так как, помимо наружных электронов, в образовании связей может участвовать еще соответствующее число электронов из недостроенного предпоследнего слоя.1 Хром и его аналоги не образуют водородистых соединений. Наиболее типичны для них производные высшей валентности, во многом сходные с соответствующими соединениями серы. Элементы подгруппы хрома имеют большое значение в технике. Ранее их использовали главным образом как добавку к стали с целью придания ей необходимой твердости, вязкости и коррозионной стойкости. Теперь их применяют также в чистом виде и в виде сплавов как самостоятельные конструкционные материалы. Хром содержится в земной коре в количестве 0,03 вес. %. В природе он встречается главным образом в виде хромистого железняка FeO · 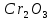 , богатые месторождения которого имеются на Урале, в Казахстане, Южно-Африканской Республике, Турции, Южной Родезии, на Филиппинах и в Югославии. Добыча хромовый руды составляет в настоящее время около 3 млн. тонн или, в пересчете на металлический хром, около 1,4 млн. тонн. , богатые месторождения которого имеются на Урале, в Казахстане, Южно-Африканской Республике, Турции, Южной Родезии, на Филиппинах и в Югославии. Добыча хромовый руды составляет в настоящее время около 3 млн. тонн или, в пересчете на металлический хром, около 1,4 млн. тонн.Металлический хром применяется главным образом в сталелитейной промышленности. Стали, содержащие 1-2% хрома, обладают большой твердостью и прочностью и служат для изготовления инструментов, ружейных и орудийных стволов, броневых плит и различных машинных частей. Так называемая «нержавеющая сталь» содержит около 12% хрома. Широкое распространение, особенно в инструментальной и автомобильной промышленности, получило хромирование, т.е. покрытие хромом других металлов для предохранения их от коррозии. Так как хром обладает относительно высокой твердостью, то покрытые им изделия хорошо сопротивляются износу. Хромирование осуществляется электролитическим путем, позволяющим получить твердый, плотно пристающий, блестящий слой металла. Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. В начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими. Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода. Технический или прикладной электролиз характеризуется сложностью протекающих в промышленных условиях электролитических процессов, различными видами электролиза, их зависимостью от природы электролита, типа электролитической ванны, оптимизации самих электролизных процессов. Электролитические процессы классифицируются следующим образом: - получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.; - получение металлов (литий, натрий, калий, берилий, магний, цинк, алюминий, медь и т.д.); - очистка металлов (медь, серебро и др.); - получение металлов и сплавов; - получение гальванических покрытий; - обработка поверхностей металлов (азотирование, борирование, электрополировка и очистка); - нанесение пленок при помощи электрофореза. Актуальность электролиза объясняется тем, что многие вещества получают именно этим способом. Например, такие металлы как хром высокой чистоты, никель, натрий, чистый водород и другие, получают только с помощью этого метода. Кроме того, с его помощью электролиза относительно легко можно получить чистые металлы, массовая доля самого элемента в которых стремиться к ста процентам. В промышленности высокочистый электролитический хром, в большинстве случаев получают именно электролизом. Преимущество этого способа в относительной дешевизне и простоте. Однако, чтобы производство было наиболее выгодным: с наименьшими затратами электроэнергии и с наибольшим выходом продукции, необходимо учитывать различные факторы, влияющие на количество и качество продуктов электролиза (сила тока, плотность тока, температура электролита, материал электродов и охлаждающие электролит установки). Основой технологического процесса получения металлического хрома является электролитическое выделение металла на катоде экстракцией из водного раствора хромового ангидрида. Катодный осадок металла представляется собой продукт высокой чистоты. Осаждение хрома производится из электролита, содержащего хромовый ангидрид, изображенный на рисунке 2 (далее CrO3).  Рисунок 2. Хромовый ангидрид. Процесс электролитического выделения хрома на катоде происходит при добавлении сульфата ионов. Суммарное уравнение химической реакции имеет вид: CrO3 + H2O 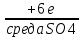 →Cr0 + H2↑ + 2O2↑ →Cr0 + H2↑ + 2O2↑На катоде протекают следующие реакции: Cr6+ + 6e → Cr Cr6+ + 3e → Cr3+ 2H+ 2e → H2↑ (удаляется из ванны в виде газа). На нерастворимом аноде протекают следующие реакции: Cr3+ + 3e → Cr6+ 4OH + 4e → 2H2O + O2↑ (удаляется из ванный в виде газа). Под воздействием постоянного тока находящиеся в электролите ионы шестивалентного хрома выходят к поверхности катода и разряжаются на нем с образованием сплошных слоев чешуйчатого металлического хрома. Одновременно с разрядом ионов хрома на катоде происходит разряд ионов водорода, а также восстановление шестивалентного хрома до трехвалентного. Ток, проходящий через электролит, расходуется как на выделение хрома, так и на выделение водорода и восстановление Cr6+ до Cr3+. В процессе электролиза выделяется тепло. Для электролиза используются монополярные электролизеры с параллельным включением анодов и катодов. В конечном итоге на катодах оседает элетролитический хром имеющий вид чешуек и следующие химические параметры представленных в таблице 2: Таблица 2
Получаемый электролитический хром методом электролиза, как уже было сказано ранее имеет чешуйчатую форму и имеет серый матовый цвет. Для наглядного примера данный материал изображен на рисунке 3.  Рисунок 3. Электролитический хром. В свою очередь для максимальной производительности при производстве электролитического хрома методом электролиза требуется соблюдать следующие параметры температуры электролита. Параметры отражены в таблице 3. Таблица 3
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
