проект по экологии. проект по экологии 2022. Проект Изучение состояния воды в прудеохлодители в рамках повышения уровня экологической образованности учеников среднего звена
 Скачать 499.86 Kb. Скачать 499.86 Kb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата исследования | Результат |
| Май 2021 | Слабо-желтоватая вода |
| Июль 2021 | прозрачная |
| Сентябрь 2021 | прозрачная |
Осадок
Взвешенные вещества, присутствующие в природных водах, состоят из частиц песка, глины, ила, других нерастворенных неорганических соединений, а также живых микроорганизмов и водных организмов и их отмерших остатков.
Исследуемая вода (таблица 2):
| Дата исследования | Результат |
| Май 2021 | Незначительный коричневый илистый осадок |
| Июль 2021 | Незначительный коричневый илистый осадок |
| Сентябрь 2021 | Незначительный коричневый илистый осадок |
Мутность
По результатам наблюдения определяют мутность исследуемой пробы в соответствии со следующей шкалой, характеризующей мутность:
прозрачная;
слабо мутная;
мутная;
очень мутная.
Мутность определяется качественно, и часто разные наблюдатели дают разные оценки.
Исследуемая вода была оценена (таблица 3):
| Дата исследования | Полученный результат |
| Май 2021 | Слабо мутная |
| Июль 2021 | Прозрачная |
| Сентябрь 2021 | прозрачная |
Запах
Запах воды вызывают летучие пахнущие вещества, поступающие в воду в результате процессов жизнедеятельности водных организмов, при биохимическом разложении органических веществ, содержащихся в воде (таков, например, процесс гниения органических остатков умерших организмов), а также с промышленными, сельскохозяйственными (стоки животноводческих ферм) и хозяйственно-бытовыми сточными водами.
Запах воды характеризуется также интенсивностью, которую измеряют в баллах.
Запахи естественного происхождения
| Характер запаха | Примеры запахов соответствующего ряда |
| Ароматический | Огуречный, цветочный |
| Болотный | Илистый, тинистый |
| Гнилостный | Фекальный, навозный |
| Древесный | Мокрой щепы, древесной коры |
| Землистый | Прелый, свежевспаханной земли |
| Плесневой | Затхлый |
| Сероводородный | Тухлых яиц |
| Травянистый | Сена, скошенной травы |
| Неопределенный | |
Балльная оценка запаха
| Балл | Интенсивность | Качественная характеристика |
| 0 | Никакого | Отсутствие запаха |
| 1 | Очень слабый | Обнаруживается при нагревании |
| 2 | Слабый | Обнаруживается только при тщательном обследовании |
| 3 | Заметный | Легко обнаруживается |
| 4 | Отчетливый | Заставляет воздерживаться от питья |
| 5 | Очень сильный | Вода не годится для любого употребления без специальной подготовки |
Вода была оценена следующим образом (таблица 4):
| Дата исследования | Полученный результат |
| Май 2021 | Неопределенный, очень слабый |
| Июль 2021 | Травянистый, очень слабый |
| Сентябрь 2021 | Отсутствие какого-либо запаха |
Внешний вид водного объекта
Ранее уже упоминалось о том, что внешний вид водного объекта может дать очень важную информацию о качестве воды в нем.
Внешний вид водного объекта можно охарактеризовать также следующим образом:
наличие или отсутствие пленок и пятен на поверхности воды, нефтяных пятен на берегу, на водных и прибрежных растениях;
наличие и состав плавающего мусора или мусора на дне и берегах реки;
искусственные или естественные запруды из веток или упавших деревьев;
наличие омутов, отмелей и др.
Наличие или отсутствие нефтяных пленок (обычно радужных) и пятен на поверхности воды, нефтяных пятен на берегу и растениях характеризуют уровень загрязнения водного объекта, который можно выразить в баллах (таблица 5).
| Балл | Внешний вид загрязнения |
| 1 | Отсутствие пленок и пятен на поверхности воды, отсутствие мусора, искусственных либо естественных запруд; |
| 2 | Отдельные пленки и пятна, в том числе нефтяные, на поверхности воды, незначительное количество мусора; |
| 3 | Пленки нефти на водных растениях, значительное замусоривание; |
| 4 | Пятна и пленки нефти на большей части поверхности и берегах водного объекта, значительное замусоривание; |
| 5 | Поверхность воды покрыта нефтью даже во время волнения, очень много мусора по берегам, в воде и на дне. |
Выражая в баллах уровень загрязненности водного объекта и его запах, можно получить сводные результаты, характеризующие общую степень загрязнения вод (таблица 6).
| Степень загрязнения вод | Запах (балл) | Внешний вид (балл) |
| Очень чистые | 0 | 1 |
| Чистые | 1 | 1 |
| Умеренно загрязненные | 2 | 2 |
| Загрязненные | 3 | 3 |
| Грязные | 4 | 4 |
| Очень грязные | 5 | 5 |
Исследуемый водоем по данной классификации может быть причислен к умеренно загрязненным.
Обработка результатов и выводы
Для более объективной оценки качества воды было отобрано три пробы с периодичностью в 1,5 месяца. Это дает возможность уменьшить неизбежные случайные погрешности при отборе проб и измерениях.
Таблица 7. Обобщенные результаты исследования органолептических свойств воды
| Номер пробы, дата, время и место отбора….. | |||||
| Характерис тика | Единица измерения | Значение показателя | |||
| I | II | III ... | среднее | ||
| Температура | оС | 14 | 19 | 13 | 15,3 |
| Цветность | словесное описание | Слабо-желтоватая | прозрачная | прозрачная | прозрачная |
| Осадок Объем Характер Цвет | словесное описание | Незначитель ный коричневый илистый осадок | Незначитель ный коричневый илистый осадок | Незначительный коричневый илистый осадок | Незначитель ный коричневый илистый осадок |
| Мутность | словесное описание | Слабо мутная | Прозрачная | Прозрачная | Прозрачная |
| Запах Характер Интенсивность | словесное описание; баллы | Неопределен ный, очень слабый | Травянистый, очень слабый | Отсутствие какого-либо запаха | Очень слабый, меняется по се- зонам |
| Внешний вид | баллы | 2 | 2 | 1 | 2 |
Вывод: по своим органолептическим показателям вода из пруда-охлодителя может быть оценена как пригодная для хозяйственного использования. Ни один из определенных показателей не противоречит нормам.
Определение химических показателей качества воды пруда-охлодителя
pH воды:
К 5 мл пробы воды добавляем 3-4 капли универсального индикатора, встряхиваем пробирку и сравниваем цвет воды со шкалой pH.[1]
pH пробы воды: 8
Норма СанПиН: 6-9
Вывод: pH в норме
Метод визуального колориметрирования:
Стеклянную пробирку или склянку с пробой помещаем над белым листом бумаги на расстоянии 0,5 – 1 см.
Освещая пробирку или склянку рассеянным белым светом достаточной интенсивности (в нашем случае, светом фонарика телефона), наблюдаем окраску раствора сверху вниз.
Ближайшее по окраске поле контрольной шкалы и соответствует значению того или иного показателя.
Общая жесткость
Общая жесткость определяется суммарной концентрацией ионов кальция и магния.
Суть метода состоит в том, что ионы кальция и магния связываются с индикатором, образуя комплексы, окрашенные в винно-красный цвет. Далее, при титровании с трилоном Б вышеупомянутые ионы образуют более прочный бесцветный комплекс, высвобождая индикатор, который окрашивает раствор в ярко-голубой цвет.
К 10 мл пробы воды добавляем 2-3 капли буферного аммиачного раствора и 1-2 капли раствора индикатора хромового тёмно-синего и встряхиваем. Титруем получившийся раствор раствором трилона Б (двунатриевая соль ЭДТА) (0,05 моль/л экв.) до перехода окраски в точке эквивалентности из винно-красной в ярко голубую.[1]
Вычисляем жёсткость по формуле[1]:
Сож=(𝑉ож×𝐻×1000)/𝑉а
Сож=(0,7×0,05×1000)/10 = 3,5 мг-экв/л
Vож – объем раствора трилона Б, израсходованного на титрование, мл;
H – концентрация титрованного раствора трилона Б, 0,05 моль/л экв.;
Vа – объем пробы, 10 мл;
1000 – коэффициент пересчета единиц измерения из моль в ммоль.
Общая жёсткость пробы воды: 3,5 мг-экв/л (°Ж)
Норма СанПиН: 7 мг-экв/л (°Ж)
Вывод: жёсткость средняя
Схемы реакций, представленные для кальция, идентичны и для магния[2]:
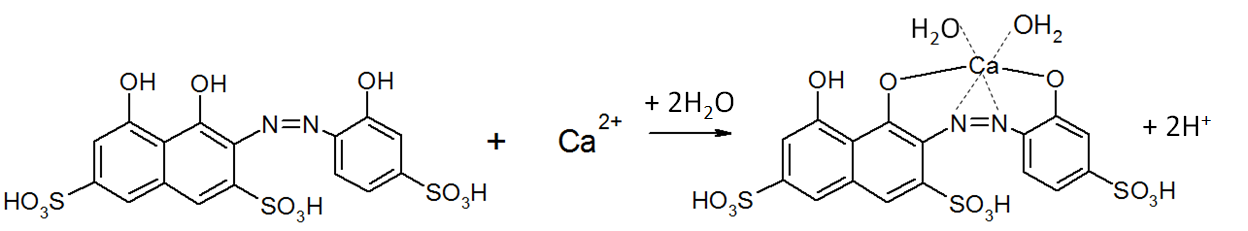 |
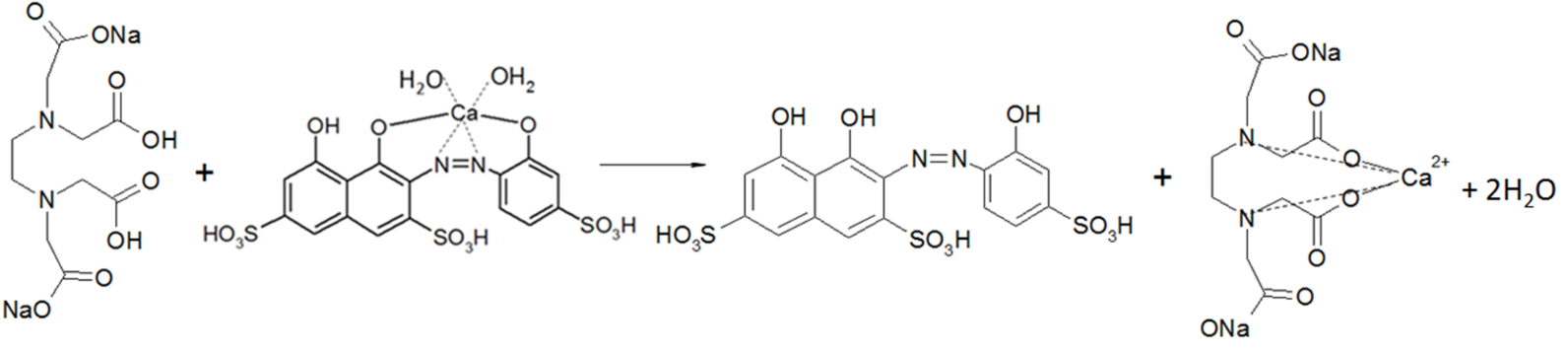 |
Общее железо
Общее железо определяется суммарной концентрацией ионов Fe2+ и Fe3+.
Суть метода заключается в способности иона Fe2+ образовывать в итервале рН 3-9 с орто-фенантролином комплексное оранжево-красное соединение. При наличии в воде ионов Fe3+ их восстанавливают солянокислым гидроксиламином в ацетатном буферном растворе при рН 4,5-4,7 по реакции:
2Fe3+ + 2NH2OH*HCl → 2Fe2+ + N2 + 2H2O + 2HCl + 2H+
К 10 мл пробы воды с pH=4-5 добавляем 4-5 капель раствора солянокислого гидроксиламина, 1 мл ацетатного буферного раствора и 0,5 мл раствора орто-фенантролина, встряхиваем. После 20 минут сравниваем раствор со шкалой. [1]
Общее железо в пробе воды: 0,3 мг/л
ПДК: 0,3 мг/л
Вывод: показатель равен ПДК
Схема образования комплексного соединения:
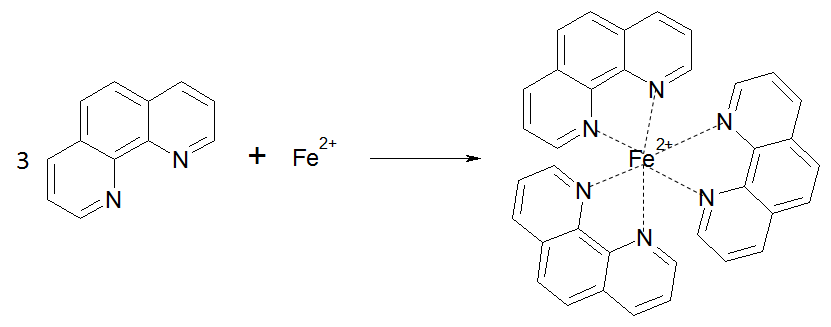 |
Нитраты
Метод основан на восстановлении нитрат-ионов до нитрит-ионов в слабокислой среде:
Zn + NO3- + 2H+→ Zn2+ + NO2- + H2O
Далее нитрит-ион в слабокислой среде реагирует с реактивом Грисса (смесь сульфаниловой кислоты и α-нафтиламина). При этом протекают реакции диазотирования и азосочетания, в результате которых образуется азокраситель, имеющий пурпурную окраску.
К 3 мл пробы воды добавляем 2-3 капли соляной кислоты (0,1 моль/л) и дистиллированную воду до 12 мл, перемешиваем, добавляем по 1 мерной ложке (без горки) реактива Грисса и порошка восстановителя, встряхиваем. Через 30 минут сравниваем со шкалой.[1]
Концентрация нитрат-ионов в пробе воды: 5 мг/л
ПДК: 45 мг/л
Вывод: показатель в норме
Схемы реакций диазотирования и азосочетания:
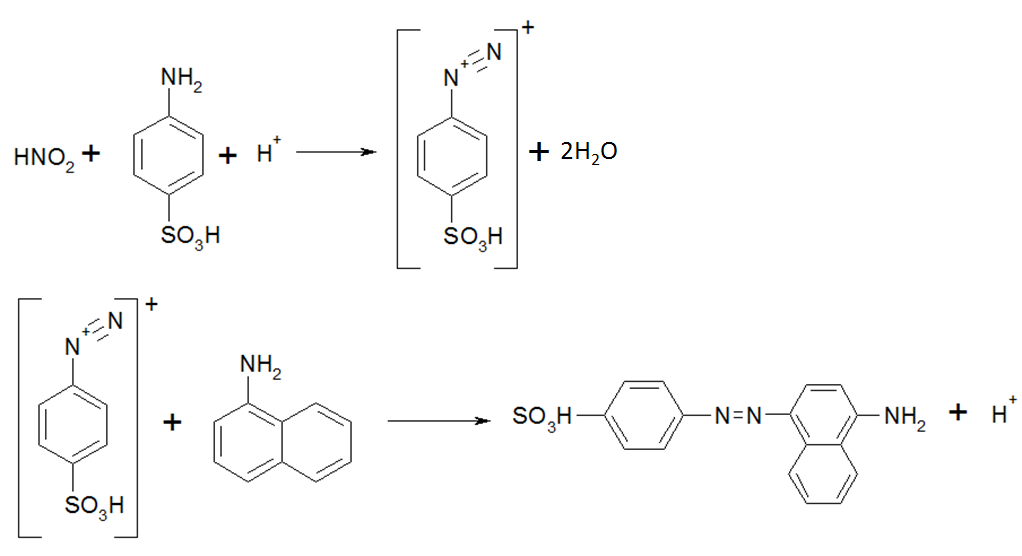 |
Нитриты
Определение нитрит-ионов проходит аналогично определению нитрат-ионов, но без предварительного восстановления вторых.
К 5 мл пробы воды добавляем 2-3 капли соляной кислоты (0,1 моль/л) и одну капсулу реактива Грисса, встряхиваем. Через 20 минут сравниваем со шкалой.[1]
Концентрация нитрит-ионов в пробе воды: 0,1 мг/л
ПДК: 3 мг/л
Вывод: показатель в норме
Сульфаты
Титриметрический метод определения сульфат-иона основан на его реакции с катионами бария с образованием нерастворимой суспензии сульфата бария:
Ba2+ + SO42- → BaSO4↓
Окончание титрования (точку эквивалентности) определяют по реакции избытка катионов бария с ортаниловым К с образованием окрашенного в голубой цвет комплексного соединения. Схема реакции образования комплексного соединения[3]:
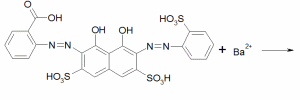 Голубое комплексное соединение |
Влияние ионов кальция и магния устраняют добавлением катионита.
К 2,5 мл пробы воды добавляем одну мерную ложку Катионита КУ-2-8Чс, встряхиваем 3 минуты, доводим рН до 4, добавляем ортанилового К до 5 мл, перемешиваем. Полученный раствор титруем раствором хлорида бария (0,02 моль/л экв.) до перехода окраски в точке эквивалентности из сине-фиолетовой в неисчезающую (2-3 минуты) голубую.[1]
Вычисляем концентрацию сульфат-ионов по формуле[1]:
Сс=(48,03×𝑉×𝐶б×1000)/𝑉п
Сс=(48,03×0,9×0,02×1000)/2,5 = 345,8 мг/л
V – объем раствора хлорида бария, израсходованного на титрование, мл;
Cб – концентрация титрованного раствора хлорида бария, 0,02 моль/л экв.;
Vп – объем пробы, 10 мл;
1000 – коэффициент пересчета единиц измерения из г в мг.
Концентрация сульфат-ионов в пробе воды: 345,8 мг/л
ПДК: 500 мг/л
Вывод: показатель в норме
Хлориды
Титриметрический метод определения хлорид-иона основан на его реакции с катионами серебра с образованием труднорастворимого осадка хлорида серебра:
Ag+ + Cl- → AgCl↓
После полного осаждения хлорид-ионов избыток ионов серебра реагирует с хроматом калия (выступает в роли индикатора) с образованием оранжево-бурого осадка хромата серебра:
2Ag+ + CrO42- → Ag2CrO4↓
Бромиды и иодиды титруются совместно, однако их вклад в результат незначителен.
К 10 мл пробы воды добавляем 3 капли раствора хромата калия и перемешиваем раствор. Получившийся раствор титруем раствором нитрата серебра (0,05 моль/л) до перехода окраски в точке эквивалентности из жёлтой в неисчезающую оранжево-бурую[1].
Вычисляем концентрацию хлорид-ионов по формуле[1]:
Схл=(35,5×𝑉×𝐻×1000)/𝑉п
Схл=(35,5×0,5×0,05×1000)/10 = 88,75 мг/л
V – объем раствора нитрата серебра, израсходованного на титрование, мл;
Cб – концентрация титрованного раствора нитрата серебра, 0,05 моль/л;
Vп – объем пробы, 10 мл;
35,5 – молярная масса эквивалента хлора, г/моль;
1000 – коэффициент пересчета единиц измерения из г в мг.
Концентрация хлорид-ионов в пробе воды: 88,75 мг/л
ПДК: 350 мг/л
Вывод: показатель в норме
Фториды
Определение фторид-ионов основано на их способности образовывать в водно-ацетоновой среде тройной комплекс сиренево-синего цвета с La3+ и ализаринкомплексоном. Схема реакции образования комплекса[2]:
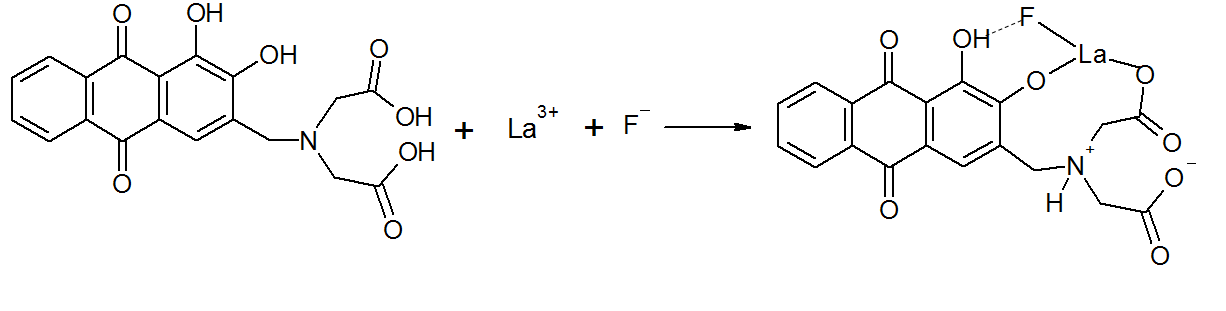 |
Раствор №1: К склянке с навеской ализаринкомплексона (0,0097 г) добавляем 1-2 капли раствора гидроксида натрия (1 моль/л) и 6 мл дистиллированной воды, доводим объем раствора до 25 мл, добавляем навеску натрия уксуснокислого (0,012 г), перемешиваем, добавляем по каплям раствор соляной кислоты (0,1 моль/л) до перехода окраски от вишнёво-красной до красно-оранжевой, доводим объём раствора до 50 мл. Раствор №2: Во флакон добавляем 2 мл ацетатного буферного раствора, 10 мл раствора нитрата лантана, 10 мл раствора №1 и 25 мл ацетона. Перемешиваем раствор. К 2,5 мл пробы воды добавляем раствор №2 до 5 мл, перемешиваем. Через 15 минут сравниваем со шкалой.[1]
Концентрация фторид-ионов в пробе воды: 0,2 мг/л
ПДК: 1,5 мг/л
Вывод: показатель в норме
Активный хлор
Метод основан на способности активного хлора, содержащегося в воде окислять йодид-ион до свободного йода, который дает с крахмалом синее окрашивание:
Cl2+2I- → I2 + 2Cl-
HClO + 2I- + H+→ I2 + Cl- + H2O
ClO- + 2I- + 2H+→ I2 + Cl- + H2O
Крахмал + I2 → синее окрашивание
При взаимодействии йода с крахмалом образуется соединение включения (клатрат) канального типа. Клатрат – это комплексное соединение, в котором частицы одного вещества («молекулы-гости») внедряются в кристаллическую структуру «молекул-хозяев». В роли «молекул-хозяев» выступают молекулы амилозы, а «гостями» являются молекулы йода. Молекулы йода располагаются в канале спирали диаметром 1 нм, создаваемой молекулой амилозы, в виде цепей ---I---I---I---I---I---. Попадая в спираль, молекулы йода испытывают сильное влияние со стороны своего окружения (ОН-групп), в результате чего увеличивается длина связи I–I до 0,306 нм (в молекуле йода длина связи 0,267 нм). Причем эта длина едина для всех атомов йода в цепи. Данный процесс сопровождается изменением бурой окраски йода на сине-фиолетовую. Амилопектин, в отличие от амилозы, дает с йодом красно-фиолетовое окрашивание.[5]
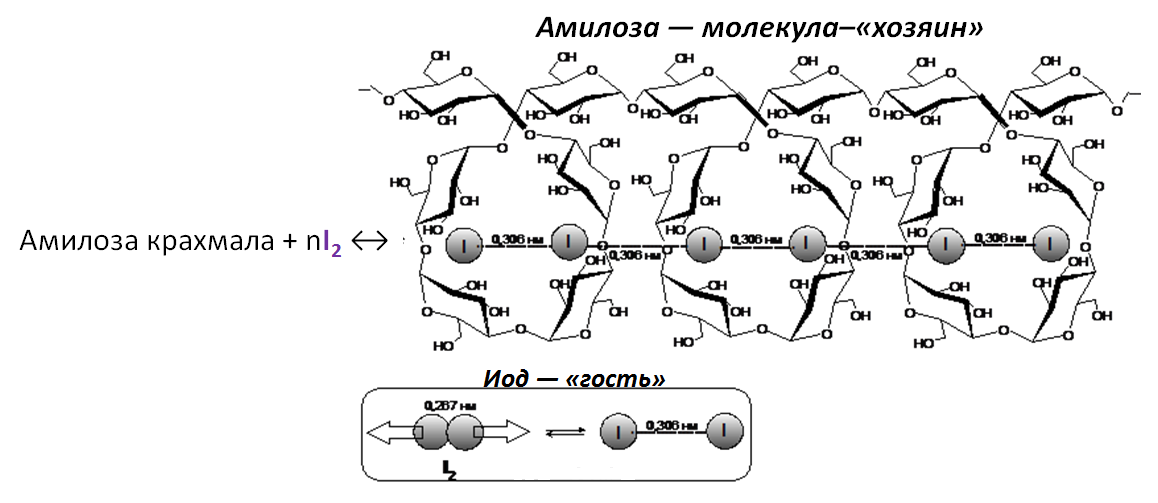 |
На тест-полоску «Активный хлор» наносим каплю анализируемой воды и сравниваем цвет тест-полоски со шкалой.
Концентрация активного хлора в пробе воды: 0 мг/л
ПДК: 0,3 мг/л
Вывод: показатель в норме
Вывод: Определение гидрохимических показателей проводилось стандартными методами химического анализа. Все показатели качества воды, за исключением общего железа, концентрация которого достигла ПДК.
находятся в норме и удовлетворяют требованиям СанПин «Гигиенические требования к охране поверхностных вод».
Оценка качества воды методами биоиндикации
Существует много различных методик, основанных на применении биоиндикации. Некоторые из них дают точные результаты, но работать по этим методикам могут лишь специалисты, хорошо разбирающиеся в водных организмах. Кроме сложных методик, есть совсем простые, однако результаты работы по ним бывают не всегда надежны.
Индекс Майера
Эта методика подходит для любых типов водоемов. Она более простая и имеет большое преимущество – в ней не надо определять беспозвоночных с точностью до вида. Метод основан на том, что различные группы водных беспозвоночных приурочены к водоемам с определенной степенью загрязненности. При этом организмы-индикаторы относят к одному из трех разделов, представленных в таблице 8.
| Обитатели чистых вод, X | Организмы средней чувствительности, Y | Обитатели загрязненных водоемов, Z |
| Личинки веснянок Личинки поденок Личинки ручейников Личинки вислокрылок Двустворчатые моллюски | Бокоплав Речной рак Личинки стрекоз Личинки комаров-долгоножек Моллюски-катушки, моллюски-живородки | Личинки комаров-звонцов Пиявки Водяной ослик Прудовики Личинки мошки Малощетинковые черви |
Нужно отметить, какие из приведенных в таблице групп обнаружены в пробах. Количество найденных групп из первого раздела необходимо умножить на 3, количество групп из второго раздела – на 2, а из третьего – на 1. Получившиеся цифры складывают:
X*3 + Y*2 + Z*1 = S
По значению суммы S (в баллах) оценивают степень загрязненности водоема:
более 22 баллов - водоем чистый и имеет 1 класс качества;
17-21 баллов - 2 класс качества;
11-16 баллов - умеренная загрязненность водоема, 3 класс качества;
менее 11 - водоем грязный, 4-7 класс качества.
Простота и универсальность метода Майера дают возможность быстро оценить состояние исследуемого водоема.
В исследуемом нами водоеме в мае 2021 года были обнаружены следующие организмы, подходящие под классификацию Майера: личинки стрекоз, личинки ручейника, пиявки и водяной ослик. На основе этих данных можно сделать вывод о довольно сильной степени загрязненности пруда-охлодителя (1 организм из разряда «чистые водоемы»,1 организм из категории «средняя чистота» и 2 организма из категории «обитатели загрязненных водоемов»). Последующие 2 пробы принесли аналогичные результаты.
Оценка состояния водного объекта по ряске
Род Ряска включает в себя около 9 видов рясок. Это водное, свободно плавающее, многолетнее травянистое растение. Ряска относится к плавающим пелагическим организмам, то есть тем, которые обитают в толще воды и на ее поверхности.
Ряску применяют для очистки воды, так как листецы извлекают из нее и запасают азот, фосфор, калий, поглощают углекислый газ и обогащают воду кислородом. На присутствие загрязняющих веществ ряска реагирует изменением цвета листеца (щитка) и поэтому может использоваться как индикаторный организм.
В наших водоемах чаще всего мы встречаемся с ряской малой. Ряска малая - это светлозеленое маленькое растение, листецы овальной формы, от нижней поверхности каждого листеца отходит в воду корешок с утолщением на конце. Ширина листеца ряски малой 2-3 мм, но она имеет относительно длинные корни - до 10 см. Именно этот вид ряски широко представлен в пруде-охлодители. Встречается в стоячих и медленно текучих водах. Этот вид и будет интересовать нас в работе по экспресс-оценке качества воды водоема.
Как выполнить экспресс-оценку качества воды
Было выбрано место отбора проб.
Выделили на поверхности воды участок площадью 0,5 м2 и собрали на этом участке все плавающие растения.
Подсчитали количество особей ряски малой, результат занесли в рабочую таблицу. Подсчитали общее количество щитков у всех особей ряски малой и занесли это значение в таблицу.
Вычислили отношение числа щитков к числу особей в соответствующем столбце рабочей таблицы.
Подсчитали количество поврежденных щитков у всех особей (черные и бурые пятна, пожелтение).
В следующем столбце таблицы вычислили процент щитков с повреждениями от общего количества щитков.
По "Таблице экспресс-оценки качества воды по ряске" определили класс качества воды (таблица 9).
| № пробы | Кол-во особей | Кол-во щитков | Отношение числа щитков к числу особей | Кол-во поврежденных щитков | Процент от общего количества щитков | Класс качества воды |
| 1 | 44 | 58 | 1,3 | 4 | 9 % | 2-3 |
| 2 | 39 | 65 | 1,7 | 4 | 10 % | 3 |
| 3 | 37 | 41 | 1,1 | 5 | 14 % | 3 |
Экспресс-оценка качества воды по ряске (таблица 10).
| % щитков с повреждениями | Отношение числа щитков к числу особей | ||||
| 1 | 1,3 | 1,7 | 2 | больше 2 | |
| 0 | 1-2 | 2 | 3 | 3 | 3 |
| 10 | 3 | 3 | 3 | 3 | 4 |
| 20 | 3 | 4 | 3 | 3 | 3 |
| 30 | 4 | 4 | 4 | 4 | 4 |
| 40 | 4 | 4 | 4 | 3 | - |
| 50 | 4 | 4 | 4 | 3 | - |
| Более 50 | 5 | 5 | - | - | - |
В этом методе класс качества воды описывается следующим образом:
1 – очень чистая;
2 – чистая;
3 – умеренно загрязненная;
4 – загрязненная;
5 – грязная;
"-" – невозможные варианты.
Вывод: согласно результатам методов биоиндикации вода пруда-охлодителя может быть причислена к умеренно-загрязненным.
Выводы и рекомендации по улучшению экологического состояния пруда-охлодителя
Итак, Нововоронежский пруд-охлодитель был причислен к разряду умеренно-загрязненных водоемов. Как основные источники загрязнения можно выделить:
А) бытовой мусор;
Б) нефтяные продукты – в отдельных местах (в частности там, где к пруду охлодителю вплотную приближается автодорога);
В) смываемые с дачных участков удобрения.
На основе полученных данных исследования были сформированы следующие направления эколого-оптимизационных мероприятий:
Очистка пруда-охлодителя от бытовых загрязнителей;
Проведение агитационных мероприятий, направленных на повышения уровня экологической образованности жителей города;
Вынесение результатов проделанной работы на общественность.
По каждому из направлений были проведены практические мероприятия.
1 июня 2021 года в рамках проведения молодежного городского форума «Экобудущее» была освещена проблема малых водоемов в глобальных масштабов. Члены школьного экологического кружка подготовили доклад об экологическом состоянии пруда-охлодителя. Также были привлечены школьники других школ и просто заинтересованные лица к участию в экологическом десанте «Чистый пруд». Он был проведен 10 июня 2021 года. В ходе мероприятий силами 68 участников были проведены: очистка прибрежной территории от бытового мусора, а также агитационная беседа с жителями города на тему «Чистый пруд – один из залогов благополучия жизни города» и установлены мусорные урны в местах, типичных для прогулки местных жителей.
10 сентября 2021 года в МБОУ СОШ № было проведено открытое мероприятие, посвященное подведению итогов трехмесячной работы с прудом-охлодителем, приглашенные гости (представители городской прессы, представитель городской Думы, а также других организаций) выслушали подробный доклад «Экологическое состояние пруда-охлодителя ». Было решено придать исследованиям школьниками экологического состояния объектов родного города регулярный характер, а также проводить субботники на пруде охлодители в летний период раз в месяц.
В данном случае, особенную ценность нашей работе по исследованию пруда-охлодителя придает непосредственное участие в ней подрастающего поколения, школьников. Известно, что в педагогическом процессе взаимодействуют три важнейших компонента: «знания-отношения-поведение». При этом наиболее актуальными для школьников 10-12 лет (а именно они и состоят в школьном экологическом отряде) являются эмоциональные переживания, связанные с прцессом общения с природой, а также разнообразная деятельность в ней. Ученый А.Н. Захлебный считает, что целью экологического образования и воспитания является формирование системы научных знаний, взглядов, обеспечивающих становление ответственного отношения школьников к окружающей среде. Ведущую роль в этом процессе играет школа, организующая прогресс формирования экологической культуры, включающий в себя две стороны: учебную и внеучебную работу. В нашей школе экологический отряд существует около 10 лет. Его участники сейчас – в основном ребята 10-12 лет, но приходят к нам и младшеклассники, и старшеклассники. Закладываемые в детстве ценности ребенок пронесет по всей жизни, научит тому же и своих детей. Несмотря на видимую малозначительность деятельности различного рода экологических кружков и отрядов, они являются базой, на основе которой может вырасти гармоничная, экологически образовання личность.
Результаты выполнения мероприятий видны уже сейчас. Пока, даже без проведения анализов качества воды, визуально было установлено уменьшение бытового мусора.
Литература
Реки Воронежской области : (Вод. режим и охрана) / А. Г. Курдов. Воронеж : Изд-во Воронеж. ун-та, 1984. – 162 с.
Экологическое образование и воспитание. Методические рекомендации. Улан – Удэ, 1990.
Справочник по гидрохимии. Интернет – издание. Эколайн, 1998.
Романенко В.Д. «Основы гидроэкологии». Интернет – издание.
Воронежская земля. Сборник под редакцией Мальтеева. Воронеж, 2005.
«Карты-инструкции по выполнению определений показателей качества воды» к полевой комплектной лаборатории контроля воды «НКВ», научно-производственное объединение ЗАО «Крисмас+». Санкт-Петербург, 2015.
Комплексоны и комплексонаты металлов / Н.М.Дятлова, В.Я.Темкина, К.И.Попов. М.: Химия, 1988. – 544с.
Органические реагенты для определения Ba2+ и SO42-. / Саввин С.Б., Акимова Т.Г., Дедкова В.П.; Изд-во «Наука», 1971. – 192с.
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. – М.: Химия, 1984. – 448 с.
Приложение 1.
Химические свойства воды
| Показатели | Содержание в исследуемой воде | ПДК |
| pH воды | 8 | 6-9 |
| Общая жесткость | 3,5 мг-экв/л (°Ж) | 7 мг-экв/л (°Ж) |
| Общее железо | 0,3 мг/л | 0,3 мг/л |
| нитраты | 5 мг/л | 45 мг/л |
| нитриты | 0,1 мг/л | 3 мг/л |
| сульфиты | 345,8 мг/л | 500 мг/л |
| хлориды | 88,75 мг/л | 350 мг/л |
| фториды | 0,2 мг/л | 1,5 мг/л |
| Активный фтор | 0 мг/л | 0,3 мг/л |
