терморегуляции. Профилактика простудных заболеваний у детей
 Скачать 373.32 Kb. Скачать 373.32 Kb.
|
87. Санитарно-бактериологическое исследование молока и молочных продуктов Ф. К. Черкес, Н. А. БельскаяМолоко и молочные продукты являются благоприятной средой для размножения микроорганизмов. При изготовлении некоторых молочных продуктов: творога, кефира, простокваши, ряженки и других используют специальную микрофлору, например молочнокислые стрептококки, молочно-кислые ацидофильные палочки и др. Микрофлора, используемая для приготовления этих продуктов, является для них специфичной и не учитывается. Неспецифической микрофлорой, встречающейся в молоке и молочных продуктах, являются аэробные бактерии: БГКП, стафилококки и др. С молоком могут передаваться возбудители туберкулеза, бруцеллеза, сальмонеллеза, сибирской язвы, вирус полиомиелита, анаэробные бациллы и т. д. Обсеменение молока и молочных изделий неспецифической микрофлорой может произойти в момент удоя, транспортировки, хранения и т. д. Исследование молока и молочных продуктов проводят согласно ГОСТу 9225-68. Отбор проб. Пробы жидких и полужидких продуктов после тщательного их перемешивания отбирают в количестве 50-100 мл в стерильные колбы. Пробы сливочного масла, сыра, творога отбирают с помощью стерильного щупа из глубины продукта. Перед взятием пробы масла, творога верхний слой продукта тщательно зачищают, а поверхность сыра в месте отбора пробы прижигают раскаленным ножом. Из расфасованных продуктов берут по 2 образца в оригинальной упаковке. Взятые образцы сопровождают документом, в котором указывают: 1. Номер образца. 2. Наименование и сорт продукта. 3. Дату изготовления. 4. Дату и час отбора пробы. 5. Объем необходимых исследований. 6. Должность и подпись лица, отобравшего пробу. Микробиологическое исследование продукта должно производиться не позднее чем через 4 ч с момента отбора пробы. При транспортировке температура не должна превышать 6° С. ГОСТ для молока и молочных изделий предусматривает определение общего числа бактерий в 1 г (мл) и определение титра цитратотрицательных (цитратнегативных) разновидностей БГКП (коли-титр). Определение общего числа бактерийПодготовка образцов для исследования. Из молока и других молочных продуктов готовят десятикратные разведения (по общепринятой методике). Количество разведений для каждого вида продукта готовят с учетом наиболее вероятного микробного обсеменения (табл. 56).  Таблица 56. Разведение молока и молочных продуктов Примечание. Для определения общего количества бактерий следует выбирать те разведения, при посевах которых на чашках вырастает не менее 50 и не более 300 колоний. Посев. По 1 мл каждого разведения вносят в 2-3 стерильные чашки Петри и заливают 12-15 мл растопленного и остуженного до 45° С питательного агара. Предварительно чашки маркируют. Сразу после заливки содержимое чашки перемешивают (путем легкого вращательного покачивания) для равномерного распределения посеянного материала. Посевы ставят в термостат при 37° С на 48 ч. По истечении срока инкубации чашки вынимают и подсчитывают число колоний при помощи счетчика. Число колоний, выросших на каждой чашке, умножают на соответствующее разведение. Полученные результаты по отдельным чашкам складывают, делят на количество чашек и получают среднее арифметическое, которое является показателем общего числа бактерий в 1 г (мл). Соответствующие ГОСТы регламентируют качество продуктов, что устанавливают по допустимым показателям: общему числу микробов и коли-титру. Пример для двух видов продуктов представлен в табл. 57.  Таблица 57. Показатели общего числа бактерий и коли-титра в молоке Примечание. Для других молочных продуктов также имеется ГОСТ обусловливающий допустимое количество микробов в 1 мл (г) продукта. Буквы А и Б обозначают категорию продукта. В кисломолочных продуктах (кефир, простокваша, творог, сметана и др.), содержащих обильную специфическую микрофлору, общее количество бактерий не определяют, а контролируют состав микрофлоры. Для этого из кисломолочных продуктов готовят препараты и красят метиленовым синим. В поле зрения препарата должны находиться только специфические для данного продукта микроорганизмы. Например, для простокваши - молочно-кислые стрептококки и палочки; для кефира - молочно-кислые стрептококки и палочки, единичные дрожжи. Микроскопия позволяет выявить микроорганизмы порчи (плесени и большое количество дрожжей). Определение БГКПОбсемененность молока и молочных продуктов бактериями группы кишечной палочки определяют бродильным методом. Бродильный титр - это то наименьшее количество продуктов, выраженное в граммах или миллилитрах, в котором присутствует кишечная палочка. Согласно ГОСТу 9225-68 учитываются только цитратнегативные разновидности кишечной палочки (рис. 57).  Рис. 57. Определение коли-титра молока Бродильный метод Первый день исследования Посев молока и молочно-кислых продуктов производят в 6 пробирок с 5 мл среды Кесслер. В 3 пробирки засевают по 1 мл цельного продукта, в другие 3 пробирки по 1 мл из разведения 1:10 (0,1 мл). Посевы инкубируют в термостате при 43° С 18-24 ч. Второй день исследования Из каждой забродившей пробирки производят посев на сектор среды Эндо и инкубируют при 37° С 18-24 ч. Третий день исследования При отсутствии типичных для БГКП колоний продукт считают незагрязненным кишечной палочкой. При наличии типичных для БГКП колоний делают мазки, окрашивают по Граму и микроскопируют. При обнаружении грамотрицательных палочек ставят пробу на оксидазу и производят посев на среду с глюкозой и среду Козера. Четвертый день исследования Производят учет результатов. Наличие кислоты и газа на среде с глюкозой и отсутствие роста на среде Козера свидетельствует о наличии цитратнегативных разновидностей кишечной палочки. Коли-титр вычисляют по табл. 58. 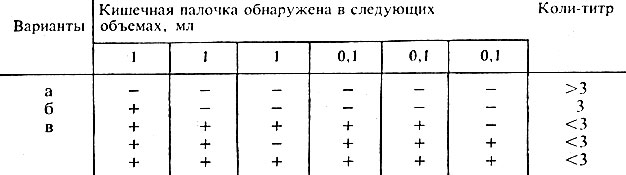 Таблица 58. Вычисление коли-титра в пастеризованном молоке, сливках, кефире, простокваше, ацидофильном молоке Примечание. Вычисление коли-титра для масла, сыра, творожных изделий, мороженого и молочных консервов проводят по другим таблицам, указанным в ГОСТе. Присутствие патогенных микроорганизмов в молоке и молочных продуктах недопустимо. 88. Среди объектов внешней среды, соприкосновение с которыми может оказывать влияние на здоровье человека, важное место принадлежит предметам обихода. Эти объекты служат пассивными посредниками при передаче болезнетворной микрофлоры, но они не обеспечивают ее размножения. Разнообразная микрофлора попадает на предметы обихода из воздуха вместе с капельками влаги и с пылью. Человек тоже может загрязнять различные предметы своими выделениями. В зависимости от внешних условий количество микробов, обсеменяющих поверхности, может колебаться в широких пределах. Наиболее часто через предметы обихода передаются возбудители воздушно-капельных и кишечных инфекций. При этом большую роль играют такие факторы, как концентрация возбудителей и выживаемости их на разных объектах. Исследование микрофлоры поверхностей является составной частью контроля противоэпидемического режима лечебно-профилактических, детских учреждений, предприятий общественного питания, пищевой, фармацевтической, микробиологической промышленности. В настоящее время для исследования чаще используются 2 основных метода – метод смывов и метод отпечатков. Реже применяются методы агаровой заливки и мембранных фильтров. Метод смывов широко используется в практической работе как наиболее простой и доступный. Смывы берут с исследуемой поверхности с помощью ватного тампона на деревянной палочке. Перед этим тампон смачивают стерильным физраствором или жидкой питательной средой, тщательно протирают им исследуемую поверхность на площади 10 х 10 см (100 см2). Для взятия смывов целесообразно использовать специальные жестяные или проволочные трафареты. При исследовании мелких предметов смыв берут с поверхности всего предмета, обращая особое внимание на труднодоступные для дезинфекции места. После этого тампоны погружают на 1/3 в пробирку с жидкой питательной средой, обламывают выступающую часть лучинки, закрывают пробирку пробкой. При исследовании на колиформные бактерии с целью выявления фекального загрязнения тампон погружают в среду Кесслера с лактозой; при исследовании на стафилококки – в 6,5% солевой бульон; при выявлении энтеробактерий и псевдомонад – в 1% пептонную воду с последующим высевом на среду Эндо. В случаях, когда возникает необходимость в определении количества микроорганизмов на единице площади поверхности, смыв берут с помощью стерильной марлевой салфетки размером 5х5 см, смоченной стерильным физиологическим раствором. Затем салфетку встряхивают в пробирке с определенным количеством физраствора в течение 10 минут для десорбции микробов с салфетки. Количество микроорганизмов в смывной жидкости определяют методом глубинного посева с последующим пересчетом колоний. Процедура взятия смывов при обследовании лечебно-профилактических учреждений регламентирована «Инструкцией по бактериологическому контролю комплекса санитарно-гигиенических мероприятий в лечебно-профилактических учреждениях (отделениях) хирургического профиля, в палатах и отделах реанимации и интенсивной терапии» (приложение №2 к приказу №720 МЗ СССР). Обследование предприятий общественного питания проводиться согласно «Методическим указаниям по санитарно-бактериологическому контролю на предприятиях общественного питания и торговли пищевыми продуктами» № 2657-82. Оценка результатов санитарно-микробиологических исследований предметов обихода зависит от целей проведенных анализов. Обнаружение патогенных микробов указывает на непосредственную опасность заражения. Обильное фекальное загрязнение инвентаря предприятий общественного питания или детских учреждений, нарастание числа находок патогенных стафилококков на предметах обихода в родильных домах или хирургических отделениях – все это свидетельствует о явном санитарном неблагополучии и необходимости проведения профилактических мероприятий. Выявление роста санитарно-показательных или патогенных микробов в смывах с поверхностей предметов, подвергавшихся дезинфекции, указывает на неполноценность последней. Развитие любой микрофлоры в посевах перевязочного материала говорит о том, что его стерилизация не достигла цели. Метод отпечатков основа на непосредственном контакте плотной питательной среды с поверхностью исследуемого объекта. Бакпечатка – пластмассовый сосуд одноразового употребления, имеющий специальное углубление для заливки питательной среды. В процессе изготовления изделие подвергается стерилизации гамма-лучами. Бакпечатка заполняется избранной питательной средой заранее. Перед использованием ее открывают и прикасаются поверхностью среды к исследуемому объекту. После инкубации в термостате проводится подсчет выросших колоний и определение групп санитарно-показательных микроорганизмов. Метод мембранных фильтров. Простерилизованный мембранный фильтр погружают в растопленный и охлажденный до 60-65оС питательный агар (или среду Эндо) и быстро переносят на исследуемую поверхность. Через 2-3 минуты фильтр помещают на поверхность плотной питательной среды в чашке Петри отпечатком вверх. После инкубации в термостате подсчитывают число выросших колоний. Данный метод позволяет исследовать вертикальные поверхности и поверхности сложной формы. 89. МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ СТЕРИЛЬНОСТИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ 19. Правила отбора проб для контроля стерильности. Отбор проб на стерильность проводит уполномоченный представитель органа государственного санитарного надзора или обученный медицинский персонал организаций здравоохранения в стерильные емкости с соблюдением правил асептики непосредственно перед проведением манипуляций и операций. Для контроля стерильности используют следующие питательные среды: сахарный бульон Хоттингера (0,5 и 1% глюкозы); тиогликолевую среду; бульон Сабуро. Обязателен посев изделий на 3 вышеуказанные среды. При посеве изделия или его части непосредственно в питательную среду количество среды в пробирке (колбе, флаконе и т. д.) должно быть достаточным для полного погружения изделия или его части. Посевы в бульон Хоттингера и тиогликолевую среду выдерживают в термостате при температуре 30-350С, среду Сабуро - при температуре 20-250С. Посевы инкубируют в термостате в течение 14 суток. В организациях здравоохранения, имеющих централизованные стерилизационные отделения, контролю на стерильность подлежит не менее 1% от числа одновременно стерилизованных изделий одного вида. Количество отбираемых проб для контроля стерильности изделий медицинского назначения, стерилизованных радиационным и газовым методом в промышленных условиях определяется по формуле: 0, 4√n, где n -количество изделий в одной партии, при минимальном количестве проб – 3 и максимальном – 40. При неудовлетворительном результате исследования, отбирается удвоенное количество образцов для вторичного посева. 20. Требования, обеспечивающие асептические условия при посевах на стерильность: 20.1. требования к помещению: посев исследуемого материала рекомендуется проводить в боксах с ламинарным потоком воздуха. Эти боксы размещают в отдельных помещениях бактериологической лаборатории. При отсутствии боксов с ламинарным потоком воздуха контроль стерильности проводят в боксированных помещениях (бокс с предбоксником). Требования предъявляемые к устройству боксированных помещений изложены в Санитарных правилах 17-129 РБ 2000 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами», утвержденных постановлением Главного государственного санитарного врача Республики Беларусь от 01.01.01 года, № 40; 20.2. подготовка помещений бокса, инструментов и персонала к работе: ежедневно до проведения работы помещения бокса и предбоксника подвергают тщательной обработке. Стены, пол, поверхности рабочих мест, инвентаря протирают дезинфицирующим средством, зарегистрированным в Республике Беларусь. Внутреннюю поверхность бокса с ламинарным потоком воздуха обрабатывают так же, как и помещение бокса. Через 45-60 минут после обработки, в бокс вносят все необходимые для работы материалы и инструменты, кроме исследуемых образцов; перед внесением материалов в ламинарном боксе включают вентиляцию на время, достаточное для обеспечения полного обмена воздуха в нем; за 1,5-2,0 часа до начала работы в боксе и предбокснике на 1,0-1,5 часа включают бактерицидные лампы. Работа в боксе осуществляется не ранее, чем через 15 минут после отключения бактерицидной лампы; инструменты, посуда и спецодежда, используемые в работе, должны быть стерильными; перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом, обрабатывают кожным антисептиками по режиму хирургической антисептики, одевают в предбокснике на ноги бахилы, стерильные халаты, маски, шапочки, стерильные перчатки. Используемые антисептики должны быть из числа зарегистрированных в Республике Беларусь. в процессе посева в боксе регулярно проверяют обсемененность воздуха. Для этого на рабочий стол ставят 2 чашки с МПА, открывая их на 15 минут, затем чашки помещают в термостат при температуре (37+1)0С на 48 часов. Допускается рост не более трех колоний неспорообразующих сапрофитов; в случае роста на чашках более 3 колоний проведение дальнейших работ в данном боксе запрещается, в нем дополнительно проводят тщательную обработку дезинфицирующим средством; 20.3. контроль стерильности изделий медицинского назначения проводят путем их погружения в питательные среды. В исключительных случаях, когда необходимо проверить стерильность инструмента больших размеров, пробы готовят методом смыва, стерильной марлевой салфеткой размером 5х5 см2, предварительно увлаженной стерильным физиологическим раствором или стерильной дистиллированной водой. Перед посевом исследуемые образцы вносят в предбоксник, предварительно снимая наружную мягкую упаковку. В предбокснике пакеты, биксы протирают снаружи с помощью стерильного пинцета (корнцанга) стерильной салфеткой (ватным тампоном), смоченной дезинфицирующим средством, перекладывают на стерильный лоток и оставляют на 30 минут. При поступлении изделий в мягкой упаковке, первый слой упаковки снимают в предбокснике, изделия во внутренней упаковке сразу переносят в бокс. Посевы на стерильность проводит бактериолог с помощью лаборанта. 21. Посевы на стерильность: 21.1. хирургический инструментарий с помощью стерильного пинцета извлекают из бикса или мягкой упаковки и целиком погружают в пробирки с питательными средами. В случаях, если стерилизованные инструменты находящиеся в одной упаковке крупных размеров (иглодержатели, ранорасширители и т. д.), производят смыв с поверхности инструмента стерильной салфеткой, смоченной в стерильном физиологическом растворе или стерильной водопроводной воде и погружают салфетку в пробирку с тиогликолевой средой. Аналогичные смывы с других инструментов засевают в пробирки со средой Хоттингера и Сабуро; 21.2. методика посева на стерильность игл и шприцев - для контроля на стерильность отбирают шприцы малой емкости (1,0 или 2,0 мл) в условиях бактериологического бокса, с соблюдением правил асептики погружают в пробирки с питательными средами (отдельно цилиндр, поршень, иглы); при необходимости контроля стерильности шприцев большой емкости (10, 20 мл и более) исследование производят методом смыва, при этом стерильной салфеткой, смоченной в стерильных физиологическом растворе или водопроводной воде, протирают с помощью пинцета внутренние части шприца и погружают салфетку в питательную среду; 21.3. исследование на стерильность систем переливания крови - от силиконовой трубки, ближе к игле, отрезают ножницами с помощью пинцета небольшие кусочки (1-2 см) и погружают в пробирки с питательными средами, иглу отдельно погружают в питательные среды; 21.4. посев на стерильность катетеров, резиновых перчаток и др. изделий из резины и пластикатов - контроль стерильности зондов, катетеров, резиновых перчаток и других изделий из резины производят путем полного погружения мелких изделий в питательные среды, от более крупных, с помощью стерильного пинцета, стерильными ножницами отрезают небольшие кусочки (1-2 см) и погружают в питательные среды; 21.5. посев на стерильность хирургического шовного материала - перед посевом, емкость с отобранными образцами шовного материала, в предбокснике протирают стерильной марлевой салфеткой, смоченной дезинфицирующим средством, зарегистрированным в Республике Беларусь, затем ее вносят в бокс; 21.6. кетгут перед посевом подвергают специальной обработке для нейтрализации и отмывания нейтрализующего раствора. Моток кетгута, приготовленный для исследования, перекладывают стерильным корнцангом или пинцетом в стерильный 10% раствор гипосульфита натрия. Раствор гипосульфита натрия готовят на дистиллированной воде, разливают в пробирки (колбы) по 20-30 мл, стерилизуют при 1200С 30 минут. Кетгут выдерживают в растворе гипосульфита в течение 24 часов при комнатной температуре (возможно помутнение раствора за счет выпадения серы), затем перекладывают в пробирки с 20-30 мл стерильной дистиллированной воды, где также выдерживают в течение 24 часов при комнатной температуре. Непосредственно перед посевом моток кетгута извлекают стерильным пинцетом и перекладывают в стерильную чашку Петри, с помощью пинцета и ножниц его разрезают на мелкие кусочки длиной 1-2 см и разъединяют для прорастания микроорганизмов внутри кетгута; посев производят в 2 пробирки с тиогликолевой средой, 2 пробирки со средой Сабуро и 2 пробирки со средой Хоттингера, помещая в каждую пробирку по 4-5 отрезков исследуемого материала; 21.7. шелк (лавсан) перед посевом помещают на 24 часа в стерильную дистиллированную воду при комнатной температуре. Перед посевом моток шелка (лавсана) перекладывают в стерильные чашки Петри, разрезают на отрезки, длиной 1-2 см. Посев шелка производят так же, как и кетгута; 21.8. исследование на стерильность аппаратов экстракорпорального кровообращения проводят после асептической сборки аппарата; контролю подлежат: смыв из аппарата, перфузат до перфузии, кровь после перфузии; стерильный физиологический раствор в количестве не менее 250 мл прогоняют через аппарат, подготовленный к операции, отбирают 100 мл раствора и засевают на питательные среды. Аналогично производят посев перфузата до перфузии и крови после перфузии; 21.9. посев на стерильность перевязочного материала. Бинты, ватные шарики, марлевые салфетки, турунды и т. п. отбирают из разных мест бикса стерильным пинцетом. Мелкие изделия целиком погружают в пробирки с питательными средами. От бинтов (внутренних частей) и крупных марлевых салфеток, с помощью стерильных ножниц, отрезают кусочки и погружают в пробирки с питательными средами. На каждый вид перевязочного материала используют по 2 пробирки каждой среды; 21.10. посев на стерильность хирургического белья - стерилизованными и фламбированными ножницами, с помощью пинцета, от хирургического белья отрезают небольшие кусочки ткани (завязка, внутренние швы и т. п.) и погружают в пробирки (колбы) с питательными средами, не касаясь краев пробирки (колбы); 21.11. учет результатов: материал стерилен при отсутствии роста во всех посевах, материал не стерилен при выявлении роста микрофлоры; 21.12. посевы на стерильность других изделий медицинского назначения выполняются в зависимости от размера и назначения изделия по методикам, аналогичным описанным выше. |
