Химия ПНИПУ для заочников. Программа и контрольные задания для студентов заочного обучения
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
223. При какой концентрации ионов Zn2+ (моль/л), потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Ответ: 0,30 моль/л. 224. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSО4? Почему?; Составьте электронные и молекулярные уравнений соответствующих реакций.
Ответ: 0,20 моль/л.
Ответ: СNi²⁺ : CCo²⁺ 0,117.
Ответ: 1,8910–12 моль/л.
Ответ: 0,058 В.
Ответ: 0,029 В.
Ответ: 2,244 В.
Ответ: 1,967 В.
Ответ: 7,310-15 моль/л.
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb Напишите электронные уравнения анодного и катодного процессов. Вычислите э. д. с. этого элемента, если СNi2+= 0,01 моль/л, СPb2+ = 0,0001 моль/л. Ответ: 0.066 В.
239. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий- никелевого аккумулятора? 240. Какие химические процессы протекают на электродах при зарядке и разрядке железо- никелевого аккумулятора? ЭЛЕКТРОЛИЗ Электролизом называют совокупность химических процессов, которые протекают под действием электрического тока на электродах, погруженных в раствор или расплав электролита. Например, если в расплав хлорида натрия погрузить инертные электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ - к катоду; анионы Cl– - к аноду. Н 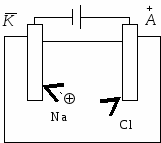 а катоде протекает процесс восстановления: а катоде протекает процесс восстановления: Na+ + ē = Na, на аноде процесс окисления: 2Cl– – 2ē = Cl2. Суммарная реакция: 2 2NaCl 2Na + Cl2 При электролизе водных растворов в процессах могут участвовать молекулы воды. Тогда на катоде может происходить восстановление ионов металла и водорода. Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода [H+] и парциального давления водорода PH₂. Обычно парциальное давление водорода РH₂ поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу (lg1 = 0). Тогда Поскольку стандартный потенциал процесса восстановления ионов водорода принимает равный нулю, а lg[H+] = –pH, то получим В нейтральных растворах pH=7 потенциал имеет значение Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем –0,41В, то из нейтрального раствора такого электролита на катоде будет выделятся металл. Такие металлы находятся в ряду напряжений вблизи водорода, начиная приблизительно с олова. Если катионом электролита является металл имеющий потенциал значительно более отрицательный, чем –0,41В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений, расположенные до титана. Наконец, если потенциал металла близок величине –0,41В (металлы средней части ряда напряжений – Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. Электрохимическое выделение водорода из кислых растворов pH которых < 7, происходит вследствие разряда ионов водорода. 2H+ + 2ē = H2. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2H2O + 2ē = H2 + 2OH–. При рассмотрении анодного процесса следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза (чаще всего графит, уголь, платина, свинец). На инертном аноде при электролизе происходит окисление воды с выделением кислорода. В щелочной среде уравнение имеет вид: 4OH– – 4ē = O2 + 2H2O, а в кислой и нейтральной: 2H2O – 4ē = O2 + 4H+ Кислородосодержащие анионы (SO24–, NO–2, SO32–) или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO24– до S2O82– равен 2,01В, что значительно превышает потенциал окисления воды (1,23 В). При электролизе водных растворов безкислородных кислот и их солей у анода разряжаются анионы. В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды, разряд анионов и электрохимическое окисление металла анода (анодное растворение металла). Будет идти тот процесс, потенциал которого меньше. Например, при электролизе NiSO4 с никелевым анодом происходит процесс окисления металла: Ni – 2ē → Ni2+ Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А? Решение. Согласно законам Фарадея т = Эit/96500, (1) где mмасса вещества, окисленного или восстановленного на электроде; Э – грамм-эквивалент вещества; iсила тока; t продолжительность электролиза, с. Граммэквивалент меди в CuSO4 равен 63,54/2 = 31,77 г. Подставив в формулу (1) значения Э = 31,77, i = 4A, t = 6060 = 3600 ч, получим m = (31.7743600)/96500 = 4,74 г. Пример 2. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла. Решение. Из формулы (1) Э = 11,74296500/3880 = 29,35, где m=11,742 г; it = Q=3880 Кл. Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях? Решение. Из формулы (1) i = m96500/Эt Так как количество водорода дано в объемных единицах, то отношение т/Э заменяем отношением VH2/Vг-экв Н2, где VH2 объем водорода в литрах; Vг-экв Н2 объем грамм-эквивалента водорода в литрах. Тогда i= VH296500/ Vг-экв Н2t. Объем грамм-эквивалента водорода при н.у. равен половине грамм-молекулярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VH2 =1,4, Vг-экв Н2 = 11,2, t = 6025 (1 ч 40 мин 26 с = 6025 с), находим i = 1,4 96500/11,2 6025 = 2 А. Пример 4. Сколько граммов едкого кали образовалось у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода, измеренного при нормальных условиях? Решение. Объем грамм-эквивалента кислорода (н. у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л составляют 2 г-экв кислорода. Столько же, т, е. 2 г-экв КОН образовалось у катода, или 56,11 2 = 112,22 г (56,11 г гэкв КОН). 241. Электролиз раствора K2SО4 проводили при силе тока 5 А в течение З ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ. 242. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов AlCl3, NiSO4. В обоих случаях анод угольный. 243. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода, измеренного при н. у. Сколько граммов меди выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах. 244. Сколько граммов воды разложилось при электролизе раствора Na2SO4 при силе тока 7 А в течение 5 ч? Составьте электронные уравнения процессов, происходящих на электродах. 245. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Сколько граммов серебра выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах. 246. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалент металла. Составьте электронные уравнения процессов, происходящих на электродах. 247. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН, расплава КОН. 248. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н. у. Вычислите силу тока. Составьте электронные уравнения процессов, происходящих на электродах. 249. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора А12(SO4)3 в случае угольного анода; в случае алюминиевого анода. 250. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течение 2,5 ч, если сила тока равна 6 А? Составьте электронные уравнения процессов, происходящих на электродах. 251. При электролизе раствора AgNO3 масса серебряного анода уменьшилась на 5,4 г. Сколько кулонов электричества израсходовано на этот процесс? Составьте электронные уравнения процессов, происходящих на электродах. 252. Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора КВr в течение 1 ч 35 мин при силе тока 16 А? Составьте электронные уравнения процессов, происходящих на электродах. 253. Составьте электронные уравнения процессов, происходящих при электролизе CuCl2 , если анод медный; если анод угольный? 254. На электролиз раствора CaCl2 израсходовано 10722,2 Кл электричества. Вычислите массу выделяющихся на угольных электродах и образующегося возле катода веществ. Составьте электронные уравнения процессов, происходящих на электродах. 255. Составите электронные уравнения процессов, происходящих на электродах при электролизе раствора КС1; расплава КС1. 256. Сколько времени проводят электролиз раствора электролита при силе тока 5 А, если на катоде выделяется 0,1 г-экв вещества? Сколько выделится вещества на аноде? 257. При электролизе растворов MgSO4 и ZnCl4 , соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделится на другом катоде; на анодах? Составьте электронные уравнения процессов, происходящих на электродах. 258. Чему равна сила тока, если при электролизе раствора MgCl2 в течении 30 мин на катоде выделилось 8,4 л водорода, измеренного при н. у. Вычислите, массу вещества, выделяющегося на аноде. Составьте электронные уравнения процессов, происходящих на электродах. 259. Сколько граммов Н2SO4 образуется возле анода при электролизе раствора Na2SO4, если на аноде выделяется 1,12 л кислорода, измеренного при н. у.? Вычислите массу вещества, выделяющегося на катоде. Составьте электронные уравнения процессов, происходящих на электродах. 260.Вычислите силу тока, зная, что при электролизе раствора КОН в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г кислорода. Какое вещество и в каком количестве выделяется на катоде? Составьте электронные уравнения процессов, происходящих на электродах. КОРРОЗИЯ МЕТАЛЛОВ* Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. При электрохимической коррозии на поверхности металла одновременно протекает два процесса: анодный – окисление металла Ме0 – nē = Men+ и катодный – восстановление ионов водорода 2H+ + 2ē = H2 или молекул кислорода, растворенного в воде O2 + 2H2O +4ē = 4OH– Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. |
