Химия ПНИПУ для заочников. Программа и контрольные задания для студентов заочного обучения
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывай максимальное восстановление последней. Решение. Цинк как любой металл проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р- элемента VI А группы равна –2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:  4 Zn0 – 2 ē = Zn2+ 4 Zn0 – 2 ē = Zn2+1 S6+ + 8 ē = S2– Составляем уравнение реакции: 4Zn + 5Н2SO4 = 4ZnSO4 + Н2S + 4Н2O Перед Н2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы Н2SO4 идут на связывание четырех ионов Zn2+. 201. Исходя из степени окисления хлора в соединениях НСI, НСIO3 НСIO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме КВr + КBrО3 + Н2SО4 Вr2 + К2 SO4 + H2O. 202. Реакции выражаются схемами: Р + НIO3 + Н2O Н3РО4 + НI Н2S + СI2+Н2O Н2SO4 + НСI Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем; какое вещество окисляется, какое – восстанавливается. 203. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: Аs3– As5+; N3+ N3–; S2– S0. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Na2SO3 + КMnО4 + Н2O Nа2SO4 + МnО2 + КОН 204. Исходя из степени окисления фосфора в соединениях РН3, Н3РO4, Н3РО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме РbS + НNО3 S + + Рb(NО3)2 + NO2 + Н2O. 205*. КMnО4 + Nа2SO3 + КОН К2МnО4 + Nа2SO4, + Н2О P + НNО3 +Н2O Н3PО4 + NO 206. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: Мn6+ Mn2+; CI5+ CI– ; N3– N5+. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Сu2O+НNO3Сu(NО3)2 +NO+Н2О 207*. НNO3 + Са NН4NО3 + Са(NO3)2 + Н2О К2S + КMnO4 + Н2SO4 S + К2SO4 + МnSO4 + Н2O 208. Исходя из степени окисления хрома, йода и серы в соединениях К2Сr2О7, КI и Н2SО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: NaCгО2 + РbО2 + NаОН Na2CrО4 + Nа2PbО2 + Н2О 209*. Н2S + СI2 + Н2O Н2SO4 + НСI К2Cr2О7 + Н2S + Н2SО4 S + Сг2 (SO4)3 + K2SO4 + H2O 210*. KClO3 + Na2SO3 KCl + Na2SO4 KMnO4 + HBr Br2 + KBr + MnBr2 + H2O 211*. P + HClO3 + H2O H3PO4 + HCl H3AsO3 + KMnO4 + H2SO4 H3AsO4 + MnSO4 + K2SO4 + H2O 212*. NaCrO2 + Br2 + NaOH 2Na2CrO4 + NaBr + H2O FeS + HNO3 Fe(NO3)2 + S + NO + H2O 213*. HNO3 + Zn N2O + Zn(NO3)2 + H2O FeSO4 + KClO3 + H2SO4 Fe2(SO4)3 + KCl + H2O 214*. K2Cr2O7 + HCl Cl2 + CrCl3 + KCl + H2O Au + HNO3 + HCl AuCl3 + NO + H2O 215. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) НСl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме KMnO4 + KNO2 + H2SO4 MnSO4 + KNO3 + K2SO4 + H2O 216*. HCl + CrO3 Cl2 + CrCl3 + H2O Cd + KMnO4 + H2SO4 CdSO4 + K2SO4 + MnSO4 + H2O 217*. I2 + NaOH NaOI + NaI MnSO4 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + PbSO4 + H2O 218*. H2SO3 + HClO3 H2SO4 + HCl FeSO4 + K2Cr2O7 + H2SO4 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O 219*. I2 + Cl2 + H2O HIO3 + HCl FeCO3 + KMnO4 + H2SO4 Fe2(SO4)3 + CO2 + MnSO4 + К2SO4 + H2O 220. Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВr; б) K2Cr2O7 и H3PO3; в) HNO3 и H2S? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме AsH3 + HNO3 H3AsO4 + NO2 + H2O ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ* Если металлическую пластинку опустить в воду, то расположенные на ее поверхности катионы металла будут гидратироваться полярными молекулами воды и переходить в жидкость. При этом электроны, в избытке остающиеся в металле, заражают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие: Me + mH2O=Me(H2O)n+m+ ne– в растворе на металле где n число электронов, принимающих участие в процессе. На границе металл жидкость возникает двойной, электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях, называемых стандартными электродными потенциалами (Е°). Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1 моль, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; G0 = 0). Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем так называемый “ряд напряжений”. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы. И наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, протекает в направлении, в котором э. д. с. элемента имеет положительное значение. В этом случае G0 < 0, так как G0 = nFE0. Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта (табл. 4). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а кобальта – 0,1 моль/л? Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста: где Е'° стандартный электродный потенциал; п число электронов, принимающих участие в процессе; С концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л. Е° для никеля и кобальта соответственно равны 0,25 и 0,277 В, Определим электродные потенциалы этих металлов при данных в условии концентрациях: Е(Ni2+/Ni)= 0,25 + (0,058/2)lg10–3 = 0,337 B, Е(Co2+/Co)= 0,277 + (0,058/2)lg10–1 = 0,306 B. Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля. Таблица 4 Стандартные электродные потенциалы Е0 некоторых металлов (ряд напряжений)
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен 2,41 В. Вычислите концентрацию ионов магния в моль/л. Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1); 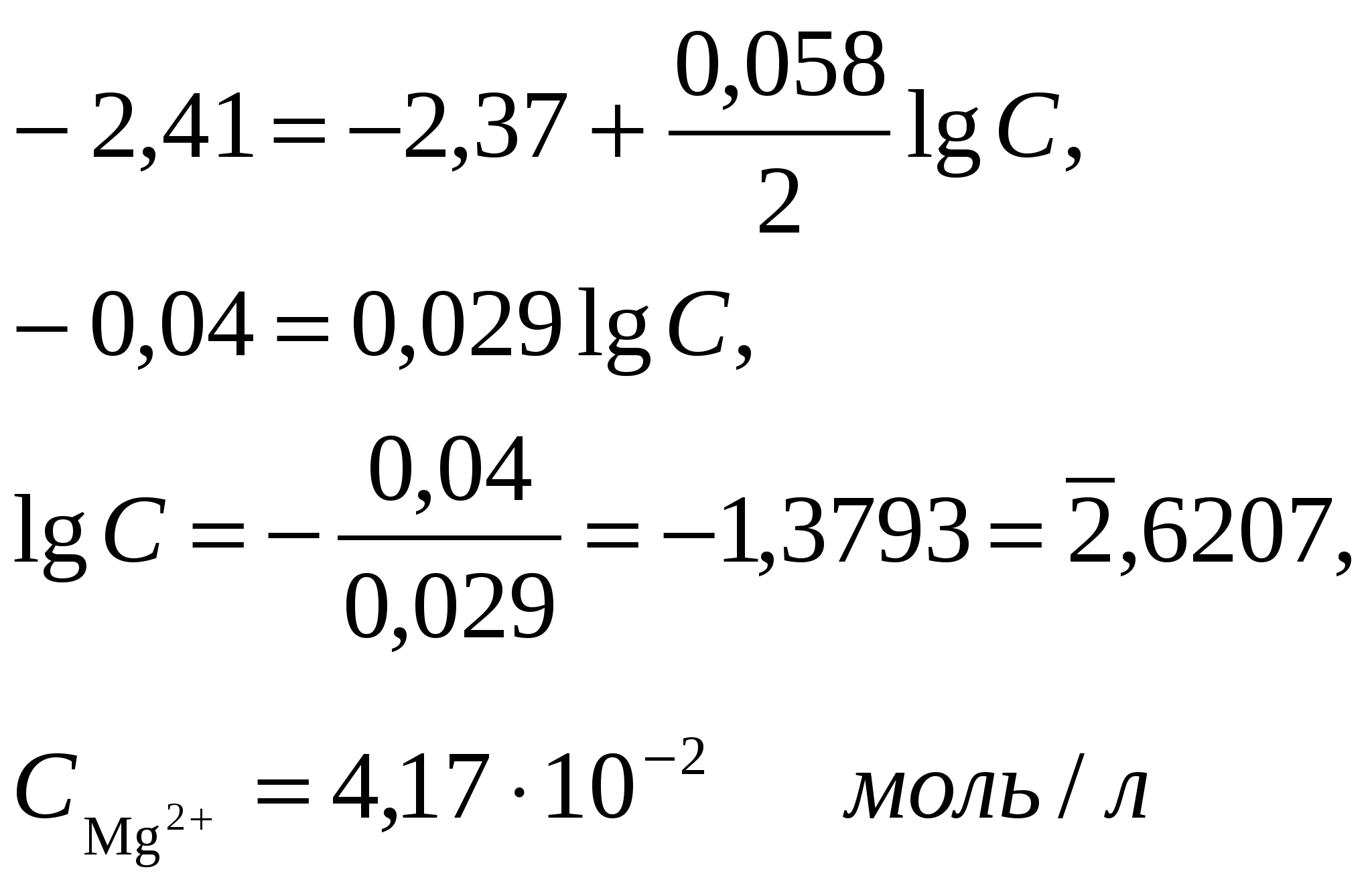 Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его э. д. с. Решение. Схема данного гальванического элемента ()MgMg2+║Zn2+Zn(+) Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки границу раздела двух жидких фаз пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (2,37 В) и является анодом, на котором протекает окислительный процесс: Mg2ē=Mg2+ (1) Цинк, потенциал которого 0,763В, катод, т. е. электрод, на котором протекает восстановительный процесс: Zn2+ + 2ē = Zn (2) Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов; Mg + Zn2+ = Mg2+ + Zn Для определения электродвижущей силы э. д. c. гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то э. д.с. элемента равна разности стандартных потенциалов двух его электродов: э. д. с.= Е°(Zn2+/Zn) Е°(Mg2+/Mg)= 0,763 (2,37)=1,607 B. 221. В два сосуда с голубым раствором медного купороса поместили: в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции. 222. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4 ; б) MgSO4; в) Pb(NO3)2 ? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций. |
