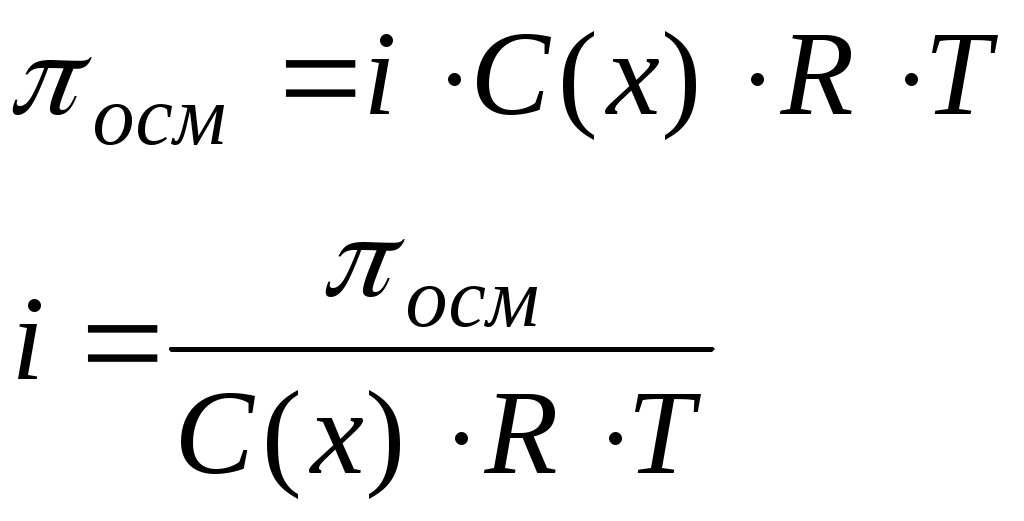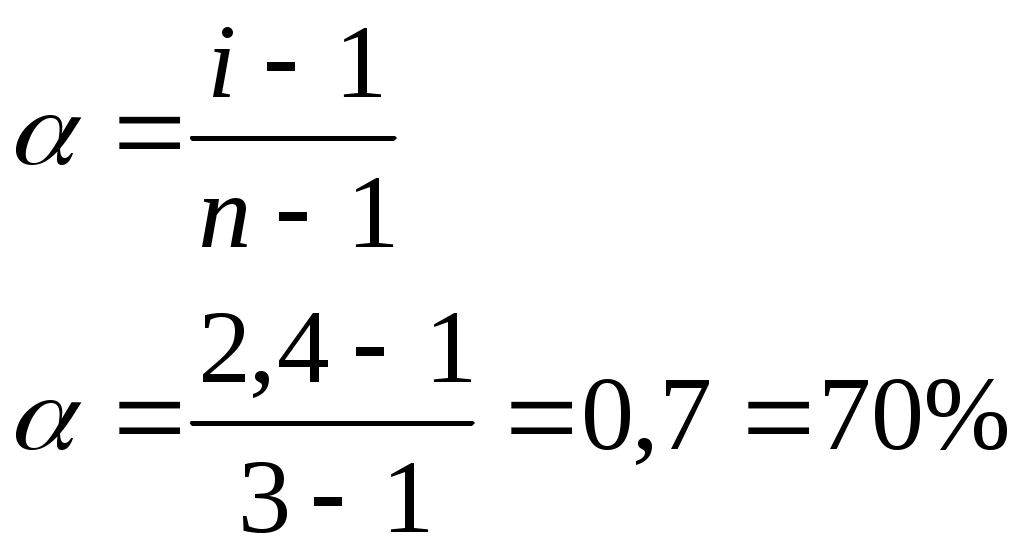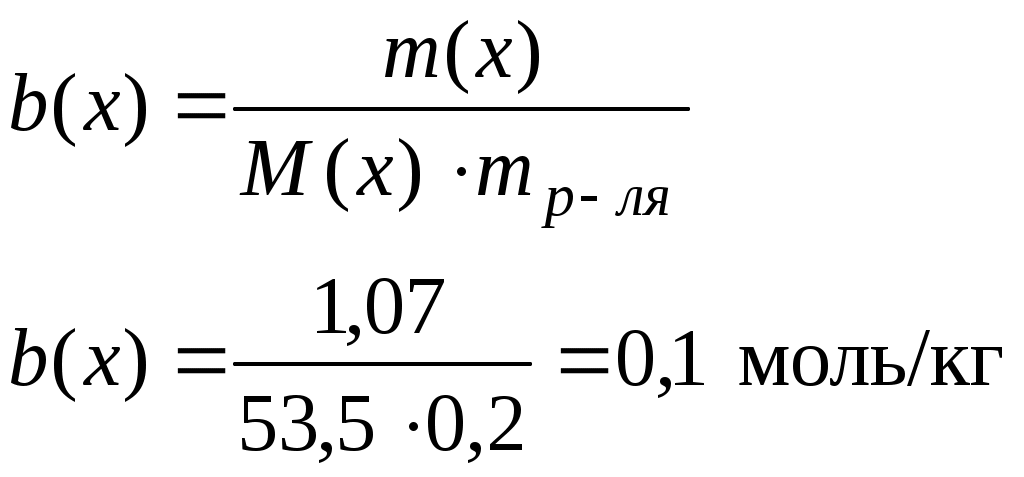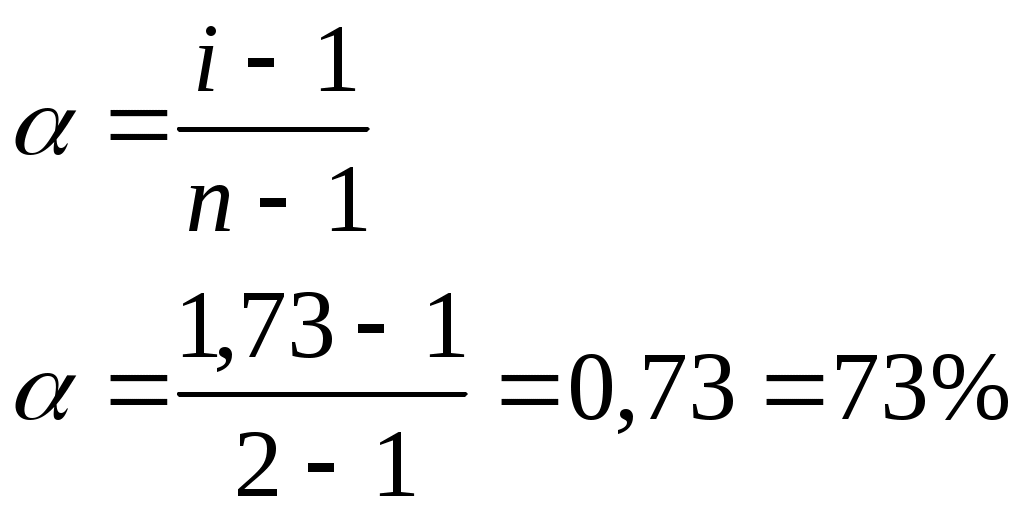КОНТРОЛЬНАЯ РАБОТА №1. Программа по Общей и неорганической химии, даны рекомендации по ее изучению. Пособие содержит варианты контрольных работ, требования к их содержанию и оформлению,, вопросы для подготовки к экзамену
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
p – Элементы IV группы Общая характеристика группы. Общая характеристика углевода. Аллотропические модификации углерода. Типы гибридизации атома углерода и строение углеродосодержащих молекул. Углерод как основа всех органических молекул. Физические и химические свойства простых веществ. Активированный уголь как адсорбент. Углерод в отрицательных степенях окисления. Карбиды активных металлов и соответствующие им углероды. Углерод (II). Оксид углерода (II), его КО и ОВ характеристика, свойства как лиганда, химические основы его токсичности. Цианистоводородная кислота, простые и комплексные цианиды. Химические основы токсичности цианидов. Соединения углерода (IV). Оксид углерода (IV), стереохимия и природа связи, равновесия в водном растворе. Угольная кислота, карбонаты и гидрокарбонаты, гидролиз и термохимическое разложение. Биохимическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации. Кремний. Общая характеристика. Основное отличие от углерода: отсутствие пи – связи в соединениях. Силициды. Соединения с водородом (силаны), окисление и гидролиз. Тетрафторид и тетрахлорид кремния, гидролиз. Гексафторосиликаты. Кислородные соединения. Оксид кремния (IV). Силикагель. Кремневая кислота. Силикаты. Растворимость и гидролиз. Природные силикаты и алюмосиликаты, цеолиты. Кремний органическое соединений. Силиконы и силиксаны. Использование в медицине соединений кремния. Химические основы использования соединений олова и свинца в анализе фармпрепаратов. p – Элементы V группы Общая характеристика группы. Азот, фосфор, мышьяк в организме, их биологическая роль. Азот. Общая характеристика. Многообразие соединений с различными степенями окисления азота. Причина малой химической активности азота. Молекула азота как лиганд. Соединения с отрицательными степенями окисления. Нитраты (ковалентные и ионные). Аммиак, КО и ОВ характеристика, реакции замещения. Амиды. Аммиакаты. Свойства аминокислот как производных аммиака. Ион аммония и его соли, кислотные свойства, термическое разложение. Гидразин и гидроксиламин. КО и ОВ характеристика. Азотистоводородная кислота и азиды. Соединения азота в положительных степенях окисления. Оксиды. Стереохимия и природа связи. Способы получения. КО и ОВ свойства. Азотистая кислота и нитриты. КО и ОВ свойства. Азотная кислота и нитраты. КО и ОВ характеристика. «Царская вода». Фосфор. Общая характеристика. Аллотропические модификации фосфора, их химическая активность. Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота. Элементы подгруппы мышьяка. Общая характеристика. Водородные соединения мышьяка, сурьмы и висмута в сравнении с аммиаком и фосфином. Определение мышьяка по методу Марша. Понятие о химических основах применения в медицине и фармации аммиака, оксид азота (I) (закиси азота), нитрита и нитрата натрия, оксидов и солей мышьяка, сурьмы и висмута. Химические основы использования соединений p – элементов V группы в фармацевтическом анализе. p – Элементы VI группы Общая характеристика группы. Кислород. Общая характеристика. Роль кислорода как одного из наиболее распространенных элементов и составной части большинства неорганических соединений. Особенности электронной структуры молекулы кислорода. Химическая активность кислорода. Молекула О2 в качестве лиганда в оксигемоглобине. Озон, стереохимия и природа связей. Химическая активность в сравнении с кислородом (реакция с растворами иодидов). Классификация кислородных соединений и их общие свойства (в том числе бинарные соединения: супероксиды (гипероксиды, надпероксиды), пероксиды, оксиды, озониды). Сера. Общая характеристика. Способность к образованию гомоцепей. Соединения серы. Биологическая роль серы (сульфгидрильные группы и дисульфидные мостики и белках). Химические основы применения серы и ее соединений в медицине, фармации, фармацевтическом анализе. Селен и теллур. Общая характеристика. КО и ОВ свойства водородных соединений и их солей. Оксиды и кислоты, их КО и ОВ свойства (в сравнении с подобными соединениями серы). Биологическая роль селена. p – Элементы VII группы (галогены) Общая характеристика группы. Особые свойства фтора как наиболее электроотрицательного элемента. Простые вещества, их химическая активность. Соединения галогенов с водородом. Растворимость в воде; КО и ОВ свойства. Ионные и ковалентные галиды, их отношение к действию воды, окислителей и восстановителей. Способность фторидиона замещать кислород (например, в соединениях кремния). Галогенид – ионы как лиганды в комплексных соединениях. Понятие о химизме бактерицидного действия хлора и йода. Применение в медицине, санитарии и фармации хлорной извести, хлорной воды, препаратов активного хлора, йода, а также соляной кислоты, фторидов, хлоридов, бромидов и йодидов. p – Элементы VIII группы (благородные газы) Общая характеристика. Физические и химические свойства благородных газов. Соединения благородных газов. Применение благородных газов в медицине. Список литературы а) основная литература
б) дополнительная литература
Методические рекомендации и указания к выполнению контрольной работы Студенты 1 курса фармацевтического факультета (очная форма обучения с применением дистанционных технологий) изучают общую и неорганическую химию в 1 и 2 семестрах. Общая и неорганическая химия, дисциплина на которой базируется изучение последующих дисциплин (органическая, аналитическая, физическая, коллоидная, фармацевтическая химия и др.). Работа студента над курсом общей и неорганической химии включает самостоятельное изучение материала по учебникам и учебным пособиям с использованием справочной литературы, выполнение контрольных работ (применение теоретических знаний к решению расчетных задач, использование Периодической системы химических элементов Д.И.Менделеева для характеристики свойств элементов и их соединений). В период выездной сессии студенты выполняют лабораторные работы, посещают лекции и сдают собеседование. Всего студент очной формы обучения с применением дистанционных технологий фармацевтического факультета выполняет две контрольные работы ( в 1 и 2 семестре). При решении задач и ответов на вопросы следует иметь в виду следующее: Решение задач необходимо сопровождать пояснением. Математические расчеты обязательно доводить до конкретного числового ответа (необходимо возводить в степень, извлекать корни, вычислять логарифмы чисел и производить другие математические операции). При решении задач на химическое равновесие и выражение константы равновесия следует подставлять значения равновесных концентраций веществ выраженных в моль/л. В ионных уравнениях в виде молекул следует писать малорастворимые вещества, слабые электролиты, в том числе и комплексные ионы, газообразные вещества. При решении вопроса о растворимости веществ и силе электролитов пользоваться соответствующими справочными таблицами. Окислительно – восстановительные реакции, протекающие в водных растворах, уравниваются ионно – электронным методом, который рассматривает изменение реально существующих в растворах молекул и ионов. При составлении ионно – электронных схем процессов восстановления и окисления малорастворимые электролиты, слабые электролиты (малоионизированные ионы), газообразные вещества следует писать в молекулярной форме, кроме того надо учитывать рН среды. При написании протолитических реакций в растворах электролитов следует приводить ионные и молекулярные уравнения. При выполнении заданий следует пользоваться справочными таблицами по константам ионизации слабых электролитов, произведениям растворимости и константам нестойкости комплексных ионов. Ответы на контрольные вопросы должны быть краткими но исчерпывающими и сопровождаться теоретическими обоснованиями, формулами и уравнениями химических реакций. При ответе на теоретические вопросы не следует переписывать текст учебника. Все задачи следует решать в системе СИ. Методические рекомендации по решению задач I. Способы выражения концентрации растворов Для решения задач необходимо знать следующие понятия и величины: 1. Количество вещества 1. Моль – количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 0,012 кг углерода – 12. При использовании моля как единицы количества вещества следует учитывать какие именно реальные или условные частицы имеются ввиду. 2. Молярная масса М(х) – масса 1 моль вещества. Например, молярная масса серной кислоты М(H2SO4)= 98 г/моль; молярная масса иона алюминия М(Al3+) = 27 г/моль m (x) 3. Количество вещества: n(x) = M(x) 4. Число Авогадро. 1моль любого вещества содержит одинаковое число частиц (реальных или условных). NA = 6,02∙ 1023 моль-1 2. Количество вещества эквивалента 1. Эквивалент – это реальная или условная частица вещества х, которая эквивалентна одному иону водорода в обменной реакции или в окислительно – восстановительных реакциях эквивалентна одному электрону. 2. Фактор эквивалентности – показывает, какая доля реальной частицы х эквивалентна одному иону водорода в обменной реакции или в окислительно – восстановительных реакциях эквивалентна одному электрону Число, стоящее в знаменателе дроби – число эквивалентности – z fэкв (x) = 1/Z Величина Z – всегда целое положительное число (1,2,3 и т.д.) Фактор эквивалентности зависит от: природы веществ; стехиометрии реакций, в которых они участвуют – значение фактора эквивалентности может изменяться а) определение фактора эквивалентности для различных классов соединений в обменных реакциях кислоты fэкв кислоты = 1/ основность для HCl, Z =1, fэкв – 1 для H2SO4, Z = 2, fэкв – ½ для H3 PO4, Z = 3, fэкв – 1/3 а) H2SO4 + NaOH = Na2SO4 + 2H2O В этой реакции в молекуле H2SO4 замещается два атома водорода, следовательно, Z = 2, fэкв H2SO4 – ½ б) H2SO4 + NaOH = NaНSO4 + H2O В этом случае в молекуле Na2SO4 замещается один атом водорода, Z =1, fэкв H2SO4 – 1 Для фосфорной кислоты, в зависимости от реакции, значения факторов эквивалентности могут быть 1, ½, 1/3 основания fэкв основания= 1/кислотность для КОН Z =1, fэкв – 1 для Ca(OH)2 Z = 2, fэкв – ½ Фактор эквивалентности многокислотных оснований может меняться в зависимости от количества замещенных групп (также как и у кислот). Например, для Ca(OH)2 возможны значения fэкв – 1,1/2, для Al(OH)3 – 1,1/2, 1/3 1_____________________ соли fэкв(соли) = заряд катиона∙ число атомов катионов для KCl fэкв – 1 для Cr(NO3)3 fэкв -1/3 для Al2(SO4)3 fэкв -1/6 Значение факторов эквивалентности для солей также зависит и от реакции, аналогично зависимости его для кислот и оснований. б) определение fэкв веществ в ОВР _____1___________ fэкв(окислителя или восст – ля) = число отданных, принятых электронов а) MnO4- + 8H+ + 5е = Мn2++ 4H2O; fэкв (KMnO4) = 1/5 б) MnO4- + е = MnO42-; fэкв (KMnO4) = 1 3. Молярная масса эквивалента вещества Х – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества Х: М (1/z х) = 1/z М(х) или М (fэквХ) Х) = fэкв(Х)∙ М(Х) = М (1/z х) а) H2SO4 +2NaOH = Na2SO4 + 2H2O fэкв (NaOH) = 1, М(NaOH) = 40 г/моль; М (1 NaOH) = 40г/моль fэкв (H2SO4) = 1/2; М(H2SO4) = 98 г/моль; М(1/2 H2SO4)= 49г/моль б) H2SO4 + NaOH = NaНSO4 + H2O fэкв (NaOH) = 1, М(NaOH) = 40 г/моль; М (1 NaOH) = 40г/моль fэкв (H2SO4) = 1; М(H2SO4) = 98 г/моль; М( 1H2SO4) = 98 г/моль; 4.Количество вещества эквивалента: m(X) n(1/z X) = M(1/z X), Закон эквивалентов: Вещества реагируют пропорционально их эквивалентам: С (1/z X) ∙V(X) = С (1/z Y) ∙ V(Y) Способы выражения концентрации растворов 1.Массовая доля ω показывает отношение массы растворенного вещества m(x) к массе раствора: m (x) ω = m (р-р) m (x) ∙100% ω (%) = m (р-р) Массовую долю можно выражать в долях единицы или в % Например, ω(x) = 0,1 или ω(x) =10% 2. Молярная концентрация С(х) – отношение количества вещества n(x), содержащегося в системе (например в растворе) к объему этой системы V n (x) С(х)= V ; моль/л Например, С(KCl) = 2,5 ∙10-3моль/л 3.Молярная концентрация эквивалента С(1/z∙x) – отношение количества вещества эквивалента n(1/z∙x) содержащегося в системе (например в растворе) к объему этой системы V. Единица измерения моль/л. С(1/z ∙х)= n (1/z ∙x) V ; Например, С(1/z NaCl) = 2,0 ∙10-2 моль/л 4.Моляльная концентрация b(x) – отношение количества вещества n (x), содержащегося в системе (например в растворе) к массе растворителя mр-ля. Единица измерения моль/кг n (x) b(x) = mр-ля 5. Титр раствора Т (х) – масса вещества m (х), содержащаяся в 1 мл раствора. Единица измерения г/мл. m (x) Т (х) = V 6. Массовая концентрация Y(x) – отношение массы компонента, содержащегося в системе (растворе), к объему этой системы. Единица измерения г/л m (x) Y(x) = V Молярная доля компонента - отношение количества вещества данного вещества к суммарному количеству вещества всех веществ в растворе n (x) N = n(cмесь) Объемная доля компонента φ(Х) – V(x) φ(Х) = V(смесь) дополнительные формулы: mр-ра ρр-ра = Vр-ра г/мл ω%∙ρ∙10 С(х) = М(х) если не указан объем или масса раствора mр-ра = mр-ля + mв-ва Задача1.Какую массу Na2B4O7∙ 10H2O и воды надо взять для приготовления 2 кг раствора с ω = 5%, в расчете на безводную соль. Дано: Решение: mр-р = 2кг Na2B4O7∙ 10H2O(ТВ) = Na2B4O7(р-р) (ω=5%) ω% = 5% = 0,05 Из реакции образования кристаллогидрата М(2) = 382 г/моль Na2B4O7 + 10H2O = Na2B4O7∙ 10H2O следует: М(1) = 202 г/моль (1) (3) (2) m(2) = ? m m(3) = ? n(1) = n(2). Т.к n = M ; то m(1)∙M(2) m(1) /М(1) = m(2)/ М(2); m(2)= M(1) mв-ва Из ω = mр-р находим m(1) = mр-р ∙ ω mр-р ∙ ω∙ М(2) 2кг∙0,05∙382г/моль Следовательно: m(2) = M(1) = = 0,189 кг m(3) = 2 кг – 0,189 кг = 1,811 кг ответ: m(2) = 0,189 кг, m(3)= 1,811 кг Задача На титрование 15 мл раствора H2SO4 с молярной концентрацией эквивалента С (1/2 H2SO4) 0,8 моль/л пошло 12 мл раствора КОН. Определить молярную концентрацию эквивалента КОН (С1/z КОН) в растворе. Дано: Решение: V(H2SO4) = 15 мл С (1/2 H2SO4) = 0,8 моль/л H2SO4 + 2КОН = K2SO4 + 2H2O V(КОН) = 12 мл 1 2 (С1/z КОН) =? Согласно закону эквивалентов: n(1/z X1) = n(1/z X2), т.к. n(1/z X1) = C(1/z X1)∙ V1 = C(1/z X2)∙ V2 C(1/Z H2SO4) ∙ V (H2SO4)= (С1/z КОН)∙ V (КОН) 15 мл∙ 0,8мл С1/zКОН) = 12 мл =1,04 моль/л Ответ: молярная концентрация эквивалента раствора щелочи равна 1,04 моль/л АЛГОРИТМ ДЕЙСТВИЯ при решении задач на следствие из закона Гесса Задача: Вычислить ∆Но реакции C2H5OH(ж) + O2(г) =СH3COOH(ж) + H2O(ж) 1 2 3 4 Дано: Решение: Из закона Гесса следует: ∆Нообр.1.= - 278кДж/моль ∆Нореакции= ∑ n ∆Н0обр(прод)- ∑ n ∆Н0обр(исх) ∆Нообр.3 = - 485 кДж/моль ∆Нореакции= [1моль∙(- 485 кДж/моль) +1моль∙ (- 286 кДж/моль) ] - [1моль∙(-278 кДж/моль)]= -493кДж ∆Нообр.4 = -286 кДж/моль ∆Но реакции=? Алгоритм решения задач с использованием законов Рауля Задача: Вычислите температуру кипения раствора, содержащего 100 г С12Н22О11 сахара в 750 г воды.
Алгоритм решения задач с использованием закона Вант-Гоффа Задача: Навеска неэлектролита массой 17,64 г была растворена в воде, а объем раствора доведен до 1 литра. Осмотическое давление оказалось равным 2,38·105 Па при температуре 20оС. Определите молярную массу неэлектролита.
Алгоритм решения задач по определению «кажущейся» степени диссоциации (α) Задача: При 0оС осмотическое давление раствора карбоната натрия с концентрацией 0,1 моль/л равно 272,6 кПа. Определить «кажущуюся» степень диссоциации.
Задача: Температура кипения раствора NH4Cl, полученного растворением соли массой 1,07 г в 200 мл воды, равна 100,09оС. Определить степень диссоциации (α %) соли в этом растворе.
АЛГОРИТМ ДЕЙСТВИЯ при решении задач на вычисление рН раствора и концентраций ионов Н+ и ОН‑ Задача 1. Вычислите рН раствора, если концентрация ионов водорода равна 7,410-3 моль/л. Решение: рН = -lg[H++] = -lg(7,410-3)=(-lg7,4)+ (-lg10-3) = (-0,87) + (3) = 3-0,87 = 2,13. Задача 2. Вычислите концентрации ионов [H++] и [ОН‑] в растворе с рН = 8,48. Решение: Для нахождения концентрации ионов Н+ необходимо выполнить антилогарифмирование (найти число по логарифму): рН = -lg[H+] = 8,48; -рН = lg[H+] = -8,48. Представим число (-8,48) как алгебраическую сумму целой и дробной части (характеристики и мантиссы): - 8,48 = (-8)+(-0,48). Чтобы воспользоваться таблицей логарифмов, мантиссу необходимо сделать положительной. Для этого от характеристики отнимаем единицу, а к мантиссе эту единицу прибавляем: (-8) + (-0,48) =(-9)+(0,52); меняем слагаемые местами: 0,52 + (- 9). Находим в таблице (см. приложение) мантиссу 52 (или ближайшую к ней), проводим перпендикуляры влево и вверх от нее. Число, имеющее мантиссой 52, есть 33 (3 слева, 3 вверх). Так как характеристика числа 0,52 равна 0, то в целую часть найденного числа выделяем 0 + 1 = 1 цифру и ставим запятую: 3,3. Число (-9) есть логарифм числа 10-9. Находим произведение полученных чисел: 3,310-9. Ответ: [H+] = 3,310-9 моль/л; [ОН‑] = Задача 3. Определите концентрацию ионов ОН‑ в растворе NН4ОН (С = 0,01 моль/л; Кд = 1,810-5). Рассчитайте рН этого раствора. Решение: NН4ОН - слабый электролит и диссоциирует обратимо: NH4OH NH4+ + OH‑. В соответствии с законом Оствальда степень диссоциации равна: 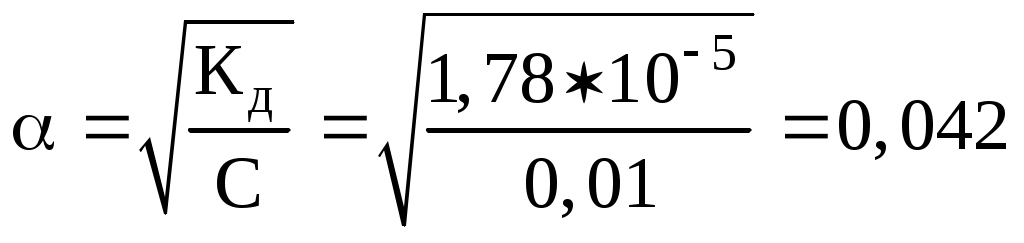 ; ;концентрация ионов [ОН‑] == 0,010,0421 = 4,210-4 моль/л рОН = - lg[ОН‑] = - lg(4,210-4) = 4 - 0,63 = 3,37; рН = 14 - 3,37 = 10,63. Задача 4. Вычислите рН раствора NаОН ( = 0,08 %; плотность - 1 г/мл; степень диссоциации - 1). Ршение: Молярная концентрация раствора NаОН равна: Так как степень диссоциации = 1, [ОН] = 0,02 моль/л; рОН = - lg[ОН‑] = -lg(0,02) = -lg(210-2) = 2 - 0,3 = 1,7; рН = 14 - рОН = 14‑1,7 = 12,3. Задача 5. Вычислите молярную концентрацию раствора муравьиной кислоты (рН = 3; Кд (НСООН) = 1,810-4). Решение. НСООН НСОО‑ + Н+; Так как рН = 3, то [Н+] = 10-3; Задача 6. Вычислите рН среды, константу и степень гидролиза раствора КNО2 (С = 0,05 моль/л). Решение: КNО2 - соль слабой кислоты и сильного основания. Для расчета рН воспользуемся формулой: По таблице (см приложение) определяем рК азотистой кислоты: рК = 3,4; рН = 7 + 1/23,4 + 1/2lg(0,05) = 7 + 1,7 + 1/2(-1,3)= 8,7 - 0,65 = 8,05. Константу гидролиза определяем по формуле: Вычисляем степень гидролиза: 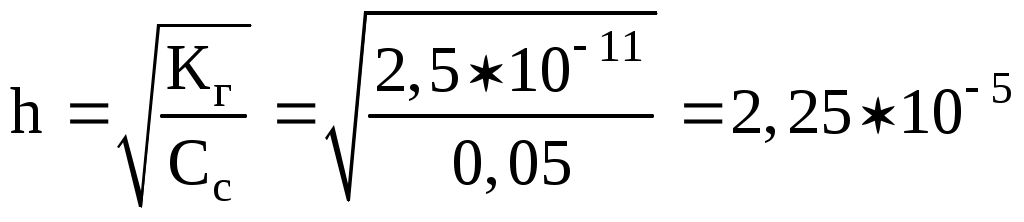 , , или: 2,2510-5100% = 2,2510-3%. Гетерогенные процессы и равновесия Задача 1. В 2 литрах раствора при 20 С содержится 0,326 г сульфата кальция. Определить ПР этой соли.
|