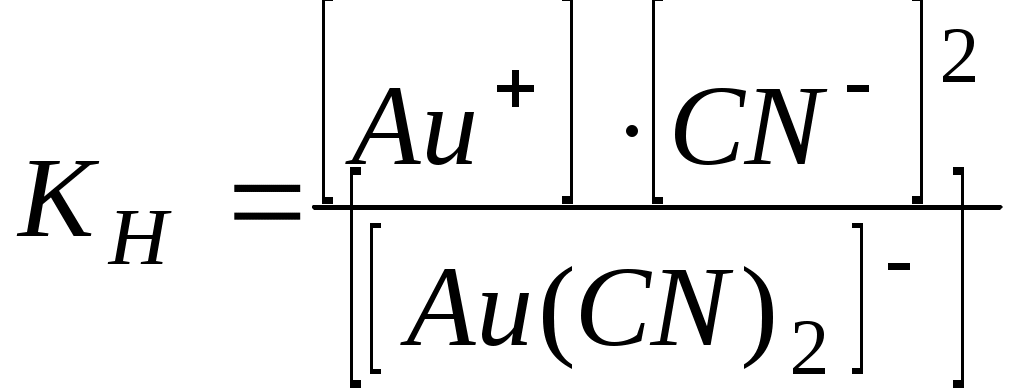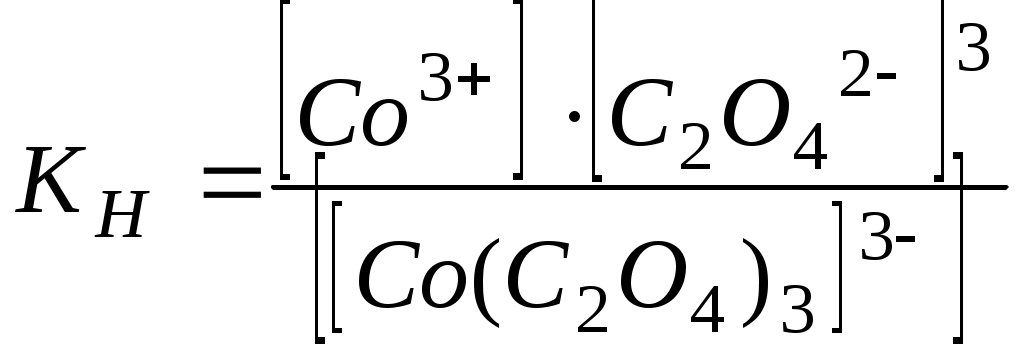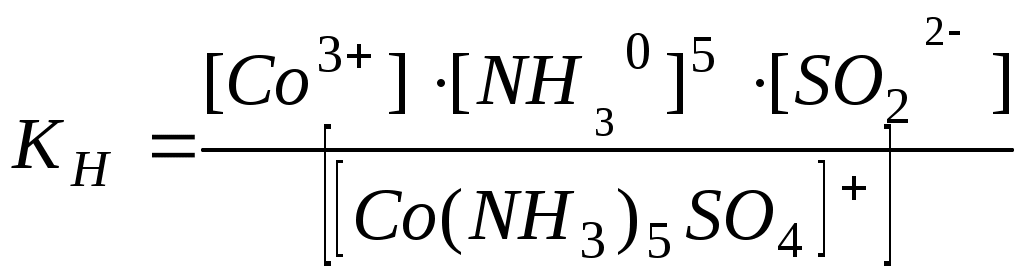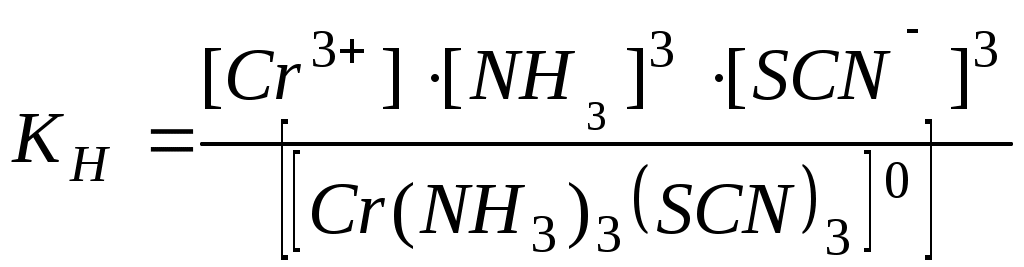|
|
КОНТРОЛЬНАЯ РАБОТА №1. Программа по Общей и неорганической химии, даны рекомендации по ее изучению. Пособие содержит варианты контрольных работ, требования к их содержанию и оформлению,, вопросы для подготовки к экзамену
Задача 2. Произведение растворимости гидроксида хрома (III) 5,410-31 при 20С. Вычислить растворимость этого основания (в моль/л и г/л).
Алгоритм
|
Решение
|
1. Изобразить схему равновесия в насыщенном растворе над осадком.
|
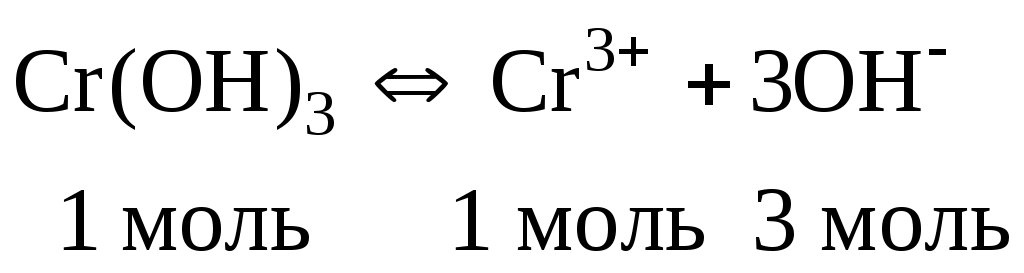
|
2. Написать выражение для ПР и определить молярную концентрацию гидроксида хрома в растворе над осадком.
|
ПР = [Cr3+][OH‑]3; ПР = х(3х)3 = 27х4
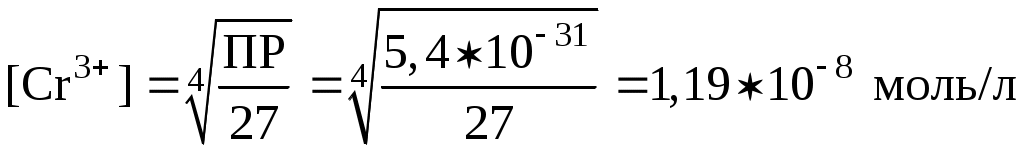 ; ;
Из уравнения диссоциации следует, что:
C(Cr(OH)3) = 1.1910-8 моль/л
|
3. Рассчитать массовую концентрацию Cr(OH)3.
| Р(Cr(OH)3) = СМ = 1,1910-8 моль/л 103 г/моль =
= 1,2210-6 г/моль.
|
Задача 4. Выпадет ли осадок, если смешать равные объемы двух растворов
1) С(АgNО3) = 0,001 моль/л; 2) С(К2СrО4) = 0,005 моль/л
Алгоритм |
Решение
|
1. Написать уравнения диссоциации солей исходных растворов и определить концентрации ионов, образующих осадок.
|
AgNO3 Ag+ + NO3‑
K2CrO4 2K+ + CrO42-
[Ag+] = 0,001 моль/л; [CrO42‑] = 0,005 моль/л
|
2. Изобразить схему равновесия в насыщенном растворе над осадком.
|
Ag2CrO4 2Ag+ + CrO42‑
|
3. Определить концентрации ионов после смешивания растворов.
|
Поскольку смешали равные объемы, то общий объем увеличился в 2 раза, а концентрации ионов, следовательно, уменьшились в 2 раза
[Ag+] = 0,0005 моль/л; [CrO42‑] = 0,0025 моль/л
|
4. Рассчитать значение произведения концентрации ионов в данном растворе (ИП).
|
ИП = (510-4)2(2,510-3) = 6,2510-10
|
5. Сравнить значение ИП с ПР и сделать вывод о возможности образования осадка.
|
ИП(6,2510-10) > ПР(410-12) осадок выпадет
|
Комплексные соединения
Задачи с эталонами решения
Пример 1:
Вычислите заряды комплексных ионов, образованных платиной (IV): 1) [Pt(NH3)4Cl2]; 2) [Pt(NH3)Cl5]; 3) [Pt(NH3)2Cl4].
Решение:
1) Степень окисления атома платины равна «+4», заряд молекулы NH3 равен нулю, а заряды двух хлорид-ионов равны «-2»; алгебраическая сумма зарядов:
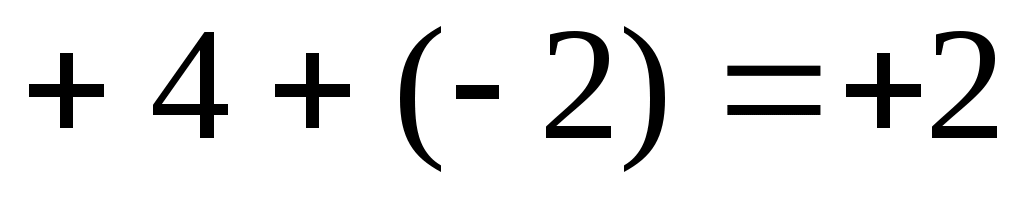
Заряды других комплексных ионов:
2) 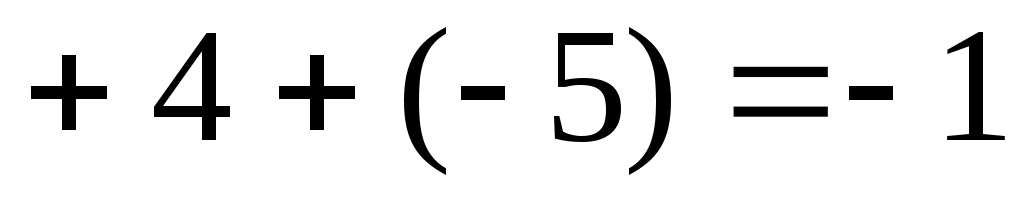
3) 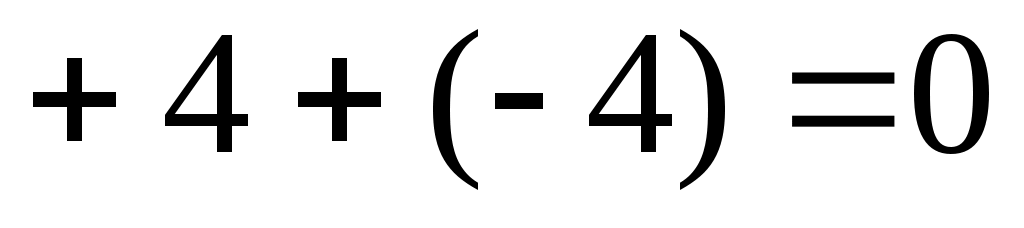
В первом случае внешняя сфера содержит отрицательно заряженные ионы; во втором – положительно заряженные ионы; а в третьем – соединение практически является неэлектролитом.
Пример 2:
Определить заряды комплексообразователей в комплексных соединениях: 1) K4[Fe(CN)6]; 2) [Cr(H2O)4(S2O3)]Cl; 3) [Co(NH3)Cl3].
Решение:
1) Заряд внутренней среды, куда входит комплексообразователь – железо, равен заряду внешней среды, но противоположен по знаку:
[Fe(CN)6]4-;
с учетом заряда и количества лигандов составляем уравнение:
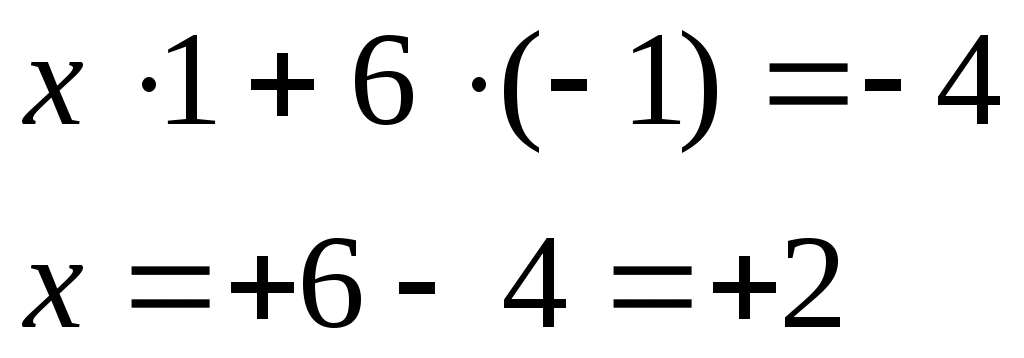
x – заряд комплексообразователя.
Fe+2.
2) [Cr(H2O)4(S2O3)]Cl
[Cr(H2O)4(S2O3)]+
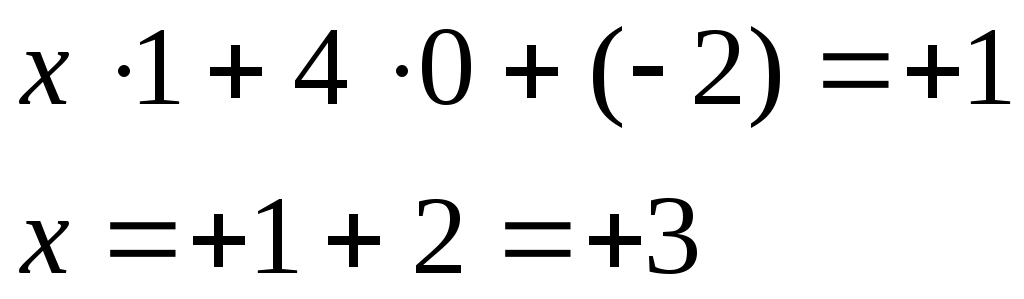
Cr+3.
3) [Co(NH3)Cl3]
[Co(NH3)Cl3]0
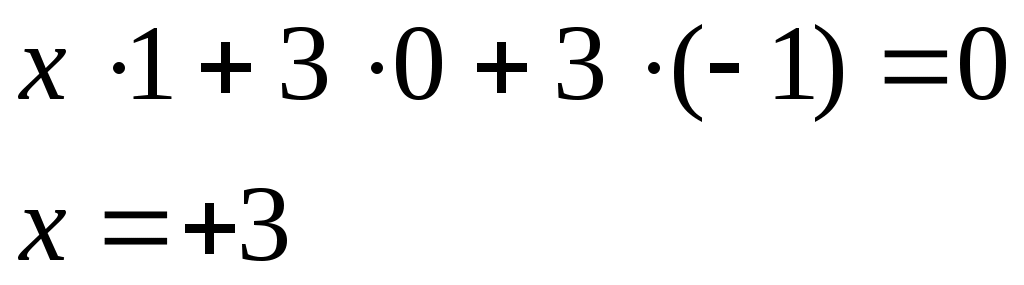
Co+3.
Пример 3:
Определить координационные числа центрального атома (комплексообразователя) в комплексных соединениях: 1) [Co(NH3)6]Cl3;
2) [Pt(NH3)5Cl]Сl; 3) [Cr(H2O)3(NH3)3]Cl3; 4) [Co(en)2Cl2].
Решение:
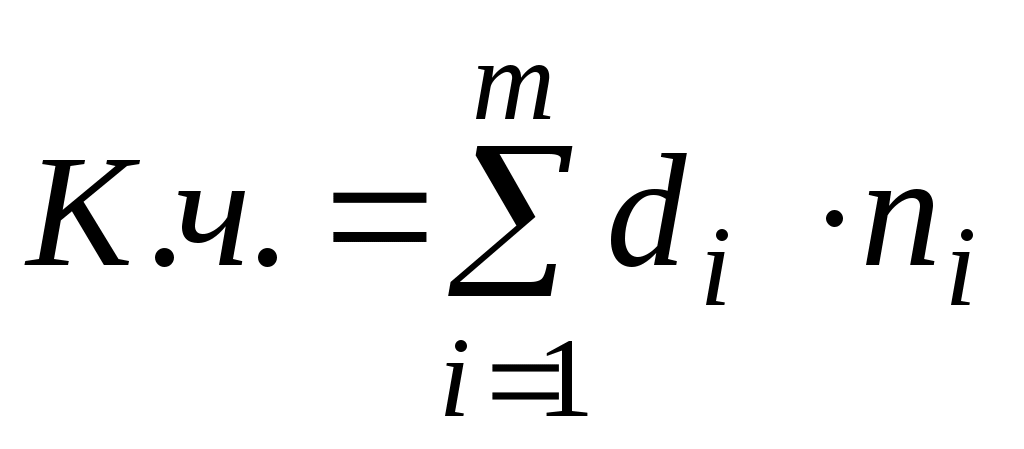 , ,
где n – число лигандорв;
d – дентантность лигантов
1) 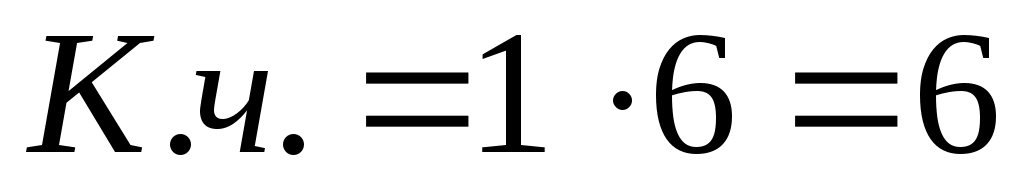
2) 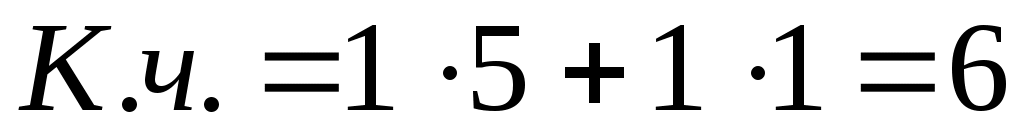
3) 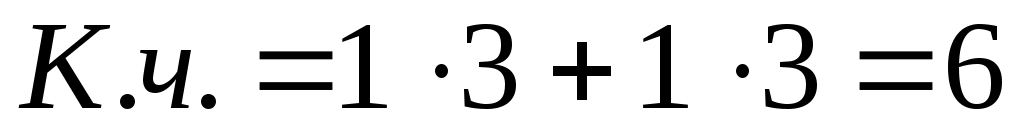
4) 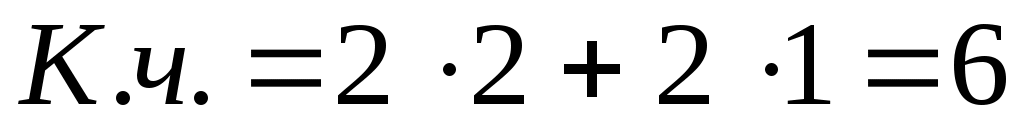
Пример 4:
Написать уравнения диссоциации комплексных солей по первой и второй ступеням и выразить KН этих солей:
а) K[Au(CN)2];
б) Na3[Co(C2O4)3];
в) [Co(NH3)5SO4]NO3;
г)[Cr(NH3)3(SCN)3].
Решение:
По типу сильного электролита соли диссоциируют на внешнюю и внутреннюю сферы по первой ступени:
а) 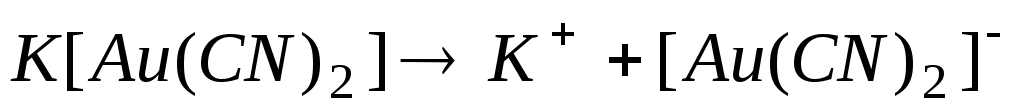 - первая ступень; - первая ступень;
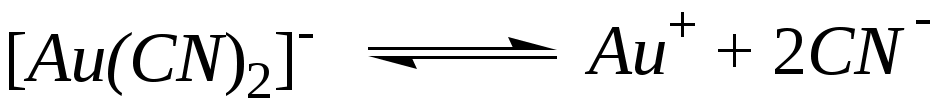 - вторая ступень - вторая ступень
По типу слабого электролита идет диссоциация вторичная и KН записывают исходя из полной диссоциации комплексного иона:
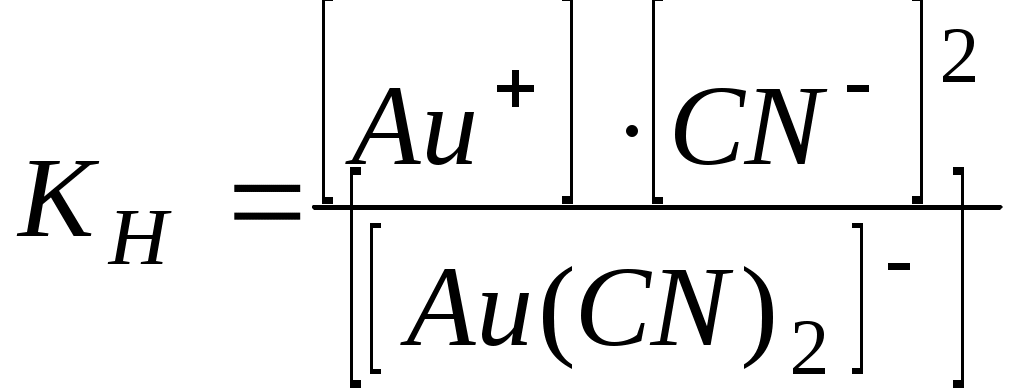
б) 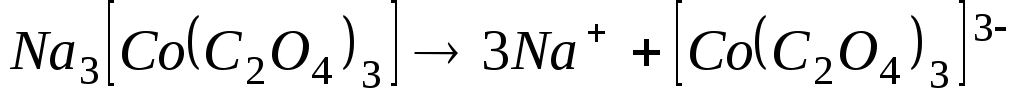 - первая ступень; - первая ступень;
 - вторая ступень. - вторая ступень.
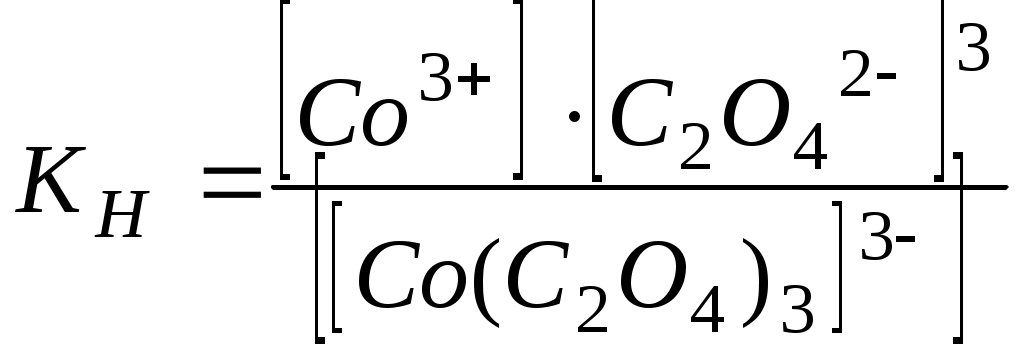
в) 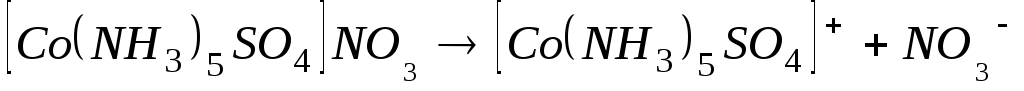 - первая ступень; - первая ступень;
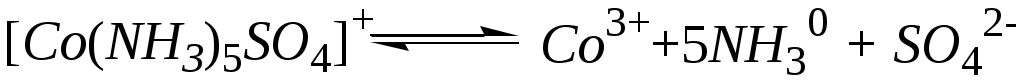 - вторая ступень. - вторая ступень.
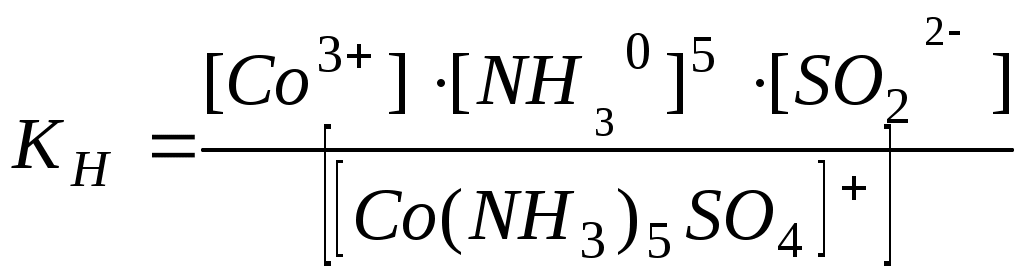
г) 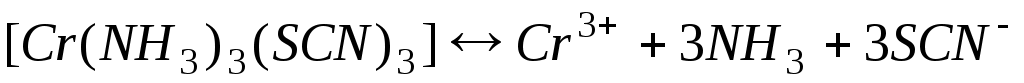
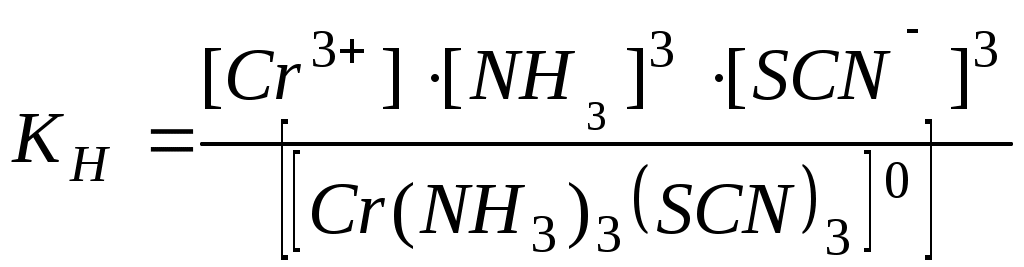
У нейтральных комплексов диссоциация идет только по типу слабых электролитов.
Пример 5:
Назовите следующие комплексные соли:
а) [Pt(NH3)5Cl]Cl3;
б) [Cu(NH3)2(SCN)2];
в) Na2[Cr(CN)4(gly)];
Решение:
Название комплексных солей дают в соответствии с правилами номенклатуры для солей анионного, катионного или нейтрального тиа.
а) хлоридхлоропентааммин платины (IV);
б) дитиоцианодиамминмедь;
в) глицинатотетрацианохромат (III) натрия;
Оформление контрольной работы
Титульный лист
Федеральное государственное бюджетное образовательное учреждение высшего образования "Оренбургский государственный медицинский университет" Министерства здравоохранения Российской Федерации
ФГБОУ ВО ОрГМУ Минздрава России
Кафедра фармацевтической химии
ФИО
Группа _____ фип
Специальность «Фармация 33.05.01.»
Контрольная работа по дисциплине «Общая и неорганическая химия»
Модуль 1 - 3
Вариант ___
Оренбург - 2020
- Полностью переписать текст задания, сохраняя ту же нумерацию, что и в «Методических рекомендациях», а затем выполнить это задание.
- Если контрольная работа не засчитывается, то она возвращается студенту с замечаниями преподавателя. В этом случае студент предоставляет работу на повторную проверку, выполнив указанные в рецензии задания заново, но в этой же тетради.
Варианты контрольной работы
ФИО
|
№ варианта
|
№№ вопросов и задач
|
12-1 фип
|
|
|
Айбулатова Роза Турсунбековна
|
1
|
№ 1-12 пункты а, №5л,№6л
|
Бакыткалиева Асем Нурболаткызы
|
2
|
№ 1-12 пункты б, №5м,№6м
|
Горбузняк Аниса Рафхатовна
|
3
|
№ 1-12 пункты в, №5и,№6и
|
Джаббарова Екатерина Валерьевна
|
4
|
№ 1-12 пункты г, №5о,№6о
|
Ерназарова Нурслу Елжановна
|
5
|
№ 1-12 пункты д, №5п,№6п
|
Исбулатова Динара Арстоновна
|
6
|
№ 1-12 пункты е, №5 р,№6р
|
Кадырова Клара Абдигалиевна
|
7
|
№ 1-12 пункты ж,№ 5 с,№6с
|
Кульжанов Амир Кайратович
|
8
|
№ 1-12 пункты з,№ 5 т,№6т
|
Мейрамбекова Назерке Мейрамбековна
|
9
|
№ 1-12 пункты и,№ 5 у,№6у
|
Мукатаева Молдир Кайратовна
|
10
|
№ 1-12 пункты к,№ 5 ф,№6ф
|
Нурдилла Сандугаш Изжановна
|
11
|
№ 1-12 пункты а,№ 5 л,№6л
|
Нурмуканова Акмарал Сериковна
|
12
|
№ 1-12 пункты б,№ 5 м,№6м
|
Сейткалиева Асемгул Алдашкызы
|
13
|
№ 1-12 пункты в,№ 5 и,№6и
|
Скибина Диана Николаевна
|
14
|
№ 1-12 пункты г,№ 5 о,№6о
|
Хакимова Кунзия Каирбековна
|
15
|
№ 1-12 пункты д,№ 5 п,№6п
|
Цой Марина Владимировна
|
16
|
№ 1-12 пункты е,№ 5 р,№6р
|
Шарипова Жанат Болатбеккызы
|
17
|
№ 1-12 пункты ж,№ 5 с,№6с
|
12-2 фип
|
18
|
№ 1-12 пункты з,№ 5 т,№6т
|
Абдуали Нуркенай Нурланкызы
|
1
|
№ 1-12 пункты и,№ 5 у,№6у
|
Алимбаева Мария Александровна
|
2
|
№ 1-12 пункты к,№ 5 ф,№6ф
|
Башаева Асем Ермураткызы
|
3
|
№ 1-12 пункты л,№ 5 ф,№6а
|
Бибикова Елена Владимировна
|
4
|
№ 1-12 пункты м,№ 5 ф,№6б
|
Вагина Ольга Витальевна
|
5
|
№ 1-12 пункты н,№ 5 ф,№6в
|
Вьюркова Светлана Оразгалиевна
|
6
|
№ 1-12 пункты о,№ 5 ф,№6г
|
Ергалиева Айнур Кошкалиевна
|
7
|
№ 1-12 пункты п,№ 5 ф,№6д
|
Ермек Зухра Мураткызы
|
8
|
№ 1-12 пункты р,№ 5 ф,№6ж
|
Мироевская Оксана Александровна
|
9
|
№ 1-12 пункты с,№ 5 ф,№6з
|
Мухутдинова Асем Сабыржановна
|
10
|
№ 1-12 пункты т,№ 5 ф,№6и
|
Сулейменова Жанна Мейрамбековна
|
11
|
№ 1-12 пункты и,№ 5 у,№6к
|
Тайырова Алтыннур Кайырбеккызы
|
12
|
№ 1-12 пункты к,№ 5 ф,№6л
|
Токтанаева Динара Советалиевна
|
13
|
№ 1-12 пункты а,№ 5 л,№6м
|
Трибус Валерия Алексеевна
|
14
|
№ 1-12 пункты б,№ 5 м,№6н
|
Тусупова Гульбаршын Мухамедрахимовна
|
15
|
№ 1-12 пункты в,№ 5 и,№6о
|
Умбеталин Адил Асылбекулы
|
16
|
№ 1-12 пункты г,№ 5 у,№6п
|
Шарипова Эльвира Геннадьевна
|
17
|
№ 1-12 пункты д,№ 5 у,№6р
|
Щипанский Сергей Борисович
|
18
|
№ 1-12 пункты ж,№ 5 ф,№6с
|
Задачи и вопросы к контрольной работе №1 по курсу Общей и неорганической химии
1. Решить задачу. Какую массу кристаллогидрата и воды надо взять для приготовления раствора известной массы с указанной массовой долей в расчете на безводную соль?
|
вещество
|
масса раствора
|
ω, %
|
а)
|
декагидрат карбоната натрия
|
1,5 кг
|
10
|
б)
|
наногидрат сульфида натрия
|
300 г
|
5
|
в)
|
декагидрат сульфата натрия
|
500 г
|
10
|
г)
|
пентагидрат сульфата меди (II)
|
0,5 кг
|
5
|
д)
|
гексагидрат хлорида хрома (III)
|
250 г
|
10
|
е)
|
пентагидрат сульфида калия
|
1,5 кг
|
5
|
ж)
|
гексагидрат хлорида кальция
|
300 г
|
10
|
з)
|
пентагидрат сульфата меди ( II)
|
500 г
|
10
|
и)
|
гексагидрат хлорида стронция
|
500 г
|
5
|
к)
|
наногидрат хлорида алюминия
|
0,5 кг
|
10
|
л)
|
пентагидрат сульфата марганца (II)
|
250 г
|
5
|
м)
|
гептагидрат сульфата железа ( II)
|
400 г
|
10
|
н)
|
декагидрат карбоната натрия
|
300 г
|
6
|
о)
|
пентагидрат хлорида меди ( II)
|
0,5 кг
|
10
|
п)
|
гептагидрат сульфата магния
|
250
|
15
|
р)
|
дигидрат сульфата кальция
|
500 г
|
5
|
с)
|
наногидрат сульфида натрия
|
250 г
|
5
|
т)
|
декагидрат сульфата натрия
|
400 г
|
10
|
|
|
|
 Скачать 0.64 Mb.
Скачать 0.64 Mb.