Лекарственные вещества. реф 1. Производные бензодиазепина
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
https://www.bibliofond.ru/view.aspx?id=581378 ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА Глава 17. Анализ производных пиримидино-тиазола, птеридина, изоаллоксазина, фенотиазина и бензодиазепина По фармакологическому действию препараты этой группы относятся к седативным средствам, т.е. обладают успокаивающим эффектом при минимальном воздействии на двигательные и мыслительные функции. В отличие от нейролептиков они не характеризуются антипсихотической активностью. В медицинской практике бензодиазепины применяются с начала 60-х годов. В основе их химического строения лежит бициклическая система 1,4-бензодиазепина: 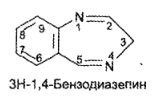 Лекарственные вещества этой группы содержат фенильный радикал при С5 и являются производными 5-фенил-ЗН-1,4-бензодиазепина (хлозепид) и 1,2-дигидро-ЗН-1,4-бензодиазепин-2-она (сибазон, нитразепам, нозепам, феназепам и др.): 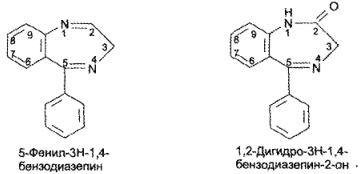 Общие физико-химические свойства лекарственных веществ группы бензодиазепина представлены в табл. 72. 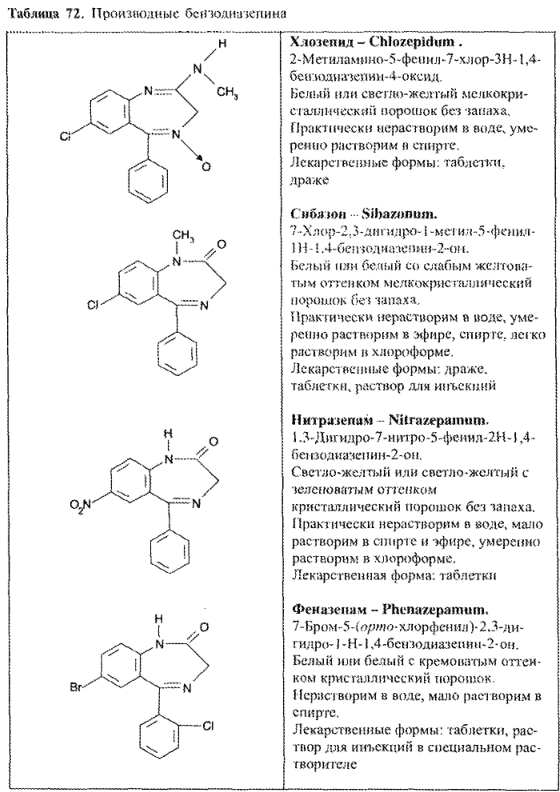 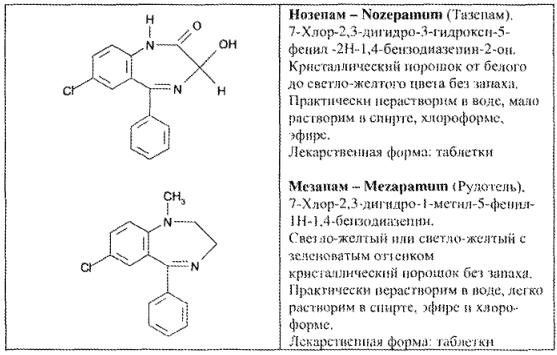 В мировой медицинской практике применяют около 20 препаратов группы 1,4-бензодиазепина, незначительно различающихся по структуре и фармакологическому действию. Продолжаются поиск и внедрение новых лекарств этой группы. Примером могут служить 2 сравнительно новых препарата — алпрозалам и триазолам, имеющие трициклическую структуру, включающую бензодиазепиновый фрагмент: 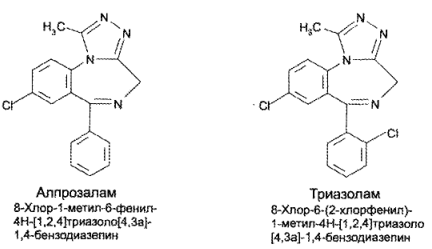  Общие физические свойства Все препараты данной группы имеют окрашивание от слабого желтого до лимонно-желтого. Все они плохо растворимы или практически нерастворимы в воде. Это связано с тем, что бензодиазепины, в молекуле которых содержится азометиновый фрагмент, являются внутренними основаниями Шиффа, для которых характерна гидрофобность. Все препараты имеют определенную Тпл. Общий бензодиазепиновый цикл в сочетании с фенильным радикалом, карбонильной группой и заместителями обусловливает характерность поглощения света в ИК- и УФ-областях спектра. Указанные выше свойства используют для определения подлинности препаратов группы бензодиазепина. Получение Методы синтеза препаратов группы 1,4-бензодиазепина разнообразны. Более простой и часто используемый метод — применение в качестве исходных веществ соответствующих аминобензофенонов. Примером может служить синтез нитразепама: 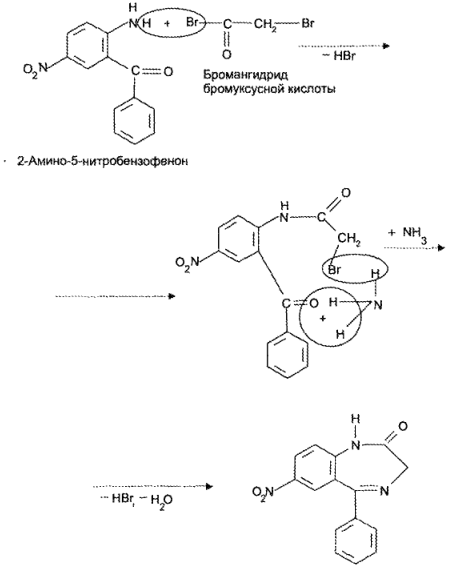 Химические свойства и анализ качества Особенности химического строения лекарственных веществ группы 1,4-бензодиазепина позволяют классифицировать их свойства и реакции следующим образом: кислотно-основные свойства; реакции окисления; гидролитическое расщепление с последующим определением продуктов гидролиза; доказательство ковалентно связанного атома галогена; частные реакции. Кислотно-основные свойства Хлозепид и мезапам обладают выраженными основными свойствами. Нитразепам, феназепам, нозепам являются амфолитами. Основные свойства им придает азометиновый фрагмент, а кислотные — способность к лактим-лактамной и кето-енольной таутомерии, обусловленной подвижностью атома водорода метиленовой группы. Кислотные свойства данных препаратов обусловливают возможность их растворения в щелочах и образования нерастворимых комплексных соединений с солями тяжелых металлов (например, Со2+). Благодаря азометиновой группе (как центру основности) все препараты труппы бензодиазепина растворяются в разбавленных кислотах, образуют осадки с общеалкалоидными реактивами. Некоторые осадки (например, с реактивами Драгендорфа и Майера) имеют характерные формы кристаллов. Реакции окислении Частично гидрированный бензодиазепиновый цикл молекул препаратов данной группы объясняет их легкую способность к окислению в различных условиях. В качестве окислителей используют реактив Марки, калия перманганат и другие реактивы. Феназепам при нагревании с раствором кислоты хлорной образует продукт окисления желто-зеленого цвета с зеленой флюоресценцией. Аккуратное плавление феназепама приводит образованию окрашенного в красно-фиолетовый цвет плава. Гидролитическое расщепление Реакции гидролитического расщепления и определение продуктов гидролиза используют для определения подлинности и количественного определения препаратов труппы бензодиазепина. Жесткое расщепление препаратов при нагревании с кристаллическим гидроксидом натрия в открытом тигле приводит к выделению аммиака (или соответствующего амина). Некоторые препараты (нозепам, феназепам) образуют при таком взаимодействии со щелочью окрашенные плавы из-за проходящего параллельно расщеплению окисления. При кислотном гидролизе разрыву подвергаются и амидная, и азометиновая группы. Образующиеся при этом производные бензофенона окрашены в желтоватый цвет, лучше поглотают свет в УФ-области спектра. При гидролизе деблокируется первичная ароматическая аминогруппа, и далее можно проводить реакцию образования азокрасителя (испытание подлинности или ФЭК) или нигритометрическое количественное определение: 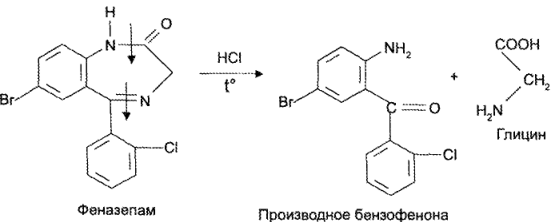 Далее проводят диазотирование раствором натрия нитрита в среде кислоты хлороводородной и азосочетание с р-нафтолом в щелочной среде или N-(1-нафтил)этилендиамином в умеренно кислой среде с образованием азокрасителя: 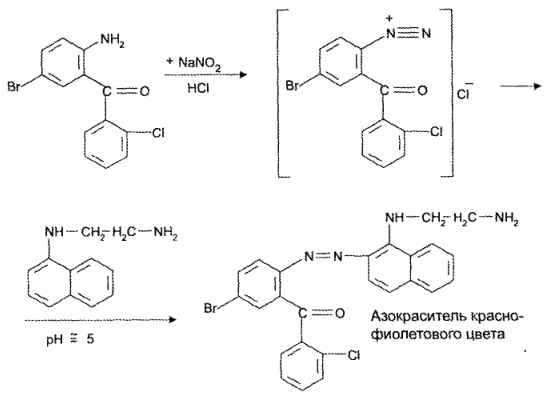 Нитразепам способен также к образованию азокрасителя после восстановления нитрогруппы (подобно левомицетину, нитроксолину). Определение ковалентно-связанных атомов галогенов Определение органически связанных атомов галогенов проводят после минерализации в виде галогенид-ионов реакцией с серебра нитратом. Минерализацию проводят различными способами: сжигание в колбе с кислородом: нагревание с растворами щелочей в присутствии цинка; другие методики. Открыть ковалентно связанный атом галогена можно и пробой Бельштейна. При этом несколько кристалликов препарата на медной проволоке вносят в пламя, которое при этом окрашивается в яркий светло-зеленый цвет. Методы количественного определения Индивидуальные лекарственные вещества группы бензодиазепина количественно определяют методом кислотно-основного титрования в среде уксусного ангидрида или ледяной уксусной кислоты (как однокислотные основания): 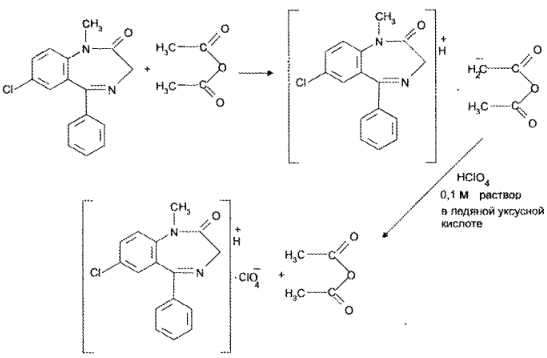 Количественное определение препаратов группы бензодиазепина можно провести методами нитритометрии, Кьельдаля, аргентометрии после минерализации атомов галогенов и сжиганием в колбе с кислородом. Однако перечисленные способы по точности и трудоемкости уступают кислотно-основному титрованию и потому применяются редко. Количественное определение препаратов данной группы в лекарственных формах проводят с помощью различных физико-химических методов (УФ-спектрофотометрия, ФЭК, флуориметрия, ВЭЖХ). Чистота Специфическими примесями препаратов группы бензодиазепина являются соответствующие аминобензофеноны как исходные вещества при синтезе или продукты разложения. Определяют их с помощью ТСХ, УФ-спектрофотометрии и других физико-химических методов. ДИПЛОМНАЯ РАБОТА на тему: Феназепам, производные 1,4-бензодиазепина Выполнила: Алексеева В.Н. Дипломный руководитель: Косивцов Ю.Ю. Тверь 2012 СОДЕРЖАНИЕ Перечень сокращений Введение . Характеристика производных 1,4-бензодиазепина .1 Описание фармакологической группы .2 Классификация анксиолитиков .3 Производные 1,4 - бензодиазепина .4 Физические и физико-химические свойства производных 1,4-бензодиазепина .4.1 Липофильность производных 1,4-бензодиазепина .4.2 Инфракрасные спектры производных 1,4-бензодиазепина .4.3 Ультрафиолетовые спектры производных 1,4-бензодиазепина .4.4 Масс - спектры производных 1,4-бензодиазепина .5 Химические свойства производных 1,4-бензодиазепина .5.1 Кислотно-основные свойства производных 1,4-бензодиазепина .5.2 Реакция диазотирования и гидролиз производных 1,4-бензодиазепина .5.3 Ацилирование производных 1,4-бензодиазепина .5.4 Алкилирование производных 1,4-бензодиазепина .5.5 Окисление производных 1,4-бензодиазепина .5.6 Восстановление производных 1,4-бензодиазепина .5.7 Нитрование производных 1,4-бензодиазепина .5.8 Галогенирование производных 1,4-бензодиазепина .5.9 Замещение атома кислорода на серу в производных 1,4-бензодиазепина .6 Биохимия и механизм действия 1,4-бензодиазепинов .6.1 Механизм действия производных производных 1,4-бензодиазепина .6.2 Связывание 1,4-бензодиазепинов белками крови .6.3 Фармакокинетика производных 1,4-бензодиазепина .7 Показания к применение бензодиазепиновых анксиолитиков .8 Связь между структурой и физиологической активностью 1,4-бензодиазепинов .9 Феназепам .9.1 Препарат «Феназепам» .9.2 Пространственная форма феназепама .9.3 Фармакокинетика феназепама .9.4 Данные о безопасности препарата .9.5 Синтез феназепама . Анализ субстанции феназепама и препарата «Феназепам» .1 Производство препарата «Феназепам» .2 Метод прямого прессования .3 Методики экспериментов .3.1 Анализ субстанции феназепама на содержание основного действующего вещества и других показателей качества .3.2 Методики определения готовой продукции препарата «Феназепама» .4 Результаты и обсуждения .4.1 Анализ субстанции феназепама по основным показателям качества .4.2 Анализ готовой лекарственной формы «Феназепам» по основным показателям качества . Экономическая часть .1 Определение затрат на проведение исследования .2 Материальные затраты .3 Заработная плата исполнителей исследования .4 Амортизационные отчисления .5 Определение единого социального налога .6 Определение накладных расходов .7 Смета затрат на проведение исследований .8 Заключение . Безопасность и экологичность .1 Идентификация опасных и вредных факторов .2 Основные мероприятия и технические средства по обеспечению безопасности .3 Мероприятия по осуществлению безопасности в опасных ситуациях .4 Проектирование установки искусственного освещения для лаборатории .5 Оценка экологичности проекта Заключение Список использованных источников ПЕРЕЧЕНЬ СОКРАЩЕНИЙ В настоящей дипломной работе использованы следующие сокращения: НТД - нормативно-техническая документация ГОСТ - государственный общесоюзный стандарт ГФ - государственная фармакопея ОКК - отдел контроля качества ФС - фармакопейная статья ФСП - фармакопейная статья предприятия ПДК - предельно допустимая концентрация СОВС - стандартный образец вещества свидетеля РСО - рабочий стандартный образец ЦНС - центральная нервная система ГАМК - γ-аминомасляная кислота ГЭБ - гематоэнцефалический барьер ВВЕДЕНИЕ Первые современные психотропные препараты были созданы в начале 50-х годов ХХ века. Этот набор средств, применяемых для лечения психических заболеваний, был весьма ограниченным и малоспецифичным. Транквилизаторы первого поколения (бенактизин, мепробамат и др.) с начала 60-х годов XX в начали вытесняться более эффективными препаратами ряда 1,4-бензодиазепинов. Сейчас хлордиазепоксид (либриум, элениум,) диазепам (валиум, седуксен), оксазепам (адумбран, тазепам), нитразепа (могадон, эуноктин). клоназепам, лоразепам, феназепам и другие производные 1,4-бензодиазепина занимают ведущее положение в арсенале транквилизирующих средств. Более того, за сравнительно короткий срок препараты 1,4-бензодиазепинового ряда во многих странах мира стали одними из самых распространенных лекарственных средств. По числу выписываемых на них рецептов 1,4-бензодиазепииовые транквилизаторы занимают сейчас второе место после аспирина среди всех лекарственных препаратов. Большим достижением отечественных ученых было создание оригинального мощного транквилизатора бензодиазепинового ряда - «Феназепама». Этот транквилизатор, содержащий в своей структуре бром, обнаружил в клинике широкий спектр успокаивающего, снотворного и противосудорожного действия. Он очень широко внедрился в современную клиническую практику не только психиатров, но и врачей всех специальностей. Распространение транквилизаторов объясняется весьма широкой сферой их использования не только при лечении нервно-психических расстройств, но и в хирургии, акушерстве, гинекологии, педиатрии и других областях медицины в качестве вспомогательных средств. Сегодня группа транквилизаторов насчитывает более 100 препаратов. Продолжается их активный поиск и совершенствование - разработка препаратов с наименее выраженными побочными действиями и в то же время достаточно эффективных. Только в наиболее популярном ряду производных 1,4-бензодиазепина, благодаря легкой замещаемости радикалов по различным положениям в молекуле, было синтезировано свыше 3 тысяч соединений, из которых более 40 используются в клинической практике. Введение более жестких норм показателей качества таблетированных препаратов настоятельно требует постоянного поиска надлежащего качества действующих веществ, более эффективных и многофункциональных вспомогательных ингредиентов, а также внедрения в производство лекарственных средств новейших технологий и современного оборудования. При этом качественные и количественные изменения в составе вспомогательных веществ лекарственной формы могут существенно изменить растворимость и кинетику растворения, биодоступность лекарства (липофильность), его концентрацию в крови и длительность действия. Кроме того определение примесей в фармацевтических препаратах является также важной и актуальной задачей, так как состав примесей определяет качество продукта и позволяет судить о производителе продукции и ее фальсификации. Необходимо отметить, что в ряде случаев примеси, присутствующие в препарате в следовых концентрациях, по своей токсичности намного превосходят токсичность основного компонента. Целью данной дипломной работы является анализ действующего вещества в сырье (субстанции) феназепама и в препарате «Феназепам», контроль на производстве «Феназепам» таблеток (входной контроль субстанций, промежуточный контроль на производстве и контроль готовой продукции), а так же использование теста «Растворение» для оценки фармацевтической эквивалентности таблетизированных лекарственных форм феназепама изготовленных по разной технологии. Для достижения этой цели ставились следующие задачи: 1) изучение химической природы, биологической и физиологической роли основного вещества, содержащейся в препарате «Феназепам»; 2) освоение методов и методик качественного и количественного анализа основного действующего вещества; 3) физико-химическое исследование, а так же установление основных показателей качества согласно ФС; ) проведение сравнительной оценки фармацевтической доступности таблетизированной формы феназепама с препаратом сравнения (таблетки, полученные методом прямого прессования из размолотой субстанции); ) заключение о пригодности данного препарата в клинической практике. 1. ХАРАКТЕРИСТИКА ПРОИЗВОДНЫХ 1,4-БЕНЗОДИАЗЕПИНА 1.1 Описание фармакологической группы Анксиолитики (от лат. anxietas - тревожное состояние, страх; греч. lytikos - способный растворять, ослабляющий), или транквилизаторы (от лат. tranquillo - успокаивать), или атарактики (от греч. ataraxia - невозмутимость) - психотропные средства, уменьшающие выраженность или подавляющие тревогу, страх, беспокойство, эмоциональное напряжение. Появление первых транквилизаторов относится к 50-м годам XX века. До этого для коррекции тревожных состояний использовались алкоголь, опиум, бромиды (с начала XIX в.), барбитураты (с начала XX в.) и другие средства. Исторически можно выделить 3 поколения анксиолитиков: анксиолитики первого поколения (мепробамат, гидроксизин, бенактизин и др.); анксиолитики второго поколения (препараты бензодиазепинового ряда); анксиолитики третьего поколения (буспирон и др.) [1]. 1.2 Классификация анксиолитиков Существует несколько классификаций лекарственных средств, относящихся к группе анксиолитиков: по химической структуре, механизму действия, фармакокинетическим и фармакодинамическим особенностям. По классификации М.Д. Машковского анксиолитики представлены несколькими классами химических соединений: производные бензодиазепина (бензодиазепины); карбаминовые эфиры замещенного пропандиола (мепробамат); производные дифенилметана (бенактизин, гидроксизин); транквилизаторы разных химических групп (бензоклидин, буспирон, мебикар и др.). Согласно классификации Д.А. Харкевича, по механизму действия анксиолитики можно разделить на следующие группы: агонисты бензодиазепиновых рецепторов (диазепам, феназепам и др.); агонисты серотониновых рецепторов (буспирон); вещества разного типа действия (бенактизин и др.) [2]. 1.3 Производные 1,4 - бензодиазепина Большинство анксиолитиков бензодиазепиновой структуры являются производными 1,4-бензодиазепина (рисунок 1.1, 1.2). Основа химической структуры бензодиазепинов состоит из бензольного кольца, соединенного с семичленным гетероциклическим кольцом, содержащим два атома азота (диазепин) в позициях 1 и 4. Все используемые в клинике производные бензодиазепина имеют также второе бензольное кольцо, присоединенное к углероду в позиции 5. Для проявления активности существенным является наличие галогена или нитрогруппы в 7 положении. Некоторые соединения группы бензодиазепинов содержат в молекуле остаток 1,5-бензодиазепина (клобазам) или 2,3-бензодиазепина (тофизопам) [3]. Рисунок 1.1 - 3Н-1,4-Бензодиазепин Рисунок 1.2 - 1Н-1,4-Бензодиазепин В структуре производных бензодиазепина имеется азометиновая группа - атом углерода C5 соединенный с атомом азота N4 двойной связью. В соответствии с заместителями в диазепиновом кольце бензодиазепины можно классифицировать следующим образом: 2-кето-бензодиазепины содержат кето-группу при атоме углерода в позиции 2 (диазепам, дикалия клоразепат, флуразепам и др.); 3-гидрокси-бензодиазепины содержат гидрокси-группу при атоме углерода в позиции 3 (оксазепам, лоразепам, темазепам); триазолобензодиазепины содержат триазоловое кольцо, соединенное с диазепиновым кольцом через атом азота в положении 1 и атом углерода в положении 2 (алпразолам, триазолам, эстазолам) [2,3]. Возможно наличие и других дополнительных заместителей в структуре бензодиазепина, например, имидазо-группа (мидазолам) и др. В таблице 1.1 приведены некоторые представители производных 1,4-бензодиазепина. Таблица 1.1 Производные 1,4-бензодиазепина Название Структурная формула Хлозепид (Chlozepidune) 7-хлор-2-метиламино-5-фенил-3Н-1,4-бензодиазепила-4-оксид Диазепам (Diazepam) 7-хлор-1,3-дигидро-1-метил-5-фенил-3Н-1,4-бензодиазепин-2-он Феназепам (Penazepanum) 7-бром-5-(орто-хлорфенил)-2,3-дигидро-1Н-1,4-бензодиазетин-2-он Оксазепам (Oxazepamum) 7-хлор-2,3-дигидро-3-окси-5-фенил-1Н-1,4-бензодиазепин-2-он Лоразепам (Lorazepam) 7-хлор-5-(орто-хлорофенил)-2,3-дигидро-3-окси-1Н-1,4-бензодиазепин-2-он Мезапам (Mezapamum) 7-хлор-2,3-дигидро-1-метил-5-фенил-1Н-1,4-бензодиазепин Гидазепам (Gidazepamum) 7-бром-1-(гидразинокарбонил)-метил-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепина-2-он В связи с легкой замещаемостью радикалов по различным положениям в молекуле бензодиазепина было синтезировано и исследовано более 3 тысяч соединений, из которых несколько десятков зарегистрированы в различных странах в качестве лекарственных средств [3]. .4 Физические и физико-химические свойства производных 1,4-бензодиазепина .4.1 Липофильность производных 1,4-бензодиазепина Коэффициенты распределения Р в системе вода - несмешивающийся в ней растворитель биологически активных веществ в определенной степени характеризуют способность последних проникать через биомембраны. Данные характеристики в сочетании с другими физико - химическими параметрами широко используются для установления связи между структурой и биологической активностью веществ и для математического прогнозирования активности новых соединений. На рисунке 1.3 представлена общая формула производных 1,4-бензодиазепина. Рисунок 1.3 - Общая формула производных 1,4-бензодиазепина Коэффициенты распределения 1,2-дигидро-3Н-1,4-бензодиазепинов-2-онов определялись в системе н-октанол - фосфатный буфер (рН = 7.4) и представлены в таблице 1.2. Таблица 1.2 Величина lg P 1,2 - дигидро-3Н-1,4-бензодиазепинов-2-онов Номер соединения R1 R2 R3 R4 lg P 1 H C6H5 - H 2.28±0.01 2 CH3 C6H5 - H 2.71±0.01 3 Cl C6H5 - H 2.93±0.01 4 Br C6H5 - H 3.11±0.01 5 NO2 C6H5 - H 2.16±0.01 6 Br о-ClC6H4 - H 3.30±0.01 7 Br м-ClC6H4 - H 3.63±0.01 8 Br п-ClC6H4 - H 3.78±0.01 Из таблицы видно, что феназепам (соединение номер 6) имеют одно из наибольших значений lg P, что говорит о его высокой способности проникать через биомембраны. Для некоторых групп и радикалов были найдены константы π - константа гидрофобности заместителя, значение которых представлены в таблице 1.3 [3,4]. Таблица 1.3 Константы π радикалов и групп Радикал или группа π Радикал или группа π CH3 (в положении 7) 0.42±0.01 o-Cl 0.19 CH3 (в положении 3) 0.32 Br 0.81±0.01 C2H5 0.71±0.01 NO2 -0.12 C3H7 1.21 COCH3 -0.34±0.01 изо- C3H7 1.07±0.01 OH -0.73 СН2 0.39±0.01 ON→O -1.58 Cl 0.63±0.01 NH2 -0.74 .4.2 Инфракрасные спектры производных 1,4-бензодиазепина Легко интерпретируемые спектры получаются при работе с растворами в четыреххлористом углероде. Однако низкая растворимость в нем многих бензодиазепинов не всегда позволяет получать такие спектры. Спектры кристаллических образцов 1,4 - бензодиазепинов, как правило, сложнее вследствие межмолекулярных взаимодействий. В них достоверное отнесение можно сделать только для некоторых характеристических полос. В качестве примера можно описать ИК - спектры соединений, изображенных на рисунке 1.4. аб вг Рисунок 1.4 - Производные 1,2-дигидро-3Н-1,4-бензодиазепина: -хлор-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепин-2-он (а); 7-хлор-5-фенил-1,2,3,4-тетрагидробензодиазепин-2-он (б); 7-хлор-1-метил-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепин-2-он (в); 7-хлор-1-метил-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепин (г) На рисунке 1.5 представлены ИК-спектры этих соединений. Спектры этих соединений содержат полосу поглощения двойной связи С5=N4 в области 1600 - 1620 см-1. Правильность отнесения этой полосы подтверждается ее отсутствием в спектре соединения (б). Наиболее интенсивная полоса поглощения в спектрах 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов, располагающаяся в области 1690 - 1700 см-1, соответствует валентным колебаниям связи С=О. В спектрах наблюдаются полосы поглощения свободной и связанной NH - группы. Наиболее интенсивная из полос (в области около 3180 см-1) отвечает колебаниям связи амидной группы, имеющей S-цис-конфигурацию. Рисунок 1.5 - ИК-спектры: -хлор-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепин-2-он (а); -хлор-5-фенил-1,2,3,4-тетрагидробензодиазепин-2-он (б); -хлор-1-метил-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепин-2-он (в); -хлор-1-метил-5-фенил-1,2-дигидро-3Н-1,4-бензодиазепин (г) в четыреххлористом углероде Интенсивная полоса в области около 1320 см-1 может быть отнесена к валентным колебаниям связи С-N третичного амина. В спектре тетрагидробензодиазепина эта полоса отсутствует. Серия полос в интервале волновых чисел 1300 - 900 см-1, вероятно, отвечает деформационным колебаниям связей С-Н бензольных колец (1300 - 1000 см-1 - плоскостные колебания, 1000 - 900 см-1 - внеплоскостные колебания) [4-6]. .4.3 Ультрафиолетовые спектры производных 1,4-бензодиазепина В электронных спектрах 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов обычно имеется три полосы поглощения с максимумами при 200 - 215, 220 - 240 и 290 - 330 нм. Две первые полосы соответствуют возбуждению ароматических хлороформов. Третью - длинноволновую - полосу относят к азометиновой связи, сопряженной с бензогруппой [4,6]. На рисунке 1.6 представлен УФ-спектр феназепама. Рисунок 1.6 - УФ-спектр феназепама .4.4 Масс - спектры производных 1,4-бензодиазепина Значение метода масс - спектрометрии не ограничивается доказательством структуры новых соединений. Особую ценность метод приобретает в исследования биотрансформации (метаболизма) препаратов. Основные пути распада 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов под электронным ударом представлены на рисунке 1.7. Элиминирование водорода от молекулярного ион-радикала происходит в основном (примерно на 70%) из орто-положения арильного заместителя у атома С5. Отщепление радикала H2CN от молекулярного ион-радикала приводит к ионам «F2», дающим в спектрах весьма интенсивные пики. В случае когда R3≠H, наблюдается элиминирование радикала R3HCN. Дальнейший распад ионов «F1» и «F2» сопровождается отщеплением окиси углерода и атома водорода. Элиминирование молекулярными ионами молекулы HCN имеет место при фрагментации бензодиазепинов с электроакцепторными заместителями в положении 7. Несмотря на то что 1,2-дигидро-3Н-1,4-бензодиазепины-2-оны и 1,2-дигидро-3Н-1,4-бензодиазепин-2-тионы весьма близки по структуре, в характере их фрагментации под электронным ударом имеются существенные различия. Характерные для бензодиазепинтионов пути распада заключаются в элиминировании молекулярным ион-радикалом атома водорода, потере радикала ∙SH молекулярными и [M-H]+ ионами, отщеплении HCN. Особенности распада бензодиазепинтионов, очевидно, связаны с лактам-лактимной таутомерией молекулярных ионов. Особенностью распада 5-(галогено)фенил-1,2-дигидро-3Н-1,4-бензодиазепин-2-онов является элиминирование радикала галогена молекулярными ион-радикалами, приводящее к образованию ионов «F8», «F9», «F10» наряду с обычными для бензодиазепинов ионами, сохраняющими атомы галогенов в фенильном ядре [4,7]. Рисунок 1.7 - Схема основных путей распада 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов под электронным ударом .5 Химические свойства производных 1,4-бензодиазепина .5.1 Кислотно-основные свойства производных 1,4-бензодиазепина ,4-Бензодиазепины и их дигидропроизводные проявляют слабоосновные свойства (гетероатом азота N4). При введении в ядро 1,4-бензодиазепинов карбонильных и оксигрупп основность их снижается. Феназепам, например, в среде метилэтилкетона ведет себя как слабое однокислотное основание. Основность азота в азометиновой группе сильно снижается за счет сопряжения с кольцом бензола при С5. Присоединение протона при взаимодействии с кислотой происходит за счет гетероатома азота N4. Исключение составляет хлозепид, у которого положительный заряд при присоединении протона распределяется по триаде, между гетероатомом азота N1 и атомом азота метиламиногруппы N2. Слабоосновные свойства бензодиазепинов лежат в основе их количественного определения методом кислотно-основного титрования в не водных средах. Основность соединений данного типа увеличивается при наличии основных заместителей. При введении в ядро 1,4-бензодиазепинов карбонильных, окси- и карбоксильных групп основность соединений снижается. Бензодиазепины как азотсодержащие основания могут давать реакции с осадочными реактивами. Например, сибазон образует розовый осадок с аммония рейнекатом в кислой среде. ,05 г препарата сибазона растворяют в 2 мл разведенной кислоты хлороводородной, прибавляют 2 мл раствора аммония рейнеката. Образуется розовый осадок, растворимый в ацетоне (рисунок 1.8). Рисунок 1.8 - Реакция сибазона с аммония рейнекатом в кислой среде С концентрированными кислотами (серной, хлороводородной, хлорной) 1,4-бензодиазепины образуют окрашенные соли, которые флюоресцируют в УФ-свете. Это испытание используется для идентификации препаратов. К 1 мл раствора феназепама 3% для инъекций прибавляют 3 капли концентрированной кислоты серной и перемешивают. Раствор окрашивается в желтый цвет. В УФ-свете раствор дает ярко-зеленую флюоресценцию. С концентрированной кислотой серной сибазон дает в УФ-свете зеленовато-голубую флюоресценцию, нитразепам - голубую флюоресценцию. Соединения с лактамной группой (рисунок 1.9) проявляют слабокислотные свойства, образуя соли при действии сильных оснований. Рисунок 1.9 - Лактамная группа Наряду со слабоосновными свойствами сибазон, нозепам и нитразепам проявляют и слабокислотные свойства; они реагируют с сильными основаниями, например с диметилформамидом, образуя соответствующие анионы. Так, сибазон (слабая СН-кислота) и нозепам (слабая NH-кислота) образуют соответствующие депротонированные соединения (анионы) - рисунок 1.10 [4,6]. Рисунок 1.10 - Депротонированный нозепам .5.2 Реакция диазотирования и гидролиз производных 1,4-бензодиазепина Реакция диазотирования лежит в основе нитритометрического метода количественного определения производных данной группы, образование азокрасителя используется для их идентификации и фотоколориметрического количественного определения. ,02 г феназепама нагревают до кипения с 2 мл разведенной кислоты хлороводородной в течение 3 минут и охлаждают. Полученный раствор дает характерную реакцию на первичные ароматические амины. В качестве азосоставляющей применяют фенолы в щелочной среде: резорцин (рисунок 1.11), β-нафтол (рисунок 1.12) или ароматические амины в кислой среде (красная окраска). Рисунок 1.11 - Реакция диазотирования феназепама с резоцином (красное окрашивание) Рисунок 1.12 - Реакция диазотирования феназепама с β-нафтолом (оранжево-красный осадок) Соль диазония, полученную из нитразепама, сочетают в кислой среде с N-1-нафтилэтилендиамином; образуется азокраситель красного цвета (рисунок 1.13) [4,7]. Рисунок 1.13 - Образование азокрасителя из нитрозепама При нагревании нитразепама с цинковой пылью в кислой среде, кроме гидролитического разложения, происходит восстановление ароматической нитрогруппы до аминогруппы с образованием 2,5-диаминобензофенона (рисунок 1.14), который дает реакции диазотирования и азосочетания по обеим аминогруппам. Рисунок 1.14 - 2,5-Диаминобензофенон Несколько иначе протекает кислотный гидролиз хлозепида. 0,05 г хлозепида нагревают до кипения с разведенной кислотой хлороводородной в течение 2 мин и охлаждают. Вначале происходит присоединение воды по двойной связи 1-2, затем отщепление метиламина и образование амидной связи, а далее - гидролиз лактамной (амидной) связи (рисунок 15) [4]. Полученный раствор дает характерную реакцию на первичные ароматические амины с образованием оранжево-красного осадка. Сибазон не дает реакции образования азокрасителя, так как при кислотном гидролизе образуется вторичная ароматическая аминогруппа. Рисунок 15 - Схема гидролиза хлозепида При щелочном гидролизе в жестких условиях (сплавление с натрия гидроксидом или кипячение с раствором щелочи) из амидной группы бензодиазепинов образуется аммиак или метиламин (сибазон), окрашивающие влажную красную лакмусовую бумагу в синий цвет. При этом нозепам образует на стенках пробирки налет изумрудно-зеленого цвета. Реакция сплавления со щелочью используется для идентификации 1,2-дигидро-ЗН-1,4-бензодиазепин-2-онов [7]. .5.3 Ацилирование производных 1,4-бензодиазепина При ацилировании 3Н-1,4-бензодиазепинов в зависимости от их структуры условий реакции получаются различные продукты. Ацилирование хлордиазепоксида (рисунок 1.15) уксусным ангидридом при комнатной температуре приводит к N-ацетильному производному (I). При действии горячего уксусного ангидрида или ацетилхлорида в диметилформамиде образуется продукт перегруппировки Полоновского (II). Продолжительное нагревание хлордиазепоксида с уксусным ангидридом дает продукт N-ацетилирования и перегруппировки (III) [4,7]. Рисунок 1.15- Схема ацилирования хлордиазепоксида .5.4 Алкилирование производных 1,4-бензодиазепина ,4-Бензодиазепины алкилируются по положениям 1 и 4, а иногда по положению 3 (рисунок 1.16). Кроме того, реакцией алкилирования различные группы можно ввести в качестве заместителей в уже имеющиеся заместители. Чаще всего алкилирование проводят в присутствии оснований (NaОH, NH2Na, CH3ONa, щелочи и т.д.) [4,8]. Рисунок 1.16- Алкилирование производных 1,4-бензодиазепина .5.5 Окисление производных 1,4-бензодиазепина -Окси-1,2-дигидро-3Н-1,4-бензодиазепины окисляется хромовым ангидридом. Четырехокись рутения окисляет 2-окси-1,2-дигидро-3Н-1,4-бензодиазепин-2-оны до нестабильных α-дикарбонильных производных (рисунок 1.17). Рисунок 1.17- Окисление 2-окси-1,2-дигидро-3Н-1,4-бензодиазепина Озонирование 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов, незамещенных в положении 5, приводит к 2,5-дионам (рисунок 1.18) [4,9]. Рисунок 1.18- Озонирование 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов .5.6 Восстановление производных 1,4-бензодиазепина Разработанные методы гидрирования соединений данного класса позволяют проводить селективное восстановление того или иного фрагмента молекулы. N-окиси 1,4-бензодиазепинов восстанавливаются до соответствующих дезоксидных производных треххлористым фосфором, водородом в присутствии никеля или железным порошком в среде уксусной кислоты. Так же может восстанавливаться и соседняя азометиновая связь (рисунок 1.19). Рисунок 1.19- Восстановление N-окиси 1,4-бензодиазепинов Хлордиазепоксид по-разному восстанавливается водородом на палладиевом и платиновом катализаторах: в первом случае восстановление идет с элиминированием атома хлора из положения 7 и атома кислорода аминооксидной группы, во втором - восстанавливается аминооксидная группа и примыкающая к ней азометиновая связь (рисунок 1.20). Рисунок 1.20- Восстановление хлордиазепоксида на платиновом и палладиевом катализаторах Несколько иные различия отмечены при восстановлении на палладиевом и платиновом катализаторах соединения с заместителями R1 = Cl, R2 = C6H5, R3=H Если на палладиевом катализаторе, как и при восстановлении хлордиазепоксида, элиминируется атом хлора и атом кислорода из положения 7 и 4 соответственно, то гидрогенизация на платине данной N-окиси приводит к 4-окситетрагидро-1,4-бензодиазепин-2-ону (рисунок 1.21). Рисунок 1.21- Восстановление соединения с заместителями R1 = Cl, R2 = C6H5, R3 = H на палладиевом и платиновом катализаторах ,2-Дигидро-3Н-1,4-бензодиазепин-2-оны и 3,4-дигидро-5Н-1,4-бензодиазепин-5-оны гидрируются водородом на платине по азометиновым связям (рисунок 1.22) [4,7,9]. Рисунок 1.22- Восстановление на платиновом катализаторе 1,2-дигидро-3Н-1,4-бензодиазепин-2-она .5.7 Нитрование производных 1,4-бензодиазепина При нитровании 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов положение вступающей в ароматическое ядро нитрогруппы определяется ориентирующим влиянием отдельных фрагментов молекул веществ. Бензодиазепины при R1=H нитрируются в положение 7, что согласуется с пара-ориентирующим влиянием амидного фрагмента диазепинового ряда. При наличии в положении 7 заместителя (Cl или NO2) нитрогруппа вступает в мета-положение кольца С, что также объясняется с позиций общих представлений об ориентирующем влиянии заместителей и групп. При дальнейшем нитровании вторая нитрогруппа, как и следовало ожидать, вступает в положение 9 (рисунок 1.23). При действии дымящей азотной кислоты на бензодиазепины в среде уксусного ангидрида получаются 4-нитро-5-ацетилокси-1,2,3,4-тетрагидро-1,4-бензодиазепин-2-оны (рисунок 1.24) [4,9]. Рисунок 1.24- Нитрование дымящей азотной кислотой производных 1,4-бензодиазепина .5.8 Галогенирование производных 1,4-бензодиазепина Атом хлора может быть введен в 1,4-бензодиазепины реакцией электрофильного и радикального замещений. 7-хлор-1,2-дигидро-3Н-1,4-бензодиазепин-2-оны образуются при действии хлора в присутствии хлорного железа на бензодиазепины в нитробензоле либо взаимодействием этих же веществ с N-хлорсукцинимидом (NCS) в среде метиленхлорида. Действие органических или минеральных гипохлоритов приводит к 1-хлор-1,2-дигидро-3Н-1,4-бензодиазепин-2-онам (рисунок 1.25). Подвижный атом хлора в соединениях легко мигрирует по внутримолекулярному механизму, замещая атомы водорода у α-углеродного атома заместителя R2. Рисунок 1.25- Галогенирование производных 1,4 -бензодиазепина Атомы хлора или брома могут быть введены в положение 3 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов действием N-хлор- или N-бромсукцинимидом. 3-хлорбензодиазепины получаются также при действии на 3-окси-1,2-дигидро-3Н-1,4-бензодиазепин-2оны хлористого тионила (рисунок 1.26). Рисунок 1.26 - Галогенирование 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов в положение 3 -Галоген-1,4-бензодиазепины образуются при бромировании тетрагидро-1,4-бензодиазепинов (рисунок 1.27), а так же замещением карбонильного атома кислорода в дионах (рисунок 1.28) [4,7,9]. Рисунок 1.27 - Бромирование тетрагидро-1,4-бензодиазепинов Рисунок 1.28- Замещение карбонильного атома кислорода в дионах .5.9 Замещение атома кислорода на серу в производных 1,4-бензодиазепина При кипячении 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов с пятисернистым фосфором в пиридине образуется соединение изображенное на рисунке 1.29. Рисунок 1.29 - Реакция 1,2-дигидро-3Н-1,4-бензодиазепин-2-онов с пятисернистым фосфором Реакции нуклеофильного присоединения по связи С=S позволяют получать разнообразные 2-замещенные 1,4-бензодиазепинов. Некоторые из этих превращений представлены на рисунке 1.30 [4,9]. Рисунок 1.30- Реакции нуклеофильного присоединения по связи С=S производных 1,4-бензодиазепина 1.6 Биохимия и механизм действия 1,4-бензодиазепинов Фармакологическая активность бензодиазепинов зависит от многих факторов, таких, как метаболизм, всасывание, распределение, выделение из организма и связывание с белками крови. Все это является главным звеном проблемы молекулярно-биологического поиска, направленного синтеза и изучения механизма действия данной группы лекарственных средств. Полученные результаты и обобщения служат основой, на которой строится и развивается научная и рациональная фармакотерапия заболеваний и фармакопрофилактика [4,5]. .6.1 Механизм действия производных производных 1,4-бензодиазепина Электрофизиологические исследования, проведенные в 60-70-е гг. XX в., показали, что бензодиазепины усиливают ГАМКергическую передачу в ЦНС (центральная нервная система). Механизм действия бензодиазепинов стал понятен после того, как в 1977 г. с помощью радиолигандного метода в головном мозге человека и животных были обнаружены места специфического связывания бензодиазепинов, так называемые бензодиазепиновые рецепторы (БД-рецепторы). В дальнейшем в экспериментах in vitro и in vivo была выявлена корреляция между способностью различных бензодиазепинов связываться с этими участками и их фармакологической активностью. Методами авторадиографии и электронной микроскопии было показано, что БД-рецепторы локализованы главным образом в синапсах ЦНС, преимущественно на постсинаптических мембранах. Показана гетерогенность БД-рецепторов, которые представлены в мозге млекопитающих по крайней мере двумя подтипами - БД1 и БД2. После обнаружения мест специфического связывания бензодиазепинов начался поиск эндогенных соединений, взаимодействующих с БД-рецепторами, так называемых эндогенных лигандов. В качестве эндогенных лигандов БД-рецепторов рассматривается большое количество соединений: пептиды, пурины, никотинамид, гипоксантин, бета-карболины, ингибитор связывания диазепама (DBI) и др., однако окончательно природа эндогенного лиганда БД-рецепторов не выяснена. В настоящее время считается, что бензодиазепины взаимодействуют со специфическими бензодиазепиновыми рецепторами (являются агонистами этих рецепторов), входящими в состав постсинаптического ГАМКА-рецепторного комплекса в лимбической системе мозга, таламусе, гипоталамусе, восходящей активирующей ретикулярной формации ствола мозга и вставочных нейронах боковых рогов спинного мозга. Бензодиазепины повышают чувствительность ГАМК-рецепторов к медиатору (ГАМК), что обусловливает повышение частоты открытия в цитоплазматической мембране нейронов каналов для входящих токов ионов хлора. В результате происходит усиление тормозного влияния ГАМК и угнетение межнейронной передачи в соответствующих отделах ЦНС [2]. Бензодиазепины обладают широким спектром фармакологического действия, включающим анксиолитическое, седативное, снотворное, миорелаксирующее, противосудорожное, амнестическое и др. По особенностям клинического действия бензодиазепиновые анксиолитики можно разделить на 3 группы: ) бензодиазепины с преобладанием анксиолитического действия (влияние на миндалевидный комплекс лимбической системы); ) бензодиазепины с преобладанием снотворного действия (влияние на ретикулярную формацию ствола головного мозга и неспецифические ядра таламуса, гипоталамуса); ) бензодиазепины с преобладанием противосудорожного действия (влияние на гиппокамп). Выраженным анксиолитическим действием обладают феназепам (по анксиолитической активности превосходит многие бензодиазепины, в том числе диазепам), диазепам, лоразепам, алпразолам и др. Умеренно выражено анксиолитическое действие у хлордиазепоксида, бромазепама, гидазепама, клобазама, оксазепама и др. Седативно-гипнотический эффект особенно выражен у нитразепама, флунитразепама, флуразепама, темазепама, триазолама, мидазолама, эстазолама и др. и они используются в основном как снотворные средства. Противосудорожные свойства характерны для клоназепама, диазепама, а также (в меньшей степени) для нитразепама. Миорелаксирующая активность характерна для диазепама, хлордиазепоксида, лоразепама, тетразепама и др. Для некоторых анксиолитиков характерно выраженное анксиолитическое действие при относительно слабом миорелаксирующем и снотворном (тофизопам, медазепам и др.), в связи с чем они более удобны для применения в дневные часы (так называемые дневные транквилизаторы) [3,5]. .6.2 Связывание 1,4-бензодиазепинов белками крови Биологическое действие 1,4-бенздиазепинов, как и других лекарственных средств, определяется физико-химическим взаимодействием вещества со специфическими молекулярными комплексами в организме, названными рецепторами. Продолжительность и интенсивность действия лекарства определяется действующей концентрацией препарата в биофазе, то есть в той микросреде, где осуществляется непосредственный его контакт с рецептором. Уровень действующей концентрации находится в прямой зависимости от диффузии препарата в плазму крови. Однако общее количество лекарства в плазме не всегда пропорционально интенсивности его действия, так как значительная часть его может взаимодействовать (связываться) с белками крови. Такое взаимодействие лимитирует нахождение соединения в кровяном русле и регулируют такие важные процессы, как метаболизм и распределение препарата в органах и тканях экспериментальных животных и человека. Только не связанный с белком препарат может взаимодействовать с рецептором. Связывание лекарственных средств в плазме крови осуществляется преимущественно альбуминовой фракцией, составляющей 5% ее состава. Наиболее изученными и часто применяемыми для исследований взаимодействия макромолекул с эндогенными и энзогенными веществами являются бычий (БСА) и человеческий (ЧСА) сывороточные альбумины. Взаимодействие между альбумином и лекарствами осуществляется за счет действия межмолекулярных сил, которые проявляются в изменении некоторых физических и физико-химических свойств молекул, образующих комплекс. Величина энергии связи комплекса не превышает 8-10 ккал/моль, что указывает на существование слабых связей между макромолекулами и лекарствами. К таким связям относятся водородные, гидрофобные и ионные (рисунок 1.31). Рисунок 1.31- Связи, стабилизирующие комплекс белок-лекарство: 1 - ионная; 2 - водородная; 3 - ковалентная связи (дисульфидный мостик); 4,5 - некоторые типы вандервальсовых взаимодействий Водородная связь образуется между полярными группами белка (- ОН, =NH и =NH+) и неподеленной электронной парой электроотрицательных элементов (N, О, S, Р) лекарств, если существуют достаточно благоприятные стерические условия. Это весьма прочная связь, поэтому для ее возникновения не требуется тесного соприкосновения между белками и лекарственными веществами. Она возникает только в том случае, если участвующий в ее образовании атом располагается на одной прямой с группой -ОН или -NH и на определенном расстоянии от нее. Прочность водородной связи зависит от степени протонизации атома водорода и донорных свойств атома лекарства. Сывороточный альбумин и некоторые лекарственные средства, имеющие полярные группы, при взаимодействии образуют гидрофобные связи, которые обеспечивают создание комплекса, характеризующегося высокой стабильностью. Важнейшая особенность гидрофобной связи состоит в том, что боковые алкильные группы взаимодействуют с другой такой же группой и не взаимодействуют с водой. При взаимодействии альбумина и лекарства гидрофобные связи начинают играть заметную роль в тех случаях, когда атомные массы пар реагирующих атомов достигают величин 12-16. При взаимодействии ароматических колец (рисунок 1.31) гидрофобная связь дополняется переносом электронов. Это обусловлено тем, что в молекулах с двумя или более сопряженными двойными связями часть электронов оказывается делокализованной и образует π-электронное облако, охватывающее всю систему сопряженных связей. В результате дальнейшей делокализации в π-электронном облаке может создаваться дефицит или избыток π-электронов. Соединения с большим дефицитом π-электронов (нитробензол, пиридин) способны образовывать непрочные комплексы с молекулой, содержащей избыток π-электронов. В такой системе происходит почти такой же свободный обмен электронами, как между двумя конденсированными кольцами в одной и той же молекуле. Следует также указать, что взаимная ориентировка, число вступивших в контакт неполярных групп, их величина и форма связей зависит от конформации молекулы белка и лекарства. Ионные связи возникают между ионами, несущими разноименные заряды. Наряду с ионным между атомами существует также взаимодействие за счет короткодействующих сил, поэтому связь оказывается более прочной. Например, катионы всех аминов, за исключением четвертичных, образуют с анионами карбоновых кислот одновременно и водородные связи. Далее две молекулы могут быть связаны друг с другом ионными силами в одной точке и гидрофобными - в другой. При этом значительно возрастают прочность связи и время ее существования. Ковалентные связи лишь в редких случаях принимают участие в образовании связи лекарства с белками. Способность альбумина связывать лекарственные препараты за счет образования тех или иных связей определяется химическими свойствами аминокислот и их расположением внутри макромолекулы. Аналитические методы, используемые при изучении взаимодействия альбумина с молекулами лекарств, делятся на неспектроскопические и спектроскопические. Первая группа включает так называемые классические методы: равновесный и кинетический диализ, ультрафильтрацию, ультрацентпифугирование и электрофорез. Ко второй группе относятся ультрафиолетовая и видимая спектроскопия, флуоресценция, дисперсия оптического вращения и кругового дихроизма, ЯМР. Сродство молекулы бенздиазепина к ЧСА зависит от величины заместителей, их ориентации относительно активных групп рецепторного участка белка, а также от донорно-акцепторных свойств вещества. Можно предположить, что при наличии объемного заместителя в положении 1 бенздиазепина (флуразепам, празепам) наблюдаются стерические затруднения для сближения белка и лиганда, чего нельзя сказать о незамещенных бенздиазепинах (дикалий хлоразепате, хлордиазепоксиде) и бенздиазепинах с небольшими заместителями (диазепаме, оксазепаме). Галогензамещенные 1,4-бенздиазепинов по сродству к альбумину можно расположить в ряд Cl < Br < I. Вот почему бромазепам обладает меньшим сродством к ЧСА, чем диазепам и оксазепам. Общее количество связавшегося c ЧСА бенздиазепина также зависит от типа заместителя, вводимого в разные положения молекулы. Наиболее сильное влияние на связывание бенздиазепинов оказывали заместители в положении 7. Производные, содержащие в положении 7 атомы галогенов или метильную группу, связывались на 97-99, а содержащие аминогруппу - всего лишь на 19,8%. Производное, имеющее в положении 7 гидроксильную группу и занимающее по липотропности промежуточное положение между галоген- и аминосодержащими соединениями, связывались с белком на 54,7%. Связывание 1, 2, 3, 4 и 7 замещенных 1,4-бенздиазепинов с белками плазмы повышалось с увеличением липотропных свойств заместителей [2,4]. .6.3 Фармакокинетика производных 1,4-бензодиазепина Производные бензодиазепина различаются по особенностям фармакокинетики, что также учитывается при назначении этих препаратов. По продолжительности действия (с учетом эффекта активных метаболитов) бензодиазепины можно классифицировать следующим образом: длительного действия (Т1/2 - 24-48 ч): диазепам, хлордиазепоксид и др.; средней продолжительности действия (Т1/2 - 6-24 ч): алпразолам, оксазепам, лоразепам и др.; короткого действия (Т1/2 - менее 6 ч): мидазолам и др. Все бензодиазепины являются липофильными соединениями. Липофильность разных веществ этой группы варьирует более чем в 50 раз, наиболее липофильными из бензодиазепинов являются диазепам и мидазолам. При приеме внутрь бензодиазепины хорошо всасываются из ЖКТ, преимущественно из двенадцатиперстной кишки (абсорбция зависит от нескольких факторов, в том числе от липофильности). Наиболее быстро всасываются диазепам и триазолам, наименее быстро - оксазепам, лоразепам. Антациды могут понижать скорость (но не степень всасывания) некоторых бензодиазепинов, в том числе диазепама и хлордиазепоксида. После внутримышечного введения бензодиазепины всасываются медленнее, чем при приеме внутрь (исключение составляют лоразепам и мидазолам, которые при внутримышечном введении всасываются быстро) [2]. Время достижения максимальной концентрации в плазме крови после однократного приема для разных ЛС варьирует от 30 минут до нескольких часов. Равновесная концентрация в крови при курсовом приеме бензодиазепинов обычно достигается в течение нескольких дней после начала терапии (для бензодиазепинов с коротким и средним периодом полувыведения) или в течение 5 дней - 2 недель (для препаратов с длительным периодом полувыведения). Бензодиазепины и их метаболиты характеризуются высокой степенью связывания с белками крови, варьирующей от 70% (алпразолам) до 98% (диазепам). Первичный метаболизм бензодиазепинов происходит в печени. Исключение составляют дикалия клоразепат и флуразепам, которые быстро метаболизируются в ЖКТ и не попадают в системный кровоток в клинически значимых количествах. Действие оказывают их активные метаболиты, которые в дальнейшем подвергаются биотрансформации в печени. Большинство бензодиазепинов подвергается микросомальному окислению в печени, в основном путем N-деметилирования или гидроксилирования до активных или неактивных метаболитов. Затем метаболиты подвергаются конъюгации либо дальнейшей биотрансформации. В процессе метаболизма у многих бензодиазепинов образуются одинаковые активные метаболиты, некоторые из них применяются как самостоятельные лекарственные средства (оксазепам и др.). Длительность терапевтического эффекта для бензодиазепинов, имеющих активные метаболиты, определяется не Т1/2 исходного вещества, а Т1/2 активных метаболитов. Некоторые бензодиазепины не образуют активных метаболитов - лоразепам, оксазепам, темазепам и др. и подвергаются только процессу конъюгации под действием глюкуронилтрансферазы с образованием глюкуронидов. Бензодиазепины (и их метаболиты) выводятся преимущественно через почки в виде конъюгатов, менее 2% - в неизмененном виде, небольшая часть - через кишечник. Некоторые фармакокинетические параметры бензодиазепинов зависят от возраста. Так, у пациентов пожилого возраста может повышаться объем распределения. Кроме того, у пациентов пожилого возраста и детей может быть удлинен период полувыведения. Накопление бензодиазепинов с коротким или средним периодом полувыведения обычно минимально, и они быстро выводятся из организма после окончания терапии [3]. .7 Показания к применение бензодиазепиновых анксиолитиков В психиатрической и неврологической практике анксиолитики применяются при лечении неврозов, психопатий, неврозоподобных и психопатоподобных состояний, сопровождающихся тревогой, страхом, повышенной раздражительностью, эмоциональным напряжением. Для купирования тревожно-фобических расстройств (панические атаки и др.) Эффективны препараты с максимально выраженным анксиолитическим и антифобическим эффектом - алпразолам, лоразепам, феназепам. Некоторые бензодиазепиновые анксиолитики применяют для купирования тревожного синдрома при эндогенных психических заболеваниях, в том числе при шизофрении (как вспомогательное средство в составе комплексной терапии) - диазепам, феназепам и др. При острых состояниях, например с целью купирования выраженного психомоторного возбуждения, эффективно парентеральное введение бензодиазепинов (диазепам, феназепам и др.). При острой алкогольной абстиненции анксиолитики (диазепам, оксазепам, феназепам, хлордиазепоксид и др.) применяют в составе комплексной терапии для облегчения таких симптомов как возбуждение, нервное напряжение, беспокойство, тревога, тремор, а также для уменьшения вероятности развития или признаков, в том числе галлюцинаций, возникшего острого делирия. При нарушениях сна используют бензодиазепины, обладающие, наряду с анксиолитическим, выраженным снотворным действием (нитразепам, флунитразепам, триазолам, темазепам и др.). Они снимают эмоциональное напряжение, уменьшают тревогу, беспокойство и способствуют наступлению сна. Применение при нарушениях сна таких бензодиазепинов, как диазепам или феназепам, целесообразно в тех случаях, когда инсомния сочетается с дневной тревогой и желательно, чтобы анксиолитическое действие продолжалось в течение всего дня. Бензодиазепины с выраженным противосудорожным действием могут быть эффективны при лечении эпилепсии, эпилептического статуса (клоназепам, диазепам и др.), нитразепам - при некоторых формах судорожных припадков, особенно у детей. Бензодиазепины, как и другие анксиолитики, нашли широкое применение во многих областях медицины: в кардиологии, анестезиологии и хирургии, дерматологии и др. Бензодиазепины используют для премедикации накануне и непосредственно перед оперативными вмешательствами и эндоскопическими процедурами, для вводного наркоза, при атаралгезии в сочетании с анальгетиками (флунитразепам, мидазолам, диазепам и др.) [3]. .8 Связь между структурой и физиологической активностью 1,4-бензодиазепинов Изучение связи структура-активность в рядах биологически активных веществ - важный этап на пути целенаправленного «конструирования» молекул новых препаратов с необходимым комплексом фармакологических свойств. Уже в начале 60-х годов в ходе интенсивных исследований в области химии и фармакологии 1,4-бензодиазепинов, развернувшихся вслед за открытием хлордиазепоксида и внедрением его в медицинскую практику, предпринимались попытки определения ключевой структуры, обеспечивающей фармакологические свойства нового класса транквилизаторов. С течением времени было накоплено большое количество данных о связи между структурой и физиологической активностью 1,4-бензодиазепинов. Были выделены следующие особенности: ) Влияние заместителя в положении 7. Электроноакцепторные заместители в положении 7 приводят к повышению активности, а электронодонорные - к понижению. Роль заместителя в определении уровня активности по различным фармакологическим тестам (по различным видам действия) неодинакова, что, вероятно, обусловлено различием механизмов, лежащих в основе соответствующих эффектов. ) Влияние заместителя в положении 5. Наиболее активные транквилизаторы найдены среди 5-арил- либо 5-гетарил-(пиридил, тиенил, индолил и др.)-1,4- бенздиазепинов. Оптимальной активностью обладают соединения, содержащие у атома С5 бензольное ядро с атомами галогенов или другими электроноакцепторными группами в орто-положении. Введение атомов галогенов в орто-положение кольца С приводит к существенному (в 2 - 5 раз) повышению активности бенздиазепинонов по тесту антагонизма с коразолом. Мета- и пара-изомеры бенздиазепинов проявляют значительно более низкую активность по всем видам действия. Некоторые из соединений подобного типа практически неактивны как транквилизаторы. Интересно, что активность по тесту антагонизма с коразолом 5-(орто-галоген)фенил- 1,2-дигидро-ЗН-1,4-бенздиазепин-2-онов практически не зависит от природы галогена в орто-положении кольца С. В то же время степень уменьшения активности бенздиазепинов при перемещении атомов галогенов из орто- в мета- и пара-положения, по-видимому, определяется природой атома галогена: чем более электроотрицателен атом галогена, тем менее активны пара-изомеры по сравнению с орто-изомерами. ) Влияние связи N4→О. Окисление 1,2-дигидро-ЗН-1,4-бенздиазепин-2-онов до соответствующих 4-окисей сопровождается, как правило, снижением активности. ) Влияние двойной связи N4→C5. Переход от ЗН-1,4-бенздиазепинов к 1,2-дигидро-ЗН-1,4-бенздиазепинам, как уже указывалось, привел к более активным препаратам, нежели хлордиазепоксид и его аналоги. Эксперименты на животных показали, что тетрагидро-1,4-бенздиазепин-2-оны проявляют активность по тем же тестам, что и 1,2-дигидро-ЗН-1,4-бенздиазепин-2-оны, уступая последним по уровню активности. Однако в организме животных тетрагидро-1,4-бенздиазепин-2-оны окисляются до дигидро-1,4-бенздиазепин-2-онов. Поэтому окончательного вывода о роли двойной связи N4-С6 в определении активности 1,4-бенздиазепинов пока сделать нельзя, поскольку фармакологический эффект тетрагидробензодиазепинов может быть обусловлен в определенной степени или полностью действием на центральную нервную систему их метаболитов - дигидробенздиазепинонов. ) Влияние заместителей в положении 3. Спектр фармакологической активности 3-замещенных 1,2-дигидро-ЗН-1,4-бенздиазепин-2-онов качественно сходен со спектром 1,2-дигидро-ЗН-1,4-бенздиа-зепин-2-онов, незамещенных в положении 3. Природа заместителей у атома С3 оказывает существенное влияние на уровень активности бенздиазепинов, причем иногда различное по отдельным видам действия. 3-Алкилпроизводные обладают значительно меньшей активностью по сравнению с незамещенными у атома С3 веществами. С увеличением объема алкильного радикала активность убывает. Активность хиральных 1,4-бенздиазепинов зависит от их конфигурации. Так, левовращающий изомер (D-форма) 3-пропил-7-хлор-5-фенил-1,2-дигидро-ЗН-1,4-бенздизепин-2-она обладает большей по сравнению с правовращающим изомером активностью по тесту антагонизма с коразолом. Введение гидроксильной группы в положение 3 1,2-дигидро-ЗН-1,4-бенздиазепиновой системы приводит к неоднозначному изменению активности по отдельным видам действия. По антагонизму с коразолом, по тесту максимального электрошока и угнетению ориентировочных реакций активность 3-оксипроизводных в ряде случаев ниже активности незамещенных в положении 3 аналогов. Однако по тестам потенцирования гексеналового сна и нарушения координации движений 3-оксипроизводные более активны. З-Ацил- оксипроизводные, как правило, менее активны, чем соответствующие 3-оксипроизводные. З-Арилиден- и 3-гетарилиденпроизводные менее активны, чем незамещенные в положении 3 бенздиазепиноны. Но некоторые представители данного типа производных 1,4-бенздиазепина, обладая достаточно высокой активностью по основным видам действия, проявляют низкую активность по тем видам действия, которые для транквилизаторов считаются побочными. Это делает перспективным изучение такого рода соединений с целью изыскания так называемых дневных транквилизаторов. ) Влияние группировки в положении 2. Замещение карбонильной группы в 1,2-дигидро-ЗН-1,4-бенздиазепин-2-онах на тиокарбонильную либо метиленовую группу приводит к ослаблению активности, хотя характер действия препаратов на центральную нервную систему принципиально не изменяется. ) Замещение у атома N1 на метальную группу чаще всего приводит к увеличению активности. Введение в это положение более объемных заместителей сопровождается снижением уровня активности. В некоторых случаях могут получаться практически неактивные производные. Замещение атома водорода в положении 1 на некоторые группы (карбамоильную, ацильные и др.) иногда дает эффект пролонгации действия таких производных 1,4-бенздиазепина. ) Влияние аннелированных циклов. Среди большого количества 1,4-бенздиазепинов с аннелированными циклами наибольший фармакологический и клинический интерес представляют системы с аннелированными гетероциклами в положениях 1, 2, и З, 4. Симметричные триазолобенздиазепины (триазолам, алпразолам и пр.) как транквилизаторы превосходят по активности диазепам [4,6]. .9 Феназепам .9.1 Препарат «Феназепам» «Феназепам»являетсяотечественнымвысокоактивным транквилизатором анксиолитического действия, превосходит другие транквилизаторы; оказывает также выраженное противосудорожное, миорелаксантное и снотворное действие. Механизм действия феназепама связан с уменьшением возбудимости подкорковых центров головного мозга, торможением действия между ними и корой мозга. Феназепам является экзогенным лигандом специфических бензодиазепиновых рецепторов ЦНС. При применении вместе со снотворными и наркотическими средствами происходит взаимное усиление влияния на ЦНС. Феназепам назначают при различных невротических и психатоподобных состояниях, сопровождающихся тревогой, страхом, повышенной раздражительностью, эмоциональной лабильностью. Препарат эффективен при навязчивости, фобии, ипохондрических синдромах, показан также при психогенных психозах, панических реакциях и другие, так как снимает состояние тревоги и страха. Феназепам применяют также для купирования алкогольной абстиненции. Кроме того, назначают как противосудорожное и снотворное средство. По силе снотворного действия приближается к митразепаму. Назначают феназепам внутрь в виде таблеток. В амбулаторных условиях назначают взрослым по 0.00025-0.0005 г (0.25-0.5мг) 2-3 раза в день. В условиях стационара суточная доза может быть увеличена до 0.003-0.005г (3-5мг); при лечении эпилепсии суточная доза составляет от 0.002-0.01 г (2-10мг). Следует учитывать, что в связи с высокой активностью феназепама чаще могут наблюдаться атаксия, сонливость, мышечная слабость, головокружение [10,11]. .9.2 Пространственная форма феназепама Дигидро-3Н-1,4-бензодизепин-2-оны имеют ваннообразную пространственную форму (рисунок 1.32). В гетероцикле имеются два практически плоских фрагмента, включающих кратные связи N(8)-C(5)-C(6)-C(13) и C(6)-C(13)-N(12)-C(11), и амидный фрагмент C(5)-N(8)-C(9)-C(11); плоским является также окружение атома углерода карбонильной группы. Атомы N(8), C(5), C(6), C(13) расположены практически в одной плоскости, от которой атомы C(9), C(11) и N(12) отогнуты в сторону. Рисунок 1.32 - Геометрия молекулы феназепама и торсионные углы в семичленном гетероцикле Длина связей и валентные углы в молекуле феназепама со стандартными отклонениями показаны на рисунке 1.33. Оба атома азота тригональные. На рисунке 1.34 представлено расположение молекул феназепама в кристалле. За счет водородных связей между амидными группами молекулы образуют центросимметричные димеры. Длина Н-связи равна 2,9 Е [4]. Рисунок 1.33 - Длины связей и валентные углы со стандартными отклонениями в молекуле феназепама Рисунок 1.34 - Расположение молекул феназепама в кристалле .9.3 Фармакокинетика феназепама Высокая биодоступность феназепама способствует быстрому достижению максимального уровня препарата практически во всех исследуемых субстратах (30 мин), после чего происходит быстрое снижение содержания во всех исследуемых органах и тканях животных. Высокое содержание отмечено в печени, почках и жировых тканях. Снижение логарифма концентраций содержания препарата в печени, почках, жировой ткани и плазме крови осуществляется параллельно. Более высокое содержание препарата в указанных органах обусловлено экскректорными функциями печени, почек и липофильностью препарата и, как следствие, сродством к жировой ткани. Изучение распределения препарата при однократном и длительном введениях продемонстрировало отсутствие депонирования препарата. При изучении распределения препарата и метаболитов в органах и тканях не обнаружено какого-либо органа и ткани, в котором элиминация препарата и метаболитов осуществлялась бы существенно медленнее, чем из плазмы крови. Распределение метаболитов феназепама, продемонстрировало также высокую скорость метаболизма препарата [10]. Одним из направлений биотрансформации феназепама в организме является процесс гидроксилирования, который осуществляется по третьему положению диазепинового цикла (рисунок 1.35). В результате этих превращений образуется 3-оксифеназепам, который является одним из метаболитов феназепама. Наряду с образованием гидроксилированного метаболита в процессе метаболизма феназепама предполагается образование продукта биотрансформации с шестичленным диазепиновым циклом (6-бром-4-фенилхиназолинон) и метаболита с разорванным диазепиновым кольцом (бензофенон) [11]. Выделение феназепама из организма при однократном и длительном введениях происходит в результате нескольких параллельных парциальных процессов: а) процесс выведения неизменного соединения и процессы образования продуктов окисления препарата (свободных метаболитов); б) процессы выведения свободных метаболитов феназепама и процессы образования конъюгатов; в) параллельное образование глюкуроновых и других конъюгатов [4]. Рисунок 1.35- Биотрансформация феназепама в организме .9.4 Данные о безопасности препарата Препарат не обладает мутагенными свойствами. Не выявлено токсическое действие феназепама на лейкоциты. Препарат не оказывает воздействия на бласт-трансформацию лимфоцитов крови. В ходе клинического изучения препарата, в основном, регистрировались побочные (или нежелательные) эффекты, характерные для всех транквилизаторов бензодиазепинового ряда и связанные с гипноседативным и миорелаксантным действием препарата. Все наблюдаемые нарушения обычно спонтанно исчезали или значительно уменьшались при стабилизации дозировок и по мере увеличения сроков лечения. Исследование побочных эффектов при применении феназепама не выявило каких-либо неожиданных или опасных явлений, что дает основания отнести оригинальный отечественный транквилизатор - «Феназепам» - к высокоэффективным и безопасным средством [11,13]. .9.5 Синтез феназепама Процесс получения фармокопейного феназепема состоит из следующих стадий: 1) подготовка оборудования; ) подготовка сырья, вспомогательных материалов; ) получение «бензофенона» из n-броманилина и о-хлорбензоилхлорида (рисунок 1.36); n-броманилин о-хлорбензоилхлорид «бензофенон» Рисунок 1.36 - Схема получения «бензофенона» ) получение технического феназепама: ацилирование “бензофенона” (рисунок 1.37); «хлорацетомид» Рисунок 1.37 - Схема ацилирования “бензофенона” аминирование «хлорацетомида» (рисунок 1.38); «аминоацетомид» Рисунок 1.38 - Схема аминирования «хлорацетомида» получение феназепама (рисунок 1.39); феназепам Рисунок 1.39 - Схема получения феназепама ) получение фармакопейного феназепама (перекристаллизация технического феназепама из толуола); ) регенерация растворителей; ) обезвреживание отходов; ) обезвреживание выбросов в атмосферу [17]. анксиолитик феназепам биохимический фармакокинетика 2. АНАЛИЗ СУБСТАНЦИИ ФЕНАЗЕПАМА И ПРЕПАРАТА «ФЕНАЗЕПАМ» В экспериментальной части данной работы описаны методы и методики анализа основного действующего вещества в субстанции и в препарате «Феназепам» и соответствие ФС по основным показателям качества, приведены расчеты по изложенным методикам и обсуждение полученных в ходе эксперимента результатов, а так же описан эксперимент по усовершенствованию технологии производства препарата. Анализу подвергались субстанция и готовая продукция препарата «Феназепам». ООО «РОЗФАРМ» не осуществляет самостоятельного производства субстанций феназепама, а приобретает его у других предприятий специализируемых на их изготовлении. В связи с этим входной контроль получаемого сырья очень важен. Исследования проводились в отделе контроля качества ООО «РОЗФАРМ». .1 Производство препарата «Феназепам» Производство препарата включает в себя стадии: ) Подготовка сырья феназепама. Процесс подготовки сырья для производства таблеток включает в себя стадии: - измельчение сырья; - просев сырья; - приготовление увлажнителя. Измельчение сырья (стеариновой кислоты) производится на микромельнице. Предварительно отвешивают необходимое количество сырья на технических весах. Просев сырья осуществляют с помощью вибрационного сита. Допускается использование ручного сита. Для просеивания сырья для производства таблеток «Феназепам» (феназепам, сахар молочный, крахмал картофельный) используется сито с диаметром отверстий (0,5±0,03) мм. Для просеивания сырья: кислота стеариновая (измельченная), кальция стеарат используется сито с диаметром отверстий (0,3±0,06) мм. ) Приготовление таблеточной массы. Процесс приготовления таблетмассы для производства таблеток включает в себя стадии: - получение гранулята; - калибровка гранулята; - опудривание гранулята - переработка некондиционных таблеток. В качестве вспомогательных веществ для производства «Феназепам» таблеток 1мг используются: сахар молочный как наполнитель, крахмал картофельный как связующее и разрыхляющее вещество, кальция стеарат как смазывающее вещество, кислота стеариновая как скользящее вещество. Процесс получения гранулята включает в себя стадии: - смешивание и увлажнение; - сушка гранулята. Для производства таблеток «Феназепам» используют влажное гранулирование, которое проводят в ротогрануляторе. В ротогранулятор загружают действующее вещество, затем добавляют необходимое количество увлажнителя. После смешивания на панели управления ротогранулятора устанавливают режим сушки гранулята. Сушку гранулята осуществляют под вакуумом с периодическим отбором проб для определения влаги, которая должна составлять 2.5+0.5%. После охлаждения гранулята до температуры 25±5 оС продукт подвергают калибровке. Калибровку гранулята проводи на установке для калибровки гранул, на сетке с размером ячеек 1.5 мм. Опудривание гранулята проводят на смесительной установке, последовательно загружая необходимые количества гранулята, крахмала картофельного с влажностью не более 20%, стеарата кальция или магния, некондиционные измельченные таблетки. 3) Таблетирование таблеточной массы Процесс таблетирования таблетмассы таблеток включает в себя стадии: - таблетирование; обеспыливание таблеток. Таблетирование таблеточной массы производят на таблетпрессе, предварительно отрегулировав параметры прессования (среднюю массу таблеток, усилие прессования, высоту таблетки). На этой стадии проводят отбор проб таблеток на соответствие по: - описанию; средней массе таблеток; - распадаемости.; - количественному содержанию. Обеспыливание таблеток производят в обеспыливателе, который входит в аппаратную схему таблетпресса. .2 Метод прямого прессования Метод прямого прессования позволяет значительно сократить производственный процесс за счёт исключения таких стадий, как приготовление гранулирующего раствора, увлажнения, влажного гранулирования, сушки, сухой грануляции. Это позволяет повысить качество готовой продукции, особенно полученной на основе термолабильных и светочувствительных субстанций, увеличивает стабильность препаратов в процессе хранения. Однако для производительной работы таблеточных машин прессуемый материал должен обладать оптимальными технологическими характеристиками (сыпучестью, прессуемостью, влажностью и др.) Такими характеристиками обладает лишь небольшое число не гранулированных порошков - вещества, имеющие изометрическую форм частиц приблизительно одинакового гранулометрического состава, не содержащих большого количества мелких фракций. Они хорошо прессуются. Одним из методов подготовки лекарственных веществ к прямому прессованию является направленная кристаллизация - добиваются получения таблетируемого вещества в кристаллах заданной сыпучести, прессуемости и влажности путем особых условий кристаллизации. Широкое использование прямого прессования может быть обеспечено повышением сыпучести не гранулированных порошков, качественным смешиванием сухих лекарственных и вспомогательных веществ, уменьшением склонности веществ к расслоению. .3 Методики экспериментов .3.1 Анализ субстанции феназепама на содержание основного действующего вещества и других показателей качества Анализу подвергалась субстанция феназепама, приобретаемая ООО «РОЗФАРМ» на других предприятиях. Контроль поступившей субстанции позволяет подтвердить подлинность, количественное содержание основного действующего вещества в сырье, которое в последующем используется для изготовления нестерильных лекарственных препаратов. Испытания проводились в соответствии с ФС 42-2411-04. Таблица 2.1 Числовые показатели, влияющие на качество субстанции феназепама Наименование показателей Норма Температура плавления 225оС - 230оС Посторонние примеси Не более 0.05% Потеря в массе при высушивании (определение влаги) Не более 0.5% Сульфатная зола Не более 0.1% Количественное содержание действующего вещества (феназепама) Не менее 99% 2.3.1.1 Описание внешнего вида субстанции феназепама Рисунок 2.1 - Структура феназепама (7-бром-1.3-дигидро-5-(2-хлорфенил)-2Н-1.4-бензодиазепин-2-она) Феназепам представляет собой белый или белый со слегка желтоватым или кремовым оттенком кристаллический порошок [17]. .3.1.2 Определение растворимости Растворимость является физическим показателем подлинности субстанции. Растворимость в фармакопейном анализе рассматривают, как свойство лекарственного вещества растворяться в различных растворителях. Растворимость при постоянной температуре является одной из основных характеристик, с помощью которой подтверждается подлинность лекарственных веществ. В соответствии с ФС 42-2411-04 субстанция феназепама практически нерастворима в воде и эфире, мало растворима в этиловом спирте 95% и умеренно растворима в хлороформе. Определение проводят в соответствии с ГФ XII, вып.1, с. 175. Методика определения растворимости субстанции Для определения растворимости субстанции феназепама применяют следующие растворители: этиловый спирт 95%, хлороформ. г субстанции феназепама вносят в 100 см3 хлороформа и непрерывно встряхивают в течение 10 минут при 20±2°С. Предварительно навеска должна быть растерта. г субстанции феназепама вносят в 1000 см3 этилового спирта 95% и непрерывно встряхивают в течение 10 минут при 20±2°С. Субстанцию считают растворившейся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества [17]. .3.1.3 Определение подлинности Испытание на подлинность - это подтверждение идентичности анализируемого лекарственного вещества (лекарственной формы), осуществляемое на основе требований ФС 42-2411-04. Для определения подлинности феназепама разработаны следующие методики. ) Качественная реакция Реакция на блокированную ароматическую аминогруппу является качественной реакцией на определение лекарственных средств бензодиазепинового ряда. Данная реакция протекает по схеме представленной на рисунке 2.2. Рисунок 2.2 - Качественная реакция на феназепам Методика эксперимента .02 г субстанции феназепама нагревают до кипения с 2 см3 разведенной кислоты хлороводородной в течение 3 минут и охлаждают. В полученный раствор добавляют нитрит натрия и проводят реакцию диазотирования. Затем в полученную соль диазония добавляют резорцин в щелочной среде и получают азокраситель красного цвета. ) Специфическая реакция. При плавлении лекарственных веществ образуются плавы различного цвета, что является специфической реакцией на определении подлинности субстанции феназепама. При плавлении субстанции феназепама образуется плав фиолетового или красно-фиолетового цвета. Раствор плава феназепама в этиловом спирте 95% имеет особенность, его окраска изменяется в зависимости от рН среды: при рН<7 окраска изменяется от сине-зеленой до желтой, а при рН> |
