Производстве Минеральных Удобрений , Отходы при производстве и способы их утилизации. Производстве Минеральных Удобрений , Отходы при производстве и. Производстве Минеральных Удобрений, Отходы при производстве и способы их утилизации
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
|
Кафедра «Безопасность и экологии горного производства» (БЭГП) РЕФРАТ Тема: «Производстве Минеральных Удобрений , Отходы при производстве и способы их утилизации» Студентка: Алкинани Фатима Дакил Саидхууд Группа мтб 20.01.04 курса : Процессы и аппараты окружающей среды защиты окружающей среды Направление : 20.04.01 техносферная безопасность - Горный институт Группа мтб 20.01.04 СОДЕРЖАНИЕ ВВДЕНИЕ……………………………………………………………….3 Производство минеральных удобрений…………………………….6 2-1 Производство суперфосфата ……………………………………………….6 2-2 Азотные удобрения………………………………………………………….10 2-3 Производство аммиачной селитры…………………………………………10 2-4 Производство карбамида……………………………………………………13 отходы при производстве и их улитаз………………………………18 3-1 Калийные удобрения. Характеристика отходов…………………………..19 3-2 Фосфорные удобрения. Характеристика отходов…………………………21 4-Заключение………………………………………………………………..25 5- список литиратуры…………………………………………………….27 ВВДЕНИЕ Минеральными удобрениями называют соли, содержащие элементы, необходимые для питания растений и вносимые в почву для получения высоких и устойчивых урожаев. Минеральные удобрения являются одним из важнейших видов продукции химической промышленности. Рост численности населения выдвигает перед всеми странами мира одну и ту же проблему – умелое управление способностью природы воспроизводить жизненные ресурсы и прежде всего продовольственные. Задача расширенного воспроизводства продуктов питания уже давно решается применением в сельском хозяйстве минеральных удобрений. Научными прогнозами и перспективными планами предусматривается дальнейшее увеличение мирового выпуска минеральных и органоминеральных удобрений, удобрений с регулируемым сроком действия. Производство минеральных удобрений - одна из важнейших подотраслей химической промышленности, его объем во всем мире составляет более 100млн. т в год. В наибольших количествах вырабатывают и потребляют соединения натрия, фосфора, калия, азота, алюминия, железа, меди, серы, хлора, фтора, хрома, бария и др. Классификация минеральных удобрений Минеральные удобрения классифицируют по трем главным признакам: агрохимическому назначению, составу и свойствам. 1. По агрохимическому назначению удобрения делят на прямые, являющиеся источником питательных элементов для растений, и косвенные, служащие для мобилизации питательных веществ почвы улучшением ее физических, химических и биологических свойств. К косвенным удобрениям принадлежат, например, известковые удобрения, применяемые для нейтрализации кислых почв. Прямые минеральные удобрения могут содержать один или несколько разных питательных элементов. 2. По количеству питательных элементов удобрения подразделяют на простые (одинарные) и комплексные. В простые удобрения входит только один из трех главных питательных элементов. Соответственно простые удобрения делят на азотные, фосфорные и калийные. Комплексные удобрения содержат два или три главных питательных элемента. По числу главных питательных элементов комплексные удобрения называют двойными (например, типа NP или РК) или тройными (NPK); последние также называют полными. Удобрения, содержащие значительные количества питательных элементов и мало балластных веществ, называют концентрированными Комплексные удобрения, кроме того, разделяют на смешанные и сложные. Смешанными называют механические смеси удобрений, состоящие из разнородных частиц, получаемые простым тукосмешением. Если же удобрение, содержащее несколько питательных элементов, получается в результате химической реакции в заводской аппаратуре. Оно называется сложным. Удобрения, предназначенные для питания растений элементами, стимулирующими рост растений и требующимися в весьма малых количествах, называются микроудобрениями, а содержащиеся в них питательные элементы – микроэлементами. Такие удобрения вносят в почву в очень небольших количествах. К ним относятся соли, содержащие бор, марганец, медь, цинк и другие элементы. 3. По агрегатному состоянию удобрения подразделяют на твердые и жидкие (аммиак, водные растворы и суспензии). Большое значение имеют физические свойства удобрений. Водорастворимые удобрительные соли должны быть сыпучими, легко рассеиваться, не быть сильно гигроскопичными, не слеживаться при хранении; должны обладать такими, чтобы сохраняться на почве в течение некоторого времени, не слишком быстро вымываться дождевой водой и сдуваться ветром. Этим требованиям в наибольшей мере обладают крупнокристаллические и гранулированные удобрения. Гранулированные удобрения можно вносить не поля механизированными методами с использованием туковых машин и сеялок в количествах, строго соответствующих агрохимическим требованиям. Фосфорные удобрения Фосфорные удобрения в зависимости от их состава в различной степени растворимы в почвенных растворах и, следовательно, неодинаково усваиваются растениями. По степени растворимости фосфорные удобрения разделяют на водорастворимые, усвояемые растениями, и нерастворимые фосфаты. К водорастворимым относятся простой и двойной суперфосфаты. К усвояемым, т.е. растворимым в почвенных кислотах, относятся преципитат, термофосфат, плавленые фосфаты и томас-шлак. Нерастворимые удобрения содержат трудноусваемые соли фосфата, растворимые только в сильных минеральных кислотах. К ним фосфоритная мука, апатиты, костяная мука. Сырьем для производства элементарного фосфата, фосфорных удобрений и других соединений фосфора служат природные фосфаты: апатиты и фосфориты. В этих рудах фосфор находится в нерастворимой форме, главным образом в виде фторапатита Ca5 F(PO4 )3 или гидроксилапатита Ca5 OH(PO4 )3 . Для получения легкоусваиваемых фосфорных удобрений, применяемых в любых почвах, требуется перевести нерастворимые фосфорные соли природных фосфатов в водорастворимые или легкоусваемые соли. В этом и состоит основная задача технологии фосфорных удобрений. Растворимость фосфорнокислых солей повышается по мере увеличения их кислотности. Средняя соль Са3 (РО4 )2 растворима лишь в минеральных кислотах, СаНО4 растворима в почвенных кислотах, а наиболее кислая соль СаН2 РО4 )2 растворима в воде. В производстве фосфорных удобрений стремятся получить возможно большую часть фосфора в виде монокальцийфосфата Са(Н2 РО4 )2 . Перевод нерастворимых природных солей в растворимые осуществляется разложением их кислотами, щелочами,нагреванием (термическая возгонка фосфора). Одновременно с получением растворимых солей стремятся получить фосфорные удобрения с возможно большей концентрацией фосфора. Производство суперфосфата Химическая промышленность выпускает простой и двойной суперфосфаты. Простой суперфосфат – самое распространенное фосфорное удобрение. Он представляет собой порошок (или гранулы) серого цвета, содержащий в основном монофосфат кальция Са(Н2РО4)2*Н2О и сульфат кальция СаSO4*0,5Н2О. В состав суперфосфата входят примеси: фосфаты железа и алюминия, кремнезем, а также фосфорная кислота. Сущность производства суперфосфата состоит в разложении природных фосфатов серной кислотой. Процесс получения суперфосфата при взаимодействии серной кислоты с кальцийфторапатитом является многофазным гетерогенным процессом, протекающим в основном в диффузионной области. Этот процесс можно условно разбить на два этапа. Первый этап – это диффузия серной кислоты к частицам апатита, сопровождаемая быстрой химической реакцией на поверхности частиц, которая идет до полного израсходования кислоты, и кристаллизация сульфата кальция: Ca5 F(PO4 )3 + 5H2 SO4 +2,5H2 O=5(CaSO4 *0,5H2 O)+H3 PO4 +HF+Q (а) Второй этап – диффузия образовавшейся фосфорной кислоты в порах неразложившихся частиц апатита, сопровождаемая реакцией Ca5 F(PO4 )3 +7H3 PO4 +5H2 O=5Ca(H3 PO4 )2 *H2 O+HF+Q (б) Образующийся монокальцийфосфат находится сначала в растворе, при перенасыщении которого начинает кристаллизоваться. Реакция (а) начинается сразу же после смещения и заканчивается в реакционной суперфосфатной камере в течении 20-40 мин в период схватывания и затвердения суперфосфатной массы, которые происходят за счет сравнительно быстрой кристаллизации малорастворимого сульфата кальция и перекристаллизации полугидрата в ангидрит по уравнению реакции 2CaSO4 *0,5H2 O=2CaSO4 +H2 O Последующая стадия процесса – созревание суперфосфата, т.е. образование и кристаллизация монокальцийфосфата, происходит медленно и заканчивается лишь на складе (дозревание) при вылеживание суперфосфата в течение 6-25сут. Малая скорость этой стадии объясняется замедленной диффузией фосфорной кислоты через образовавшуюся корку монокальцийфосфата, покрывающую зерна апатита, и крайне медленной кристаллизацией новой твердой фазы Са(Н2 РО4 )2 *Н2 О. Оптимальный режим в реакционной камере определяется не только кинетикой реакций и диффузией кислот, но и структурой образовавшихся кристаллов сульфата кальция, которая влияет на суммарную скорость процесса и качество суперфосфата. Ускорить диффузионные процессы и реакции (а) и (б) можно повышением начальной концентрации серной кислоты до оптимальной температуры. Наиболее медленным процессом является дозревание. Ускорить дозревание можно охлаждением суперфосфатной массы и испарением из нее воды, что способствует кристаллизации монокальцийфосфата и повышает скорость реакции (б) вследствие увеличения концентрации Н3 РО4 в растворе. Для этого на складе перемешивают и распыляют суперфосфат. Содержание Р2 О5 в готовом суперфосфате примерно в два раза ниже, чем в исходном сырье, и составляет при переработке апатитов 19-20% Р2 О5. Готовый суперфосфат содержит некоторое количество свободной фосфорной кислоты, увеличивающей его гигроскопичность. Для нейтрализации свободной кислоты суперфосфат смешивают нейтрализующими твердыми добавками или аммонизируют, т.е. обрабатывают газообразным аммиаком. Эти мероприятия улучшают физические свойства суперфосфата – уменьшают влажность, гигроскопичность, слеживаемость, а при аммонизации вводится еще один питательный элемент – азот. Существуют периодические, полунепрерывные и непрерывные способы производства суперфосфата. В настоящее время большинство действующих заводов осуществлют непрерывный способ производства. Схема непрерывного способа производства суперфосфата приведена на рис. 1 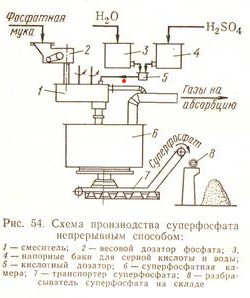 рис. 1 змельченный апатитовый концентрат (или фосфоритная мука) системой транспортеров, шнеков элеваторов передается со склада на автоматический весовой дозатор, из которого дозируется в смеситель непрерывного действия. Серная кислота (75%-ная башенная H2 SO4 ) непрерывно разбавляется водой в дозаторе-смесителе до концентрации 68% H2 SO4 , контролируемой концентратомером, и подается в смеситель, в котором происходит механическое смешивание фосфатного сырья с серной кислотой. Образующаяся пульпа из смесителя передается в реакционную суперфосфатную камеру непрерывного действия, где происходит образование суперфосфата (схватывание и затвердевание пульпы в начальный период созревания суперфосфатной массы). Из суперфосфатной камеры измельченный суперфосфат подкамерным конвейером передается в отделение дообработки – склад суперфосфата, по которому равномерно распределяется разбрасывателем. Для ускорения дозревания суперфосфата его перемешивают на складе грейферным краном. Для улучшения физических свойств суперфосфата его гранулируют во вращающихся барабанах-грануляторах. В грануляторах порошкообразный суперфосфат увлажняется водой, подаваемой внутрь барабана форсунками, и «закатывается» в гранулы различных размеров, которые затем сушат, рассеивают на фракции и тарируют в бумажные мешки. Основным аппаратом суперфосфатного производства служит суперфосфатная камера. Питание ее пульпой производится из смесителя, укрепленного непосредственно над крышкой камеры. Для непрерывного питания суперфосфатных камер применяются шнековые смесители и камерные смесители с механическим перемешиванием. Недостатком простого суперфосфата является сравнительно небольшое содержание питательного элемента – не более 20% Р2 О5 из апатитового концентрата и не более 15% Р2 О5 из фосфоритов. Более концентрированные фосфорные удобрения можно получить при разложении фосфатной породы фосфорной кислоты. Азотные удобрения Большинство азотных удобрений получают синтетически: нейтрализацией кислот щелочами. Исходными материалами для получения азотных удобрений служат серная и азотная кислоты, диоксид углерода, жидкий или газообразный аммиак, гидроксид кальция и т.п. Азот находится в удобрениях или в форме катиона NH4 + , т.е. в аммиачной форме, в виде NH2 (амидные), или аниона NO3 - , т.е. в нитратной форме; удобрение одновременно может содержать и аммиачный и нитратный азот. Все азотные удобрения водорастворимы и хорошо усваиваются растениями, но легко выносятся вглубь почвы при обильных дождях или орошении. Распространенным азотным удобрением является нитрат аммония или аммиачная селитра. Производство аммиачной селитры Аммиачная селитра – безбалластное удобрение, содержащее 35% азота в аммиачной и нитратной форме, благодаря чему она применяется на любых почвах и для любых культур. Однако это удобрения обладает неблагоприятными для его хранения и применения физическими свойствами. Кристаллы и гранулы аммиачной селитры расплываются на воздухе или слеживаются в крупные агрегаты в результате их гигроскопичности и хорошей растворимости в воде. Кроме того при изменении температуры и влажности воздуха во время хранения аммиачной селитры могут происходить полиморфные превращения. Для подавления полиморфных превращений и повышения прочности гранул аммиачной селитры применяют добавки, вводимые в процессе ее изготовления, - фосфаты и сульфаты аммония, борную кислоту, нитрат магния и др. Взрывоопасность аммиачной селитры осложняет ее производство, хранение и транспортировку. Аммиачную селитру производят на заводах, вырабатывающих синтетический аммиак и азотную кислоту. Производственный процесс складывается из стадий нейтрализации слабой азотной кислоты газообразным аммиаком, упарки полученного раствора и гранулирования аммиачной селитры. Стадия нейтрализации основана на реакции NH3 +HNO3 =NH4 NO3 +148, 6 кДж Этот хемосорбционный процесс, при котором поглощение газа жидкостью сопровождается быстрой химической реакцией, идет в диффузионной области и сильно экзотермичен. Теплота нейтрализации рационально используется для испарения воды из растворов нитрата аммония. Применяя азотную кислоту высокой концентрации и подогревая исходные реагенты, можно непосредственно получить плав аммиачной селитры (конценрацией выше 95-96% NH4 NO3 ) без применения выпаривания. Наиболее распространены схемы с неполным упариванием раствора аммиачной селитры за счет теплоты нейтрализации (рис. 2). 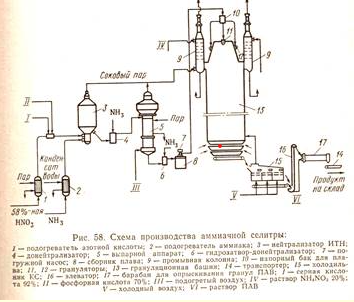 рис 2 Основная масса воды упаривается в химическом реакторе –нейтрализаторе ИТН (использование теплоты нейтрализации). Этот реактор – цилиндрический сосуд из нержавеющей стали, внутри которого находится другой цилиндр, куда непосредственно вводится аммиак и азотная кислота. Внутренний цилиндр служит нейтрализационной частью реактора (зона химической реакции), а кольцевое пространство между внутренним цилиндром и корпусом реактора – испарительной частью. Образовавшийся раствор аммиачной селитра поступает из внутреннего цилиндра в испарительную часть реактора, где испарение воды происходит за счет теплообмена между нейтрализационной и испарительной зонами через стенку внутреннего цилиндра. Образовавшийся соковый пар отводится из нейтрализатора ИТН и используется затем как греющий агент. Сульфатно-фосфатная добавка дозируется в азотную кислоту в виде концентрированных серной и фосфорной кислот, которые нейтрализуются вместе с азотной аммиаком в нейтрализаторе ИТН. При нейтрализации исходной азотной кислоты 58%-ный раствор аммиачной селитры на выходе из ИТН содержит 92-93% NH4 NO3 ; этот раствор направляется в донейтрализатор, в который подается газообразный аммиак с таким расчетом, чтобы раствор содержал избыток аммиака (около 1 г/дм3 своб. NH3 ), что обеспечивает безопасность дальнейшей работы с плавом NH4 NO3 . Донейтрализованный раствор концентрируют в комбинированном тарельчатом трубчатом выпарном аппарате с получением плава, содержащего 99,7-99,8% NH4 NO3 . Для гранулирования высококонцентрированной аммиачной селитры плав погруженными насосами перекачивается наверх грануляционной башни высотой 50-55м. Гранулирование производится разбрызгиванием плава с помощью акустических виброгрануляторов ячеечного типа, обеспечивающих однородный гранулометрический состав продукта. Охлаждение гранул производится воздухом в холодильнике кипящего слоя, состоящем из нескольких последовательных ступеней охлаждения. Охлажденные гранулы опрыскиваются ПАВ в барабане с форсунками и передаются на упаковку. Ввиду недостатков аммиачной селитры целесообразно изготовление на ее основе сложных и смешанных удобрений. Смешением аммиачной селитры с известняком, сульфатом аммония получают известково-аммиачную селитру, сульфатнитрат аммония и др. Нитрофоску можно получить сплавлением NH4 NO3 с солями фосфора и калия. Производство карбамида Карбамид (мочевина) среди азотных удобрений занимает второе место по объему производства после аммиачной селитры. Рост производства карбамида обусловлен широкой сферой его применения в сельском хозяйстве. Он обладает большой устойчивостью к выщелачиванию по сравнению с другими азотными удобрениями, т.е. менее подвержен вымыванию из почвы, менее гигроскопичен, может применяться не только как удобрения, но и в качестве добавки к корму крупного рогатого скота. Карбамид, кроме того, широко используется для получения сложных удобрений, удобрений с регулируемым сроком действия, а также для поучения пластмасс, клеев, лаков и покрытий. Карбамид CO(NH2 )2 – белое кристаллическое вещество, содержащее 46.6% азота. Его получение основано на реакции взаимодействия аммиака с диоксидом углерода 2NH3 +CO2 =CO(NH2 )2 +H2 O H=-110,1 кДж (1) Таким образом, сырьем для производства карбамида служат аммиак т диоксид углерода, получаемый в качестве побочного продукта при производстве технологического газа для синтеза аммиака. Поэтому производство карбамида на химических заводах обычно комбинируют с производством аммиака. Реакция (1) – суммарная; она протекает в две стадии. На первой стадии происходит синтез карбамата: 2NH3 +CO2 =NH2 COONH4 H=-125,6 кДж (2) газгазжидкость На второй стадии протекает эндотермический процесс отщепления воды от молекул карбамата, в результате которого и происходит образование карбамида: NH2 COONH4 = CO(NH2 )2 + Н2 О Н=15.5 (3) жидкость жидкостьжидкость Реакция образования карбамата аммония – обратимая экзотермическмя, протекает с уменьшением объема. Для смещения равновесия в сторону продукта ее необходимо проводить при повышенном давлении. Для того, чтобы процесс протекал с достаточно высокой скоростью, необходимы и повешенные температуры. Увеличение давления компенсирует отрицательное влияние высоких температур на смещение равновесия реакции в обратную сторону. На практике синтез карбамида проводят при температурах 150-190 С и давление 15-20 МПа. В этих условиях реакция протекает с высокой скоростью и до конца. Разложение карбомата аммония – обратимая эндотермическая реакция, интенсивно протекающая в жидкой фазе. Чтобы в реакторе не происходило кристаллизации твердых продуктов, процесс необходимо вести при температуре ниже 98С (эвтектическая точка для системы CO(NH2 )2 - NH2 COONH4 ). Более высокие температуры смещают равновесие реакции вправо и повышают ее скорость. Максимальная степень превращения карбамата в карбамид достигается при 220С. Для смещения равновесия этой реакции вводят также избыток аммиака, который связывая реакционную воду, удаляет ее из сферы реакции. Однако добиться полного превращения карбамата в карбамид все же не удается. Реакционная смесь по мимо продуктов реакции (карбамида и воды) содержит также карбамат аммония и продукты его разложения – аммиак и СО2 . Для полного использования исходного сырья необходимо либо предусмотреть возвращение непрореагировавших аммиака и диоксида углерода, а также углеаммонийных солей (промежуточных продуктов реакции) в колонну синтеза, т.е. создание рецикла, либо отделение карбамида от реакционной смеси и направление оставшихся реагентов на другие производства, например на производство аммиачной селитры, т.е. проведение процесса по открытой схеме. 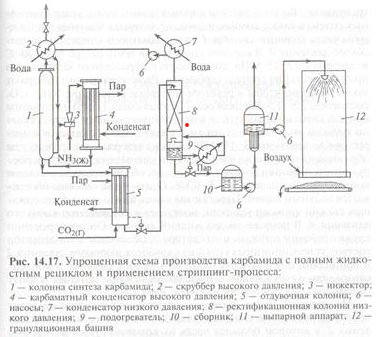 Рис 3 В крупнотоннажном агрегате синтеза карбамида с жидкостным рециклом и применением стриппинг-процесса (рис. 3) можно выделить узел высокого давления, узел низкого давления и систему грануляции. Водный раствор карбамата аммония и углеаммонийных солей, а также аммиак и диоксид углерода поступают в нижнюю часть колонны синтеза 1 из карбаматного конденсатора высокого давления 4. В колонне синтеза при температуре 170-190С и давлении 13-15 МПа заканчивается образование карбамата и протекает реакция синтеза карбамида. Расход реагентов подбирают таким образом, чтобы в реакторе молярное отношение NH3 :CO2 составляло 2,8-2,9. Жидкая реакционная смесь (плав) из колонны синтеза карбамида поступает в отдувочную колонну 5, где стекает по трубам вниз. Противотоком к плаву подают сжатый в компрессоре до давления 13-15МПа диоксид углерода, к которому для образования пассивирующей пленки и уменьшения коррозии оборудования добавлен воздух в количестве, обеспечивающем в смеси концентрацию кислорода 0,5-0,8%. Отдувочная колонна обогревается водяным паром. Парогазовая смесь из колонны 5, содержащая свежий диоксид углерода, поступает в конденсатор высокого давления 4. В него же вводят жидкий аммиак. Он одновременно служит рабочим потоком в инжекторе 3, подающем в конденсатор раствор углеаммонийных солей из скруббера высокого давления 2 и при необходимости часть плава из колонны синтеза. В конденсаторе образуется карбамат. Выделяющуюся при реакции теплоту используют для получения водяного пара. Из верхней части колонны синтеза непрерывно выходят непрореагировавшие газы, поступающие в скруббер высокого давления 2, в котором большая часть их конденсируется вследствие водного охлаждения, образуя раствор карбамата и углеаммонитйных солей. Водный раствор карбамида, выходящий из отдувочной колонны 5, содержит 4-5% карбамата. Для окончательного его разложения раствор дросселируют до давления 0,3-0,6 МПа и затем направляют в верхнюю часть ректификационной колонны 8. Жидкая фаза стекает в колонне вниз по насадке противотоком к парогазовой смеси, поднимающейся снизу вверх. Из верхней части колонны выходят NH3 ,CO2 и водяные пары. Водяные пары конденсируются в конденсаторе низкого давления 7, при этом растворяется основная часть аммиака и диоксида углерода. Полученный раствор направляют в скруббер 2. Окончательная очистка газов, выбрасываемых в атмосферу, проводится абсорбционными методами. 70%-ный раствор карбамида, выходящий из нижней части ректификационной колонны 8, отделяют от парогазовой смеси и направляют после снижения давления до атмосферного сначала на выпарку, а затем на грануляцию. Перед распылением плава в грануляционной башне 12 к нему добавляют кондиционирующие добавки, например мочевиноформальдегидную смолу, чтобы получить неслеживающееся удобрение, не портящееся при хранении. отходы при при производстве и их улитаз При производстве фосфорных удобрений велика опасность загрязнения атмосферы фтористыми газами. Улавливание соединений фтора важно не только с точки зрения охраны окружающей среды, но также и потому, что фтор является ценным сырьем для получения фреонов, фторопластов, фторкаучуков и т.д. Соединения фтора могут попасть в сточные воды на стадиях промывки удобрений, газоочистки. Целесообразно для уменьшения количества таких сточных вод создавать в процессах замкнутые водооборотные циклы. Для очистки сточных вод от фтористых соединений могут быть применены методы ионного обмена, осаждения с гидроксидами железа и алюминия, сорбции на оксиде алюминия и др. Сточные воды производства азотных удобрений, содержащие аммиачную селитру и карбамид, направляют на биологическую очистку, предварительно смешивая их с другими сточными водами в таких соотношениях, чтобы концентрация карбамида не превышала 700мг/л, а аммиака – 65-70мг/л. Важной задачей в производстве минеральных удобрений является очистка газов от пыли. Особенно велика возможность загрязнения атмосферы пылью удобрений на стадии грануляции. Поэтому газ, выходящий из грануляционных башен, обязательно подвергается пылеочистке сухими и мокрыми методами. Калийные удобрения. Характеристика отходов Основным калийным удобрением является хлорид калия — КС1. Его получают из минерального сырья — сильвинита. Россия является крупнейшим в мире производителем калийных удобрений. Сильвинит представляет собой механическую смесь хлоридов калия и натрия, в качестве примесей он имеет нерастворимый осадок (н.о.) и CaS04. Основными отходами процесса производства хлорида калия являются солевые, галитовые, глинистые шламы, сточные воды и минерализованные рассолы шламохранилищ, отходящие газы со стадии сушки. вердые отходы. Глинисто-солевые шламы представляют собой суспензию н.о. в минерализованном рассоле. Отношение Ж:Т = = 1,7 —2,5. Состав рассола, масс. %: КС1 — 10— 11, NaCl — 20—22. Твердая фаза состоит из мелкодисперсных частиц песка, глины и других включений. В настоящее время ни один из методов утилизации шламов не реализован в промышленном масштабе. Одним из препятствий является его повышенная влажность— 70—80%, мелкодисперс- ность и высокая вязкость. Шламы с помощью гидротранспорта подают в шламохранили- ща. Шламохранилища обносят дамбами, углубляют на 20 — 40 м в целях экономии площадей и снабжают полиэтиленовыми экранами. Они являются источниками загрязнения окружающей среды и требуют постоянного наблюдения. Интересны работы по сухому освобождению сильвинита от шламов. Метод основан на ферромагнитных свойствах оксида железа Fe203, концентрация которого в составе н.о. достигает 5 — 7%. По предлагаемому способу сильвинит измельчают, нагревают при температуре 150— 160 °С в течение 15 мин и помещают в магнитное поле. Степень извлечения н.о. достигает 81 %. Общая степень извлечения КС1 также увеличивается. Сухие глинистые шламы могут быть использованы в качестве калий-магниевых удобрений на песчаных почвах. Галитовые отходы. На каждую тонну хлорида калия образуется —3 т галитовых отходов, основным компонентом которых является хлорид натрия. Кроме того, в отходах содержатся небольшое количество КС1, MgCl2, CaS04, соединения брома, н.о. От вал представляет собой зернистую сыпучую массу, в которой находится до 10 % маточного раствора. Галитовые отходы, полученные после проведения флотации, содержат органические добавки. Одной из основных областей утилизации галитовых отходов является переработка их на техническую или пищевую поваренную соль. В г. Мозыре (Белоруссия) работает завод по получению поваренной соли из галитовых отходов ПО «Белорускалий». Солевые отходы используются в качестве сырья для получения поваренной соли на заводах в Италии и во Франции (до 10 % общего количества). Использование отходов, полученных флотационным методом, для производства поваренной соли, вызывает сомнения, так как в NaCl переходят органические добавки, применяемые при проведении основного процесса. Жидкие и газовые выбросы. В производстве калийных удобрений образуются минерализованные рассолы. Они получаются при обезвоживании свежих галитовых отходов и в результате их растворения при хранении. Общее содержание солей в них составляет 300 — 350 г/л, в том числе соединений брома — 0,5 г/л. Очистка минерализованных вод признана нерациональной. Одним из наиболее перспективных методов, применяемых в России и за рубежом, является закачка их в подземные глубинные горизонты. Такая технология осуществляется в Германии, Франции, США, ЮАР. В этих странах созданы специальные службы для автоматизированного сброса сточных вод и контроля за состоянием подземных вод. Отходящие газовые выбросы образуются на стадии сушки гранул КС1. Они содержат продукты сгорания топлива (S02, СО, С02, оксиды азота) и технологические газовые примеси — НС1, пыль. Очистка от пыли проводится в циклонах, обезвреживание от токсичных примесей S02, НС1 — в пенных промывателях. При производстве крупнозернистого удобрения очистку газов ведут в батарейном циклоне и промывателе. В случае производства мелкозернистого КС1 унос пыли достигает 10 — 20%, поэтому необходима двухступенчатая очистка в циклонах с последующей доочисткой в скрубберах. Применение двухступенчатой технологии позволяет получить степень очистки от пыли 98 %, а от токсичных примесей — 97 %. Фосфорные удобрения. Характеристика отходов Мировое производство фосфорных удобрений составляет около 200 млн т в год. Фосфорные удобрения — это фосфаты кальция, аммония, комплексные и сложные удобрения. Технология получения фосфорсодержащих удобрений основана на разложении природного сырья кислотами (фосфорной, серной, реже азотной) или на термическом разложении сырья В СССР была предложена схема комплексной переработки фосфогипса (см. рис. 4). 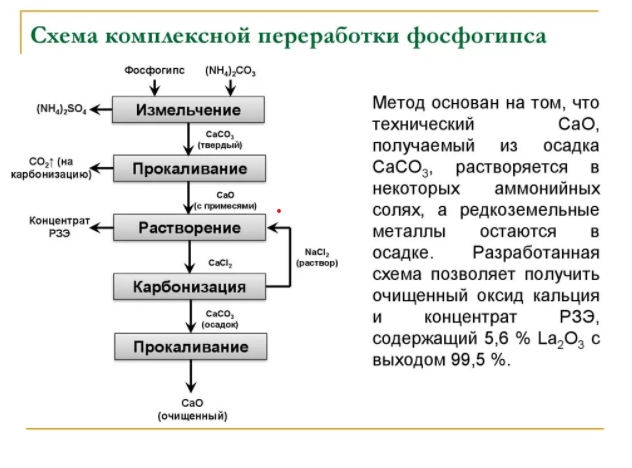 Метод основан на том, что технический СаО, получаемый из осадка СаС03, растворяется в некоторых аммонийных солях, а редкоземельные металлы остаются в осадке. Разработанная схема позволяет получить очищенный оксид кальция и концентрат РЗЭ, содержащий 5,6 % La203 с выходом 99,5 %. Складирование фосфогипса. В настоящее время в мире перерабатывают около 2 % производимого фосфогипса. Основное его количество удаляют в отвалы. Складирование фосфогипса производится либо в наземных отвалах, либо в специальных прудах-отстойниках (см. рис. 6.6). Транспортирование фосфогипса, устройство экранов под отвалами, нейтрализация образующихся при хранении фосфогипса сточных вод связаны с большими капитальными затратами. Жидкие отходы. Для получения 1 т Р205 в виде 54 %-го раствора фосфорной кислоты расходуется около 220 м3 воды. Около 95 % этого количества идет на охлаждение оборудования. Такая вода (чистый сток) используется в замкнутой водооборотной системе. Остальная вода поступает с технологических операций. Она загрязнена соединениями фосфора и фтора. В России разработан способ очистки технической воды с возвратом части ее в производственный процесс. Технологическая схема реализована и эксплуатируется на ОАО «Минудобрения» в г. Воскресенске (рис. 11.20). Сточные воды собирают в сборниках сточных вод /, затем их направляют в смесители 3, нейтрализуют суспензией Са(ОН)2 и отстаивают в отстойниках 6. Шлам отфильтровывают в барабанных вакуум-фильтратах 7и направляют в отвал. Вода из отстойников поступает в технологический цикл, а фильтрат расходуют на приготовление известкового молока. По принятой технологии получают воду, содержащую повышенные концентрации примесей, особенно по фтору. Такая вода Рис, 6. Схема обработки кислых фторсодержащих сточных вод в производстве экстракционной фосфорной кислоты 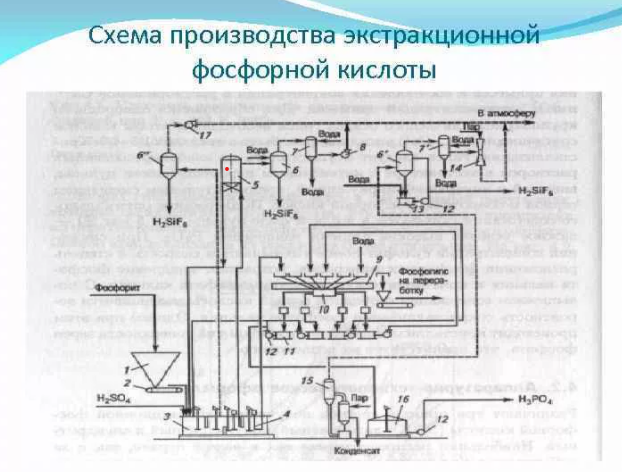 Карбонатный способ доочистки от примеси фтора прошел промышленные испытания. Он заключается в том, что в сточную воду вводят Са(ОН)2 и С02 при pH 7 — 7,5, в результате чего происходит совместное соосаждение СаС03 и соединений фтора. При организации замкнутых водооборотных технологических циклов объем сточных вод, нуждающихся в доочистке, невелик, поэтому карбонатный метод признан перспективным. Двухступенчатая очистка обеспечивает достижение остаточных концентраций по фосфору и фтору на уровне ПДК. Газовые выбросы. При переработке фосфатного сырья в удобрения происходит выделение газообразных фтористых соединений. Количество и состав газовой фазы зависят от технологии обработки фосфатного сырья. Отходящие газы содержат фтористые соединения в виде HF и SiF4. Вода является хорошим абсорбентом этих газов. Поэтому основной способ очистки газов при производстве минеральных удобрений — абсорбция. Введение в раствор добавок (солей, щелочей и т.д.) способствует уменьшению парциального давления этих газов над растворами и способствует более глубокой очистке. В результате водной абсорбции образуется 10—12%-я кремнефтористоводородная кислота, которая является вторичным сырьем и может быть утилизирована для производства ряда продуктов народнохозяйственного назначения. Масштабы производства фторида алюминия и криолита из отходящих газов сдерживает небольшой спрос на эти продукты. Поэтому в последние годы уделяют особое внимание разработке аммонийных методов, позволяющих получать модификацию A1F3, которая используется в качестве катализатора процессов изомеризации и полимеризации олефинов, а также в процессе крекинга. Сущность процесса, разработанного фирмой «UKF» (Нидерланды), состоит в том, что первоначально получают аммонийный криолит с последующим его превращением в модифицированный a-AlF3. Наибольшее значение получили методы переработки кремнефтористоводородной кислоты в плавиковую кислоту или в безводный фторид водорода. Эти вещества являются востребованным сырьем для производства различных фторидов, используемых в ка- честве катализаторов (HF — сырье для получения фторидов урана, безводный фторид водорода — основной реагент при производстве фторорганических соединений). Бифторид натрия, содержащийся в растворе, утилизируют путем превращения его в криолит. Наиболее простой путь получения фторида кальция из кремнефтористоводородной кислоты — нейтрализация ее известняком. Этот способ используется в промышленном масштабе фирмой «Bauer/Kalichemie» (Германия). Кислоту нейтрализуют суспензией известняка в системе последовательно установленных реакторов. Осадок CaF 2 отделяют от раствора, сушат и складируют. Продукт содержит примеси Si02 в количестве 2,5 —3,5 % и некоторые другие примеси, присутствующие в известняке. Полученный продукт можно использовать для производства HF. Основные преимущества процесса — возможность применения низкоконцентрированной H2SiF6, невысокие капитальные затраты. Продукт может длительное время храниться на складе, не создавая дополнительных загрязнений. Заключение Таким образом, применение минеральных удобрений является фундаментальным преобразованием в сфере производства вообще и главное в земледелии, что позволяет коренным образом решать проблему продовольствия и сельскохозяйственного сырья. Без применения удобрений сейчас сельское хозяйство немыслимо. При правильной организации и контроле применения минеральные удобрения не опасны для окружающей среды, здоровья человека и животных. Оптимальные научно-обоснованные дозы увеличивают урожайность растений и повышают количество продукции. Заключение С каждым годом агропромышленный комплекс все больше и больше прибегает к помощи современных технологий с целью увеличить продуктивность почвы и урожайность культур, не задумываясь при этом, какое влияние оказывают они на качество того или иного продукта, здоровье человека и окружающую среду в целом. В отличие от аграриев экологи и медики всего мира ставят под сомнение чрезмерное увлечение биохимическими новинками, которые буквально оккупировали рынок сегодня. Производители удобрений друг поперек дружки расписывают преимущества собственного изобретения, ни слова не упомянув о том, что неправильное или чрезмерное внесение удобрений может иметь пагубное влияние на почву. Специалисты давно установили, что избыток удобрений приводит к нарушению экологического равновесия в биоценозах почв. Химические и минеральные удобрения, особенно нитраты и фосфаты, ухудшают качество пищевых продуктов, а также существенно влияют и на здоровье человека, и на стабильность агроценозов. Особое опасение у экологов вызывает то, что в процессе загрязнения почвы нарушаются биогеохимические циклы, что в последствие приводит к обострению общей экологической обстановки список литиратуры 1. А.М. Кутепов и др. Общая химическая технология: Учеб. для вузов/А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен.- 3-е изд., перераб. – М.: ИКЦ «Академкнига». 2003. – 528с. 2. И.П. Мухленов, А.Я. Авербух, Д.А Кузнецов, Е.С. Тумаркина, И.Э. Фурмер. Общая химическая технология: Учеб. для химико-техн. спец. вузов. В 2х томах. Т.2. Важнейшие химические производства/ И.П. Мухленов, А.Я. Кузнецов и др.; Под ред. И.П. Мухленова. – 4-е изд., перераб. и доп. – М.: «Высш. шк.», 1984.-263 с., ил. 3. Бесков В. С. Общая химическая технология: Учебник для вузов. – М.: ИКЦ «Академкнига», 2005. -452с.: ил 4. Акимова Т. А., Хаскин В. В. Экология. Человек – Экономика – Биота – Среда. – М., 2001 5. Вальков В. Ф., Штомпель Ю. А., Тюльпанов В. И. Почвоведение (почвы Северного Кавказа). – Краснодар, 2002. 6. А.А. Дрейер, А.Н. Сачков, К.С. Никольский, Ю.И. Маринин, А.В. Мронов. «Твердые промышленные и бытовые отходы, их свойства и переработка», 1997. |
