Содержание
Введение
. Технологическая часть
.1 Выбор метода производства (или выделение) готового продукта
.2 Теоретические основы процесса. Выбор оптимальных параметров
.3 Характеристика исходного сырья и готовой продукции, ГОСТы
1.3.1 Исходное сырье
.3.2 Готовая продукция
.3.3 Катализаторы
.3.4 Вспомогательные материалы
.3.5 Побочные продукты
.4 Описание технологической схемы установки. Нормы технологического режима
.5 Конструкция основного аппарата и вспомогательного оборудования
.6 Автоматизация производства. Аналитический контроль. Отходы производства
.7 Охрана труда и промышленная экология
. Расчетнкая часть
.1 Материальный баланс
.2 Тепловой баланс
.3 Конструктивный расчет
.4 Экономический расчет
Заключение
Список используемых источников
Введение
В настоящее время азотная кислота является одним из исходных продуктов для получения большинства азотсодержащих продуктов. Основная ее часть (до 70%) расходуется на производство удобрений. В производстве минеральных удобрений используется неконцентрированная азотная кислота концентрацией 47-60%. Мощности по производству неконцентрированной азотной кислоты, как правило, сбалансированы с мощностями переработки - производством нитрата аммония (аммиачная и известково-аммиачная селитра, растворы КАС, плав аммиачной селитры) и сложных удобрений, получаемых азотно-кислотным или азотно-сернокислотным разложением фосфатного сырья. Небольшая часть неконцентрированной азотной кислоты используется также для получения концентрированной азотной кислоты и для других целей.
Лидирующее положение в мире по имеющимся мощностям в производстве азотной кислоты занимают: Российская Федерация, Западная Европа, Центральная Европа и Северная Америка. На их долю приходится около 80% мировых мощностей. В настоящее время и по мощностям, и по производству азотной кислоты Россия занимает первое место в мире, ее доля составляет 17%. Второе место в мировом производстве азотной кислоты принадлежит США. Значительными мощностями располагают: Китай, Румыния, Нидерланды, Франция, Украина и Узбекистан.
Структура производства неконцентрированной азотной кислоты по технологическим процессам за последние 30 лет ХХ века претерпела существенные изменения. В конце 80-х и в начале 90-х годов ХХ века были выведены из эксплуатации старые производства под атмосферным давлением.
Мировое производство азотной кислоты в обозримой перспективе стабилизируется на достигнутом уровне или немного снизится, так как нитратный азот как удобрение популярен по преимуществу в странах с коротким вегетативным периодом, то есть главным образом в развитых странах Европы и Северной Америки. Нарастающее ужесточение экологических требований в этих регионах не позволяет надеяться на увеличение норм внесения азотных удобрений под сельскохозяйственные культуры в этой части мира. Более того, последнее десятилетие характеризовалось снижением потребления минеральных удобрений в Западной Европе.
В сельском хозяйстве России основным одинарным азотным удобрением является аммиачная селитра. И сегодня это удобрение составляет основную долю в поставках азотных удобрений нашему сельскому хозяйству. К сожалению, в России нынешние фактические нормы внесения удобрений в почву многократно ниже агрохимически обоснованных. Это приводит к нарастающей деградации почвы и снижению урожайности культур, как в количественном, так и в качественном отношении. Такая ситуация не может продолжаться вечно. Таким образом, в обозримой перспективе будет нарастать увеличение доли поставок азотных удобрений отечественному сельскому хозяйству за счет улучшения использования мощностей (включая мощности производства азотной кислоты).
Следовательно необходимо повысить мощность производства азотной кислоты. Для этого целесообразно строительство новых цехов азотной кислоты.
1. Технологическая часть
1.1 Выбор метода производства (или выделение) готового продукта
азотный кислота производство
Современные методы производства азотной кислоты основаны на применении синтетического аммиака и воздуха.
Многолетние поиски новых промышленных методов (связывание атмосферного азота в высокочастотном разряде; термическим способом, основанный на использовании тепла сгорания газов, например метана при температуре выше 2200°С) пока не дали результатов, позволяющих осуществить их реализацию в промышленных масштабах. По этим методам получаются оксиды азота сравнительно низкой концентрации, обычно она составляет 1,5 - 2% NO, поэтому переработка их в азотную кислоту связана со значительными затратами и усложнением технологического и конструктивного оформления производственного процесса.
Промышленные системы производства неконцентрированной азотной кислоты различаются главным образом по давлению, при котором осуществляются основные стадии процесса.
В зависимости применяемого давления их можно условно подразделить на следующие группы:
1) системы, работающие под единым давлением 0,73 МПа единичной мощностью 360 т/сутки (агрегаты УКЛ-7);
2) системы, работающие по комбинированной схеме с конверсией аммиака под атмосферным давлением и абсорбцией оксидов азота под давлением 0,35 МПа единичной мощностью 135 т/сутки (агрегаты 1/3,5);
3) системы, работающие крупнотоннажные агрегаты по комбинированной схеме с конверсией аммиака под давлением 0,4 МПа и абсорбцией оксидов азота под давлением 1,1 МПа единичной мощностью 1200 т/сутки (агрегаты АК-72 и АК-72М).
К достоинствам систем работающих при повышенном давлении, следует отнести значительно меньшие капитальные затраты при строительстве, выпуск более концентрированной азотной кислоты (на 6 - 8% выше, чем в системах, работающих при атмосферном давлении); возможность ввода в эксплуатацию отдельных агрегатов системы, что позволяет получать азотную кислоту задолго до полного завершения строительства цеха.
В комбинированных системах достигается высокая степень конверсии аммиака в диоксид азота и меньше потери катализатора, чем в системах, работающих при повышенном давлении; несложное обслуживание этих систем на стадии получения оксидов азота, которая проводится при атмосферном давлении. К недостаткам комбинированных систем следует отнести большие размеры контактного аппарата; большее количество агрегатов по сравнению с системами, работающими при повышенном давлении.
К недостаткам схем АК - 72 относится использование реактора каталитической очмстки в период пуска агрегата в качестве камеры сгорания для подъема температуры от 480 до 650 - 750 °С, что приводит к быстрому "старению" катализатора АПК - 2. В результате "старения" берется его активность при работе в окислительнойсреде (на воздухе), что затрудняет пуск агрегата.
В данном дипломном проекте выбранна система, работающая под единым повышенным давлением 0,73 МПа.
.2 Теоретические основы процесса. Выбор оптимальных параметров
Процесс производства азотной кислоты под повышенным давлением состоит из двух основных стадий: окисление аммиака до оксида азота и его переработка с образованием азотной кислоты. Вторая стадия включает окисление оксида азота и последующее поглощение их водой.
Стадия окисление аммиака в оксид азота в общем виде выражается уравнением:
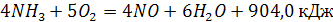 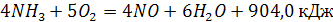 (1) (1)
Стадия окисления оксида азота в высшие оксиды азота и переработка их в азотную кислоту осуществляется согласно реакциям:
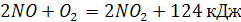 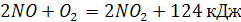 (2) (2)
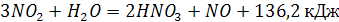 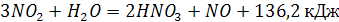 (3) (3)
Суммарную реакцию без учета побочных реакций, проходящих с образованием элементарного азота и других соединений,представляют в виде:
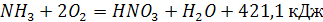 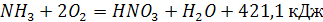 (4) (4)
Теоретические основы процесса проектируемого узла (отделения)
Каталитическое окисление аммиака является сложным процессом и может с одинаковой степенью вероятности протекать как до целевого продукта диоксида азота, так и до молекулярного азота и оксида азота.
В общем виде протекающие реакции описываются уравнениями:
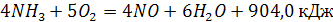 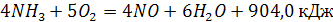 (1) (1)
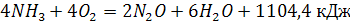 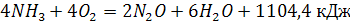 (5) (5)
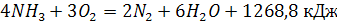 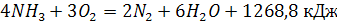 (6) (6)
Кроме основных реакций (1), (5), (6), в зависимости от условий окисления аммиака протекать несколько последовательных и параллельно-паследовательных реакций. Все они приводят к образованию молекулярного азота.
Так, образовавшийся по реакции (1) диоксид азота разлагаться по реакции
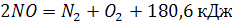 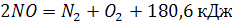 (7) (7)
или взаимодействует с аммиаком:
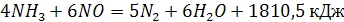 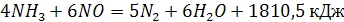 (8) (8)
Аммиак, поступающий с аммиачно-воздушной смесью (АВС), разлагается до молекулярных азота и водорода, причем последний затем сгорает с образованием паров воды:
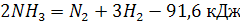 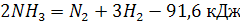 (9) (9)
Таким образом, для проведения процесса окисления аммиака с целью получения оксида азота нужен не только активный, но и весьма селективный катализатор. Особенностью катализатора, обладающего избирательными действиями, заключается в ускорении лишь одной из нескольких возможных реакций. Изменяя катализатор и условия проведения реакции, можно изменить и состав продуктов реакции.
Для осуществления реакции необходимо, чтобы реакционная система прошла через состояние повышенной энергии, т. е. через энергетический барьер, определенный энергией активации.
Наиболее перспективным катализатором для данного процесса является платина.
Платина проявляет высокую каталитическую активность в реакции (1), обеспечивается при 600 - 1000°С высокий выход оксида азота (до 99°С) при времени реакции около 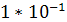 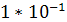 с. Одновременно с этим платина имеет низкую температуру инициирования реакции (195 - 200°С), имеет хорошую пластичность, ковкость и тягучесть, что делает сплавы на основе платины непревзойденными катализаторами окисления аммиака. Недостатком платины является ее склонность к разрушению при температурах конверсии под воздействием реакционной смеси и подверженность влиянию большого количества ядов. По этим причинам испытаны и в значительной степени запатентованы в качестве катализаторов окисления аммиака сплавы с различными металлами. с. Одновременно с этим платина имеет низкую температуру инициирования реакции (195 - 200°С), имеет хорошую пластичность, ковкость и тягучесть, что делает сплавы на основе платины непревзойденными катализаторами окисления аммиака. Недостатком платины является ее склонность к разрушению при температурах конверсии под воздействием реакционной смеси и подверженность влиянию большого количества ядов. По этим причинам испытаны и в значительной степени запатентованы в качестве катализаторов окисления аммиака сплавы с различными металлами.
Признание и распространение в качестве катализаторов получили сплавы с родием, палладием и рутением. Они обладают высокой (>1500°С) температурой плавления, легко поддаются механической обработке, ковке, а Pd и Pt - еще и сварки. С платиной металлы Rh, Pd и Ru образуют сплавы в идее непрерывного ряда твердых растворов. Эти сплавы обладают лучшими механическими свойствами по сравнению с чистой платиной.
В производстве азотной кислоты платиноидные катализаторы применяются в виде сеток. Эта форма удобна в эксплуатации, характеризуется минимальным вложением платиноидов, позволяет применять наиболее простой и удобный в эксплуатации тип контактного аппарата и обеспечивает высокую поверхность соприкосновения газа с катализатором.
Практически все эти реакции могут считаться необратимыми. При нормальных условиях небольшую термодинамическую вероятность имеет реакция (6), поэтому при поджигании факела аммиака он горит на воздухе с образованием молекулярного азота.
Процесс окисления аммиака с точки зрения адсорбционно-химической теории катализа можно представить следующим образом. Кислород и аммиак диффундируют из газовой смеси к поверхности катализатора. Вследствие высокой температуры контактирования ковалентная связь между атомами в молекулах этих газов ослаблена. Так как скорость диффузии кислорода выше скорости диффузии аммиака, в первую очередь происходит активированная адсорбция кислорода, сопровождаемая образованием электронной связи с атомами платины, имеющий свободные валентности. В результате возникает комплекс катализатор - кислород.
Образование молекулярного азота происходит при неполном покрытии поверхности катализатора кислородом (недостаток кислорода в газе) и за счет протекания побочных реакций в объем за катализатором.
Ряд исследований показал, что процесс каталитического окисления аммиака имеет диффузионный характер.
Для реакции каталитического окисления аммиака характерны зависимости скорости от линейной скорости газа, незначительное время контактирования (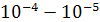 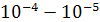 ), относительно низкая энергия активации (до 2,5 кДж/моль), что свойственно диффузионным процессам. ), относительно низкая энергия активации (до 2,5 кДж/моль), что свойственно диффузионным процессам.
Остальное время контактирования может быть представлено как отношение свободного объема катализатора (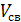 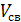 , , 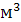 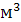 ), и объемной скорости газа в условиях конверсии ( ), и объемной скорости газа в условиях конверсии (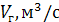 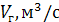 ). ).
Изучение кинетики окисления аммиака до оксида азота сильно осложняется протеканием параллельных побочных реакций, конечным продуктом большинства из которых является молекулярный азот.
Реакция разложения оксида азота может протекать сразу после появления NO в газе, но скорость этой реакции намного меньше скоростей реакций (1), (5),(6). Поэтому ее влияние наблюдается на участке кинетической кривой после максимума.
Наиболее существенным параметром, оказывающим значительное влияние на выход оксида азота, является температура.
Появление оксида азота на платиноидных катализаторах наблюдаются при температурах около 300°С. При дальнейшем повышении температуры, выход оксида азота увеличивается как за счет уменьшения проскока аммиака, так и в результате снижения содержания в продуктах реакции 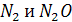 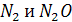 , т. е. при проявлении катализатором большей селективности к реакции (5). Максимальный выход , т. е. при проявлении катализатором большей селективности к реакции (5). Максимальный выход 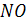 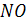 наблюдается при 900 - 920 °С. На чистой платине он достигает 96 %, на сплавах Pt - Rh - Pd - Ru - 99 % (рисунок 4). При этих температурах вторым продуктом окисления является азот. наблюдается при 900 - 920 °С. На чистой платине он достигает 96 %, на сплавах Pt - Rh - Pd - Ru - 99 % (рисунок 4). При этих температурах вторым продуктом окисления является азот.
Значительное влияние на выход оксида азота оказывает концентрация кислорода в АВС. При использовании воздуха максимально возможной концентрацией аммиака в АВС, при которой достигается высокие выходы оксида азота, является 11,0 - 11,5 % и [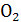 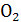 ] : [ ] : [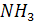 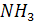 ] ] 1,7, причём это характерно для температур 870 - 900 °С. При более низких температурах (750 - 800 °С) содержание 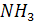 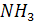 в АВС должно быть снижено примерно до 10 %. в АВС должно быть снижено примерно до 10 %.
Как правило, выход NO при проведении процесса конверсии под давлением несколько ниже, чем в сравнимых условиях при атмосферном давлении. Снижение степени конверсии вызывается не самим фактором повышения давления, а предкатализом, более резко выраженным влиянием каталитических ядов, увеличение напряжённости катализатора и некоторыми другими явлениями.
При повышении давления необходимое время контактирования возрастает и тем больше, чем ниже температура. Оптимальное время контактирования не изменяется при изменении концентрации аммиака и числа сеток.
Повышение давления в процессе конверсии позволяет увеличивать линейную скорость и напряжённость катализатора. Изменение этих параметров требует увеличения числа катализаторных сеток.
Несомненное влияние на выход оксида азота имеет линейная скорость газа. В условиях процесса окисления аммиака её влияние не равноценно влиянию времени контактирования, вследствие, одновременного протекания ряда других параллельных и последовательных реакций с участием аммиака, кислорода и диоксида азота.
Естественно, невозможно уменьшать напряжённость и линейную скорость газа до безгранично малых значений, т. к. при этом увеличиваются капитальные вложения в узле конверсии, возрастает обратная диффузия аммиака и возникает вероятность воспламенения АВС.
При окислении аммиака , как и во всем каталитическом процессе, платиноидный катализатор подвергается воздействию реакционной среды. Вследствии высоких температур, присутствие химических реакций окисления аммиака, воздействия примесей, поступающих с газами, и других явлений происходит изменение структуры катализаторных сеток, в частности, разрыхление их поверхности, увеличение размеров кристаллов и т. д. эти изменения, приводящие к потерям массы катализатора, зависят как от технологических условий процесса, так и от физико-химических свойств сплава сеток.
Окисление платины происходит по реакции:
|
 Скачать 5.75 Mb.
Скачать 5.75 Mb.