Производство лечебно-профилактических сывороток. Производство лечебнопрофилактических
 Скачать 199.5 Kb. Скачать 199.5 Kb.
|
|
Федеральное Государственное Образовательное Учреждение Высшего Профессионального Образования «Московская Государственная Академия Ветеринарной Медицины и Биотехнологии им. К.И. Скрябина» Кафедра Биотехнологии. Курсовая работа. Тема: Производство лечебно-профилактических сывороток.
Москва 2007год. Содержание.
1.Введение. Первую вакцину изобрел английский ученый Эдуард Дженнер (XVIII в.). Он заметил, что доярки, доившие коров, больных оспой, у которых на вымени были оспенные пузырьки, гораздо реже болели натуральной оспой. Дженнер взял жидкость из оспенных пузырьков коров и втер ее под кожу мальчику. Через некоторое время он заразил этого мальчика натуральной оспой, но мальчик не заболел. Дело в том, что вирус коровьей оспы, неопасный для человека, вызвал в организме пациента появление антител, нейтрализующих вирус черной оспы. Продолжил дело Э. Дженнера французский микробиолог Луи Пасте р. Он первый понял, что возбудителями инфекционных болезней являются микробы и что после перенесения болезни человек, как правило, не болеет. Пастер предположил: если удастся ослабить микроорганизмы настолько, чтобы они могли вызвать заболевание человека лишь в легкой форме, то человек, перенесший эту искусственную легкую болезнь, окажется защищенным от микробов, вызывающих то же натуральное заболевание. Опыты подтвердили эту мысль. Препараты из ослабленных микробов (или их ядов) стали называть вакцинами, что в переводе означает "коровьи", в память о первой коровьей вакцине, созданной Э. Дженнером. Процедура введения вакцины получила название прививки. После прививки иммунитет развивается в среднем в течение месяца. При введении вакцины организм самостоятельно вырабатывает антитела, но их можно вводить и в готовом виде. Особенно важно это в том случае, если заражение уже произошло и поэтому на предохранительную прививку уже нет времени. Лечебно-профилактические и диагностические иммунные сыворотки используют для профилактики инфекционных заболеваний, лечения больных, а также для серологических методов диагностики болезней. Гипериммунные сыворотки представляют собой сыворотки крови животных, систематически иммунизированных бактериальными или вирусными антигенами, содержащие антитела, обладающие строго специфическим действием на бактериальные токсины, патогенные бактерии или вирусы, против которых иммунизировали животных. Изготовление лечебно-профилактических гипериммунных сывороток представляет сложный, длительный и многогранный технологический процесс, в котором участвуют врачи-микробиологи, биотехнологи, биохимики, зооинженеры, рабочие-аппаратчики, работники электротехнической службы. Технология производства гипериммунных сывороток объединяет ряд подразделений биопредприятий, главным из которых является сывороточный цех. Классификация гипериммунных сывороток
Структура сывороточного цеха включает:
3.Антигенные лаборатории 4.Отделения получения, концентрирования и очистки сывороток. При создании гипериммунных сывороток требуются стерильные условия. Боксы должны обеспечиваться притоком стерильного воздуха. Рабочие места, стены, потолок, пол подвергаются влажной уборке с дезрастворами и УФ-облучения. Остальные помещения должны иметь приточно-вытяжную вентиляцию. Сжатый воздух, вакуум, холодная, горячая, дистиллированная, деминерализованная вода подаются по системе трубопроводов. В сывороточном цехе должны иметься автоклавные, термостатные, рефрижераторные помещения, холодильники. Основными задачами иммунизационных отделений являются:
Для приготовления гипериммунных сывороток чаще всего используют лошадей и крупный рогатый скот (волы). При производстве сыворотки против рожи используют свиней. Животных, применяемых для получения сывороток, завозят из стационарно благополучных по инфекционным болезням районов. Они должны быть клинически здоровыми, средней и выше средней упитанности, свободными от накожных паразитов. На получение высокоэффективных лечебно-профилактических сывороток влияют:
и концентрация);
Существует прямая связь между качеством антигена, силой антигенного раздражения и уровнем накопления специфических антител в крови животных. Для приготовления антигенов должны использоваться штаммы микроорганизмов, обладающие хорошо выраженными антигенными и иммуногенными свойствами. Качество антигенов зависит от следующих факторов:
При изготовлении гипериммунных сывороток применяют антигены, специфическое действие которых усилено адъювантными веществами, в качестве которых используют гель гидроокиси алюминия, алюминиевые квасцы и др. В практике производства антитоксических сывороток широко используют хлористый кальций, алюмокалиевые квасцы, адьюванты типа Фрейда, тапиока. При этом большое значение имеет качество адъювантов, которое зависит:
При получении большинства противовирусных гипериммунных сывороток используют антигены без адъювантов. 2. Отбор животных-продуцентов. Грундиммунизация Получение гипериммунных сывороток осуществляется в несколько этапов:
завезенных, путем создания у них основы иммунитета.
Подбор животных-продуцентов. Всех завезенных на биофабрику животных выдерживают в карантине 45 суток. За это время их всесторонне обследуют с ежедневным (утром и вечером) двукратным измерением температуры тела, проверяют на пораженность гельминтами и при необходимости дегельминтизируют. Всех животных исследуют на инфекционные болезни согласно требованиям нормативно-технической документации. Лошадей исследуют на сап, трихомоноз, бруцеллез, туберкулез, пироплазмидозы, инфекционную анемию; крупный рогатый скот -на туберкулез, бруцеллез, лептоспироз, лейкоз; свиней - на туберкулез, бруцеллез; овец - на бруцеллез, туберкулез, паратуберкулез и др. При отборе животных-продуцентов учитывают их физиологические и иммунобиологические показатели. На активность выработки животным-продуцентом гипериммунной сыворотки антител влияют:
Лошадей используют в возрасте от 3 до 12 лет, помеси донской и казахской пород, массой 450 — 500 кг; волов - в возрасте от 3 до 8 лет, массой не менее 350 кг, красностепной, калмыцкой, симментальской, швицкой астраханской пород; свиней - в возрасте 5-6 месяцев, массой не менее 80 кг, крупной белой породы; овец, баранов и валухов - в возрасте 2-3 лет и массой 30 - 45 кг (для получения диагностических сывороток и сывороточных сред). Учитывая, что введение антигенов животным и периодическое кровопускание приводят к нарушению обмена веществ и анемии (а в ряде случаев и к снижению титров антител), главное внимание уделяют вопросам полноценного, сбалансированного кормления животных-продуцентов, которое отличается от кормления других животных и осуществляется по специально разработанным и утвержденным рационам. Такие рационы должны содержать по 11 - 12 кормовых единиц и по 1000 - 1200 г переваримого протеина, а также включать сочно-витаминные корма и быть строго сбалансированными по минеральному составу. Для восстановления крови после крововзятия важно правильно организовать минеральное кормление животных. На 1 кг сухого корма лошадей должно приходиться: железа - 145 - 165 мг; меди- 15 - 18 мг; кобальта - 1,2 - 1,4 мг; марганца - 9 мг. Для восстановления красной крови лошадям вводят в рацион эритроциты, фибрин, кормовые антибиотики, проращенный овес. Иногда проводят реинфузию эритроцитов. Кормят животных-продуцентов 3-5 раз в день, водопой - вволю, соль лизунец - вволю (кроме свиней). Крупных животных содержат индивидуально, мелкий рогатый скот и свиней - группами. Грундиммунизация животных-продуцентов. Теоретически обосновано и практически целесообразно отбирать животных-продуцентов по иммунологическим показателям. Груидиммунизация (грундирование) - это метод отбора животных-продуцентов, обладающих высокой реактивностью организма и способных выработать антитела против введенного антигена в высоких титрах. При отборе животных-продуцентов их проверяют на наличие антител к тому или иному антигену серологическими методами. Например, отбор лошадей-продуцентов для производства противодифтерийной сыворотки проводится по титру естественного противодифтерийного анатоксина в крови животных, выявляемого в реакции нейтрализации. Если антител в крови животных не обнаруживают, их грундируют, т.е. вводят антиген и по нарастанию титра антител, в результате грундиммунизации, отбирают лошадей-продуцентов противостолбнячной, противоботулинической, противодифтерийной и других сывороток. При производстве гипериммунных сывороток против диплококковой инфекции используют волов. Если у волов в крови антитела к возбудителю диплококковой инфекции содержатся в титре 1:200 - 1:3200, то их не грундируют, а сразу используют для гипериммунизации. Если антител не обнаруживают вовсе, волов грундируют. Отбор волов и грундиммунизацию обычно проводят в местах заготовки животных. При проведении грундиммунизации животным дважды вводят убитый антиген или живые атенуированные микроорганизмы (убитые или живые вакцины) внутримышечно или подкожно с интервалом в 2 - 3 недели. До начала грундиммунизации и через 7 — 8 суток после последнего введения антигена у животных берут кровь и определяют в ее сыворотке наличие антител к тому антигену, с помощью которого в последующем готовят гипериммунную сыворотку. Выявление в сыворотке крови антител в титрах 1:800 и выше указывает на то, что данное животное может быть использовано как продуцент гипериммунной сыворотки, т.е. такое животное обладает высокой реактивностью организма и иммунная система его способна вырабатывать антитела в необходимых титрах. Кроме того, организм животного сенсибилизируется, «знакомится» с антигеном и при последующей гипериммунизации быстро ответит на введение антигена выработкой антител. Предварительное, правильно проведенное грундирование животных обеспечивает повышение (в 5 раз и более) титров специфических антител при последующей гиперимунизации тем же антигеном, увеличивает выход высокоактивного препарата и создает условия получения сывороток в более короткие сроки. Всех животных, у которых при грундиммунизации не обнаруживают антител или обнаруживают в титре менее 1:800, подвергают выбраковке. Гипериммунизация животных. Гипериммунизация - это метод парэнтерального введения животным нарастающих доз соответствующих антигенов с целью получения наивысшей ответной иммунологической реакции организма, а следовательно, и максимального увеличения в крови животных титра специфических антител, который должен обеспечить лечебный, профилактический и диагностический эффект препаратов. При гипериммунизации состав сыворотки крови меняется. Обычно нарастает количество общего белка, увеличивается количество гамма - и бета-глобулиновых фракций, уменьшается содержание альбуминов. Так, если в нормальной сыворотке крови лошадей альбумины составляют 50 % от общего количеств белков, то в иммунной сыворотке их бывает 35 % и ниже. Успех гипериммунизации животных-продуцентов во многом зависит не только от тщательного их подбора, качества антигена и адьювантных веществ, но и от правильно выбранной схемы гипериммунизации, правильной технологии выполнения этих схем, а также технологии кровопускания или обескровливания продуцентов в конце их эксплуатации. Антиген вводится обычно подкожно или внутримышечно в несколько мест с таким расчетом, чтобы точки инъекции находились вблизи лимфатических узлов. При этом в иммуногенез быстрее вовлекается большое количество лимфоузлов, что повышает общую и иммунологическую реактивность организма. Введение антигена одновременно в несколько мест обеспечивает лучшую рассасываемость его и появление более равномерных и менее болезненных инфильтратов. Антигены в небольших дозах (5 - 25 мл) обычно вводят подкожно в верхнюю часть шеи животного, а в больших количествах - в область спины и крупа внутримышечно. Места введения антигена или крововзятия протирают дезинфицирующими растворами. Для гипериммунизации, как было показано выше, чаще всего используют лошадей. Цикл гипериммунизации обычно длительный и составляет 1 - 2 и более месяцев. Впрочем, в каждом случае цикл иммунизации во многом зависит от вида получаемой гипериммунной сыворотки. Например, для получения гипериммунной противосибиреязвенной сыворотки используют лошадей в возрасте от 3 до 10 лет. Вначале здоровым животным вводят четырехкратно вакцину Ценковского II для создания стойкого иммунитета (грундиммунизация), а потом лошадей подвергают гипериммунизации вирулентной суточной бульонной культурой возбудителя сибирской язвы. Всего используют 12 вирулентных штаммов возбудителя, комбинируя их по четыре в виде смеси для каждой иммунизации. Гипериммунизацию лошадей начинают с малых доз: 0,5; 1,0; 2,5 и 5,5 мл с интервалом в трое суток. Затем культуры возбудителя сибирской язвы вводят с интервалами в 3 - 4 суток и в дозах 10,0; 20,0; 40,0; 80,0; 100,0; 110,0 120,0; 130,0; 140,0; 150,0 мл. Обычно бывает достаточным ввести антиген 13 раз и сыворотка лошадей-продуцентов становится активной. При введении доз от 10 до 80 мл к культуре добавляют 0,2 % алюминиевых квасцов, а к дозам от 100 до 150 мл - 0,1 % квасцов. При повышении у животных температуры тела интервал между инъекциями увеличивают до 4 или 5 суток. В каждом конкретном случае схемы иммунизации могут быть разными и отличаются одна от другой даже при получении одной и той же сыворотки. Специалисты сывороточного производства считают, что каждое животное отличается индивидуальной реактивностью организма и для него необходима своя, отдельная схема гипериммунизации. Разнообразие схем иммунизации определяется: различием методов введения антигена; дозировкой антигена; количеством инъекций; интервалами между инъекциями; объемом забираемой у животного крови; кратностью цикловых кровопусканий. По окончании гипериммунизации, когда в сыворотке крови животного установлен максимальный титр специфических антител, у него берут кровь обычно через 7-10 суток после последней инъекции антигена. Этот период соответствует максимальному накоплению антител в крови животных и полностью укладывается в закономерности иммуногенеза. Количество забираемой крови зависит: от массы животного; от привычки его к кровопотерям с учетом начального и последующих циклов; количества предполагаемых кровопусканий в данном цикле; количества титра антител; состояния здоровья животного. К взятию крови животных приучают постепенно. Обычно при каждом крововзятии кровь берут из яремной вены из расчета 800 мл на каждые 50 кг массы животного (или 13 % к общей массе крови животного). Многочисленные эксперименты и клинические исследования свидетельствуют о том, что гемодинамика, эритропоэз, лейкопоэз, регенерация сывороточных белков, функциональное состояние различных органов при кровопусканиях в значительной мере зависит от дозы и кратности взятия крови. Однократное кровопускание в дозах, не превышающих 1 % от массы тела животного, не вызывает заметных гемодинамических, гемоцитологических и биохимических сдвигов в ближайшие сроки от момента взятия крови. В то же время установлено, что двукратное кровопускание стимулирует образование иммуноглобулинов М (IgM), плазмоцитарную реакцию лимфоидных органов, влияет на уровень гамма- и бета-глобулинов, повышает синтез пропердина, лизоцима и бета-лизинов, увеличивает бактерицидность сыворотки крови и фагоцитарную активность лейкоцитов, повышает превентивные свойства сыворотки, а также сопротивляемость организма инфекции. Совершенно иным является эффект многократных взятий крови. Они приводят к изменению иммунных реакций. В частности, они стимулируют образование различных факторов иммунитета, но угнетают активность IgM-антител. Тотальное обескровливание проводят тогда, когда решается вопрос о прекращении использования животных как продуцентов. Обычно это делают в момент максимального накопления антител и появления тенденции снижения их синтеза. Перед тотальным взятием крови для получения её в наибольших количествах животным обычно вводят сердечные вещества. Но нужно отметить, что животные-продуценты могут пройти несколько циклов гипериммунизации (5 - 8) и решение вопроса о тотальном кровопускании принимается строго индивидуально. 3. Приготовление гипериммунных сывороток. Технологическая схема приготовления гипериммунных сывороток.
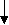 Сыворотку получают методом цитрирования крови с последующим сепарированием и дефибринированием плазмы. Сыворотку крови консервируют 0,5 %-ным раствором фенола и от полноты адсорбции антител. При получении большинства противовирусных гипериммунных сывороток используют антигены без адъювантов, отстаивают в специальных емкостях в течение двух месяцев. Отстоявшуюся сыворотку фильтруют вначале через пластины Ф, а затем через стерилизующие пластины СФ. В последующем сыворотку расфасовывают во флаконах емкостью по 100 мл. Флаконы закрывают пробками и для герметичности их обкатывают алюминиевыми колпачками. На флаконы наносят этикетку и часть продукции сдают на контроль. Гипериммунные сыворотки, получаемые из крови путем удалеформенных элементов и фибрина, называются нативными (в отличие сывороток, подвергнутых дополнительной очистке и концентрации специальными методами). Этапы получения гипериммунных сывороток.
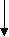  Принципы очистки сывороток основаны на выделении из них ак тивных белковых фракций (преимущественно гамма-глобулинов) и удалении балластных фракций, не являющихся носителями антител (например, альбумины). Выделенные фракции растворяют в меньшем объеме растворите ля, по сравнению с исходным объемом, что позволяет препарат сконцентрировать и вводить в меньших дозах. Необходимость в получении концентрированных сывороток связана:
В производственных условиях очистку и концентрацию сывороток проводят чаще всего комбинированным способом, включающим:
-дополнительное выдерживание сывороток при пониженных температурах. При такой обработке удаляется до 80 - 85 % балластных белков сыворотки. Кроме указанных методов очистки и концентрации сывороточных препаратов, гамма-глобулиновая фракция выделяется из сыворотки крови методом ультрафильтрации. Для этого используются ультрафильтрационные модули на полых волокнах, отличающихся пределом задержания по молекулярной массе: 5000, 15000, 50000, 100000 дальтон. В соответствии с этим, в биопромышленности используются модули УФУ-5, УФУ-15, УФУ-50, УФУ-100. Для задержания гамма-глобулинов лучше всего использовать УФУ100, обеспечивающую практически полную задержку гамма-глобулинов на фильтре, так как молекулярная масса гамма-глобулинов составляет 160000 - 900000 дальтон. Производственные опыты по ультрафильтрации сывороток дали возможность сконцентрировать их в 3 раза и практически без потерь иммуноглобулинового компонента. Это позволяет сократить объем сывороточных препаратов в 3 раза и во столько же раз повысить их удельную активность. Более того, ультрафильтрат, который в основном представлен альбуминовой фракцией, может быть использован в качестве компонента питательной среды для выращивания микроорганизмов, а также как протеиносодержащий препарат для лечения животных. Отечественный метод приготовления сыворотки, известный под названием «Диаферм-3» (диализ, ферментация), был разработан в 1954 г. и затем усовершенствовался. Метод «Диаферм-3» включает восемь стадий:
Линия производства сывороток. 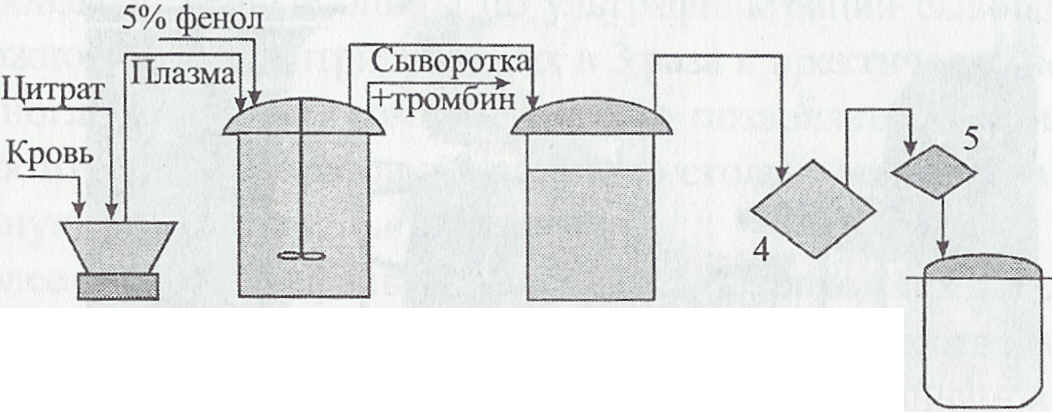 1 - сепаратор; 2 - дефибринатор; 3 отстойник; 4 - фильтр предварительной очистки; 5 - фильтр стерилизующей фильтрации; 6 - сборник готовой продукции Повторной стерилизации подвергают в случае необходимости ряд сывороток (противодифтерийные, противоботулинические) с появлением хлопьевидного осадка. В промышленном производстве готовится множество различных сывороток. Технологические приемы приготовления их в общих чертах одинаковы. В то же время для приготовления отдельных сывороток имеются свои технологические особенности производства, которые для каждой сыворотки оговорены в соответствующей научно-технической документации. Контроль качества сывороточных препаратов. Контроль за качеством сывороток осуществляют на всех стадиях их изготовления. После производственного контроля каждая серия сыворотки проверяется по физическим показателям (цвет и консистенция), на стерильность, безвредность, правильность объема расфасовки в разные емкости (ампулы или флаконы), герметичность их укупорки, качество этикетировки, маркировки и упаковки, а также специфическую активность после 20-дневного выдерживания при (37 ± 1) °С. Проводят также контроль сывороточных препаратов на содержание белка, водородных ионов (рН), электрофоретическую чистоту и др. (апирогенность, остаточное содержание солей). Сывороточные препараты должны быть стерильными (не контаминированы бактериями и вирусами), безвредными и высокоактивными специфическими препаратами. Контроль бактериальной стерильности проводят по общепринятой методике высевами из препарата на питательные среды МПА, МПБ с глюкозой, МППБ под маслом, на агар Сабуро или среду Чапека для исключения грибковой микрофлоры. Безвредность каждой серии сывороточных препаратов проверяют на морских свинках массой по 300 - 400 г (беременных свинок в опыт не берут), которым подкожно вводят 10 мл сыворотки (по 5 мл с обеих сторон); иногда безвредность проверяют на кроликах. Животные должны оставаться здоровыми и не иметь заметной местной и общей реакции в течение 10-дневного наблюдения. Специфическую активность сывороточных препаратов определяют биологическим и серологическим методами. Для определения биологической активности используют восприимчивых лабораторных животных, эмбрионы птиц или культуры клеток. Разведения для РН на животных делают 1/15 М фосфатным буферным или физиологическим растворами при рН 7,4 (с 0,2 % желатина). Серологические исследования проводят в соответствующих реакциях (РН, РДП в агаровом геле, РТГА, РСК, РИГА и др.) с использованием в качестве контроля заведомо известных позитивных и негативных сывороток (референс-препаратов). Активность сывороточных препаратов определяют по сравнению со стандартными (эталонными) референс-препаратами. Для этого сыворотку с неизвестной активностью используют параллельно со стандартной сывороткой, а затем рассчитывают дозу испытуемой сыворотки, эквивалентную по эффекту единице активности стандарта. Это позволяет исключать влияние на результаты оценки таких факторов, как особенности тест-агентов, чувствительность подопытных животных, сезонность и др., т.к. эти факторы в равной степени будут влиять на результаты, получаемые со стандартной и испытуемой сыворотками, и активность испытуемой сыворотки относительно стандартной будет оставаться постоянной. Дальнейшие интенсивные исследования в области стандартизации сывороточных препаратов, усиление требований к системам лабораторного и биологического контроля вновь разрабатываемых и модифицируемых препаратов, выделение этого направления в самостоятельную проблему несомненно будут способствовать еще большему улучшению качества лечебно-профилактических и диагностических сывороточных препаратов. 4. Заключение. В практике широко применяют как с лечебной, так и профилактической целью иммунные сыворотки. Иммунные сыворотки получают на биофабриках путем гипериммунизации животных (лошадей, волов, свиней, овец, кроликов и др.) соответствующими антигенами по специальным схемам. Этих животных называют продуцентами. Иммунные сыворотки содержат специфические антитела против соответствующих возбудителей. Лечебно-профилактическая эффективность иммунных сывороток зависит от титра антител, способа и кратности введения. При введении иммунной сыворотки больному животному она оказывает выраженное лечебное действие, при введении с профилактической — создается пассивный иммунитет через несколько часов после введения, продолжительность которого до 14 дней. По направленности действия иммунные сыворотки подразделяют на антибактериальные, противовирусные и антитоксические, например, сыворотка против рожи свиней, сыворотка против болезни Ауески сельскохозяйственных животных и пушных зверей, антитоксическая сыворотка против анаэробной дизентерии ягнят и инфекционной энтеротоксемии овец. При введении гетерологичных (чужеродных) сывороток животным следует всегда помнить, что они могут вызвать анафилактический шок или сывороточную болезнь. 5. Список использованной литературы. 1."Биотехнология", под редакцией академика Е.С. Воронина, изд. ЗАО ГИОРД, 2005 г. 2."Лабораторная диагностика", под редакцией В.В. Долгова, О.П. Шевченко, изд. Реафарм, 2005г. 3."Лабораторные исследования", справочник, изд. Интермедика, 2005 г. 4."Медицинские лабораторные технологии", под редакцией А. И. Карпищенко, изд: Интермедика, 2002 г. 5."Процессы и аппараты биотехнологии", С.В. Ковалев, Ю.И. Хрипков, изд. ВАХЗ, 1998 г. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 одбор животных продуцентов и их карантирование
одбор животных продуцентов и их карантирование


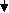

 итрирование
итрирование епарирование
епарирование Концентрирование 0,5 % -ным раствором фенола
Концентрирование 0,5 % -ным раствором фенола тстаивание в течение 2 месяцев
тстаивание в течение 2 месяцев терилизующая фильтрация
терилизующая фильтрация