Курсовая производство метанола. курсовая метанол. Производство метилового спирта
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
Министерство образования и науки Республики Казахстан Инновационный Евразийский университет КУРСОВОЙ ПРОЕКТ на тему «Производство метилового спирта» образовательная программа 6В07105 – «Химическая технология органических веществ» Выполнил студент группы ХТОВ18-402 Вакула Н.Н. Проверил преподаватель магистр химических наук Акижанова А.С. Павлодар 2021
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ Метанол – первый представитель класса спирты оС – цельсий % – процент К – кельвин P – давление ppm – (parts per million) Т – температура V* – объемная скорость подачи сырья атм-атмосфера Вт, кВт, МВт – ват, киловатт, мегаваат Гкалл – гигакаллории Кг – килограмм кг/м3 – килограмм на кубический метр 9 кДж – килоджоуль МПа – мегапаскаль Введение Метиловый спирт или метанол, пожалуй, один самых востребованных органических соединений которое в настоящее время синтезируется промышленным способом. Его также называют древесным спиртом, карбинолом, метилгидратом или гидроксидом метила. Химическая формула СН3ОН, первый представитель гомологического ряда одноатомных спиртов. Впервые метиловый спирт обнаружили в составе гидрогенезата сухой перегонки древесины. В настоящее время сухой перегонкой метиловый спирт все еще можно получить, однако в настоящее время существует множество других различных методов получения метанола, как в лабораторных условиях, так и в промышленности. Далее мы остановимся на некоторых из них. Из метанола получают такие ценные химические вещества как формальдегид, сложные эфиры, амины, растворители, уксусную кислоту, используют для получения присадок и добавок повышающие октановое число автомобильного двигателя, топливо для электростанции, сырье для тонкого органического синтеза, синтеза парфюмерии и лекарственных средств и многое другое. Поэтому метиловый спирт является одним из основных продуктов многотоннажной химии. В мире ежегодно выпускается более 20 миллиона тонн метанола. И спрос на карбинол даже не думает уменьшаться. В настоящее время, в промышленности метанол получают из природного газа при давлении процесса 250-300 кгс/см2 и температуре 250оС. В данной курсовой работе будет рассмотрен ряд задач: 1. Дана характеристика сырья и готовой продукции; 2. Рассмотрены физико-химические основы процесса, а точнее: термодинамика синтеза метанола; химизм и кинетика синтеза метанола; кинетическое уравнение по Граафу; 3. Рассмотрены катализаторы синтеза метанола; 4. Описаны химико-технологической схемы трех видов реакторов; 5. Тепловой баланс процесса синтеза метанола показан в табличной форме 1 Литературный обзор Метиловый спирт - бесцветная жидкость с запахом этанола, но только чуть-чуть более ярко выраженным, с температурой кипения +64,7 °C. Очень хорошо растворяется в воде, при этом сжимается (уменьшается в объеме) и выделяет тепло. Хорошо растворим в этиловом спирте и как он же является хорошим растворителем и является его заменителем. Во многом похож на этанол, но следует отметить одну разницу и особенность метанола от этанола, в воде не образует азеотропной смеси, и как следствие может быть разделен перегонкой. При этом чем больше концентрация метанола в воде, тем меньше температура разделения смеси (кипения). Данные приведены в таблице 1. Таблица 1 – Температура кипения водных растворов метанола.
1.1 Характеристика сырья и готовой продукции Во введении было отмечено, что метанол, в промышленности получают из природного газа. На таблице 2 приведен, наиболее встречаемый состав природного газа. Таблица 2 - Состав природного газа
Как видно из таблицы, основным ингридиентом природного газа является метан. Кроме вышеперечисленных соединений в составе природного газа могут быть в виде включения (очень малых концентрациях) другие соединения (сера, хлор, мышьяк и тяжелые металлы), которые являются ядом во время процесса получения метанола из природного газа. Поэтому от таких включений необходимо избовляься еще до начала синтеза метанола. На стадий подготовки. Сера бывает в составе в виде сероводорода, меркаптанов, сульфидов и дисульфидов. Хоть количество серы в природном газе на пересчете на серу достигает концентрации 80 мг/нм3, наличие его травит катализатор. Допускается максимальная концентрация серы в виде сероводорода в исходном газе, подаваемом в реакторный блок, не превышающая 0.1 мг/нм3. Превышение данного показателя влечет за собой необратимый процесс дезактивации катализатора, т.е. его отравление. Поэтому природный газ подвергается предварительной гидроочистке от серы, то есть очистке от серы при помощи воды. При этом используется только дистиллированная (деминерализованная) вода так как металлы даже в малом количестве влияют на катализатор, соответственно на процесс. В принципе, есть ограничения по ограничению в составе метилового спирта того или этого включения. В таблице 3 дана характеристика метанола. Таблица 3 -Характеристика готовой продукции на метанол технический 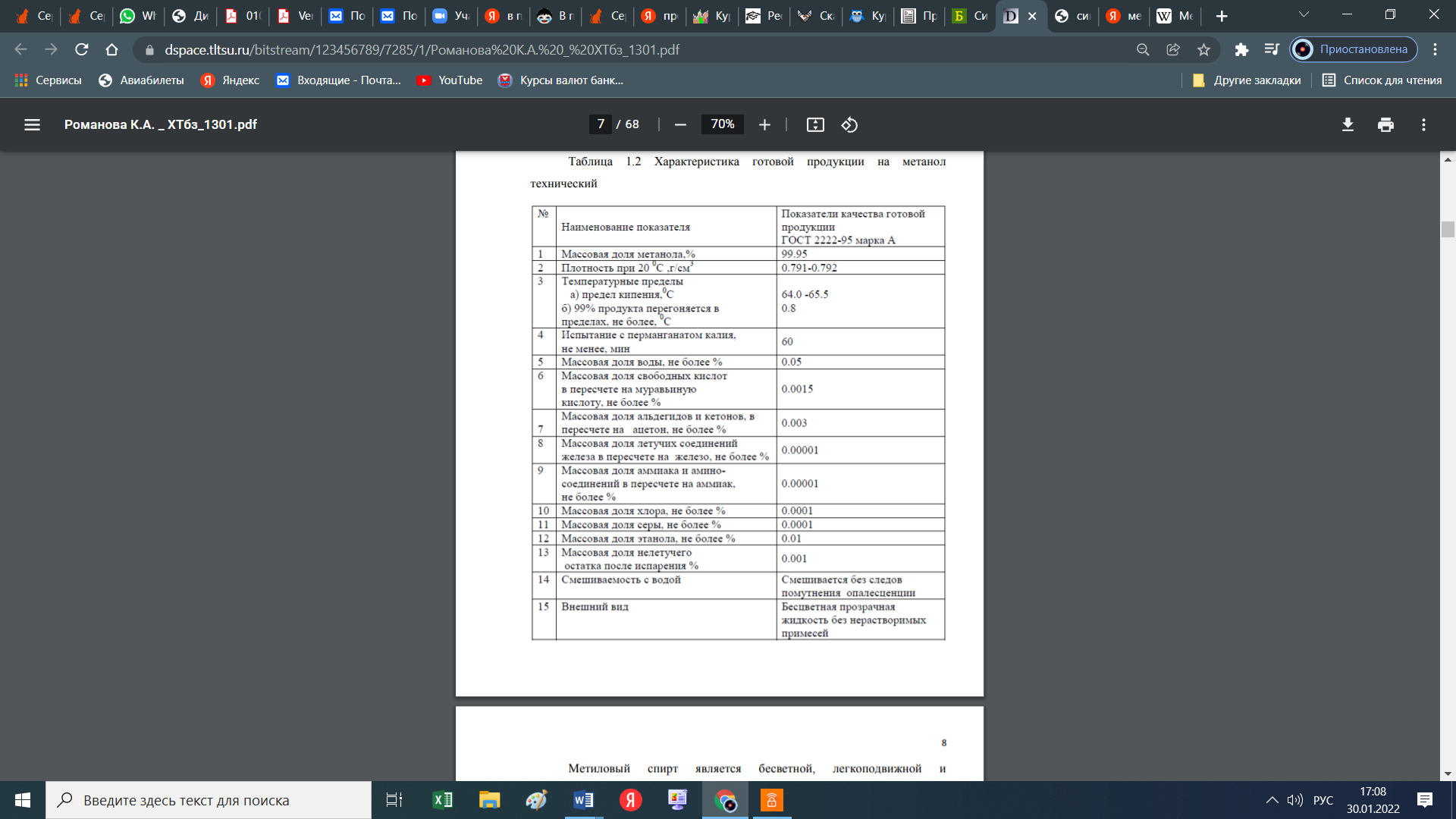 Следует отметить, что метанол в смеси с воздухом образует взрывоопасную смесь, подобно гремучему газу. Метанол, хоть и не встречается в свободном состоянии в природе, но его производные встречаются во многих соединениях. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты С6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты С6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п. [1]. вик 1.2 Физико-химические основы процесса 1.2.1 Термодинамика синтеза метанола Одним из способов получения метанола реакция между оксидом углерода, причем как монооксидом, так и диоксидом, с водородом. Реакция обратима и экзотермична. 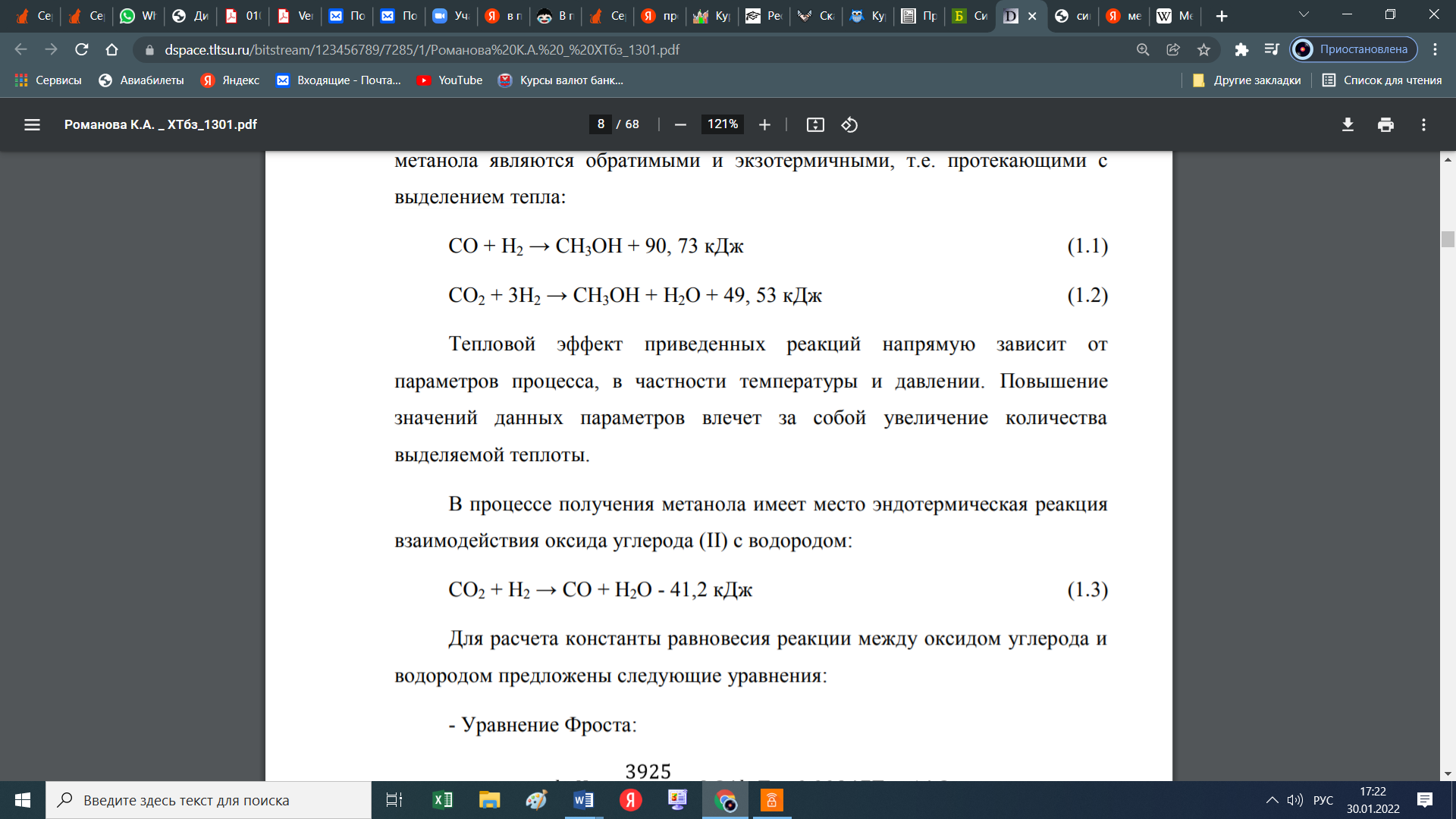 По показанному уравнению реакции, нетрудно догадаться, что тепловой эффект приведенных реакций зависит от температуры и давлении. Повышение, как и давления, так и температуры приводит к увеличению количества выделяемой теплоты. Выделяемый избыток теплоты, частично гасится в процессе сопутствующей эндотермической реакции взаимодействия оксида углерода (II) с водородом: К 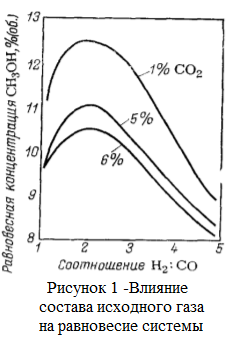 роме того, излишки тепла, всегда можно отправить на разогрев воды для хозяйственных нужд. роме того, излишки тепла, всегда можно отправить на разогрев воды для хозяйственных нужд.При промышленном производстве метанола, для равновесного выхода конечного продукта и уравновешивания их парциального давления используются инертные составляющие, такие как азот, аргон, метан и СО. Поэтому, при термодинамических расчетах учитываются концентрации данных компонентов Влияние состава исходного газа на равновесие системы показано на рисунке1 В данном случае, при получении метилового спирта образуется равновесная газовая система. При этом максимальная концентрация метанола достигается при увеличении отношения водород: окись углерода в исходном сырье, только при его полном стехиометрическом соотношении. Если это значение возрастает, то возрастает и степень превращения СО2 в метанол в большей степени чем СО. При этом увеличивается степень превращения и водорода. Поэтому, повышение концентрации инертных компонентов в исходном сырье снижает парциальное давление основных реагирующих компонентов и, соответственно и их летучести. Напротив, повышение температуры снижает равновесие прямой реакции из-за того, что реакция экзотермична и значит вызывает увеличение скорости побочных реакций, а это снижает селективность процесса. На рисунке 2 показана зависимость равновесной концентрации метилового спирта от давления и температуры. 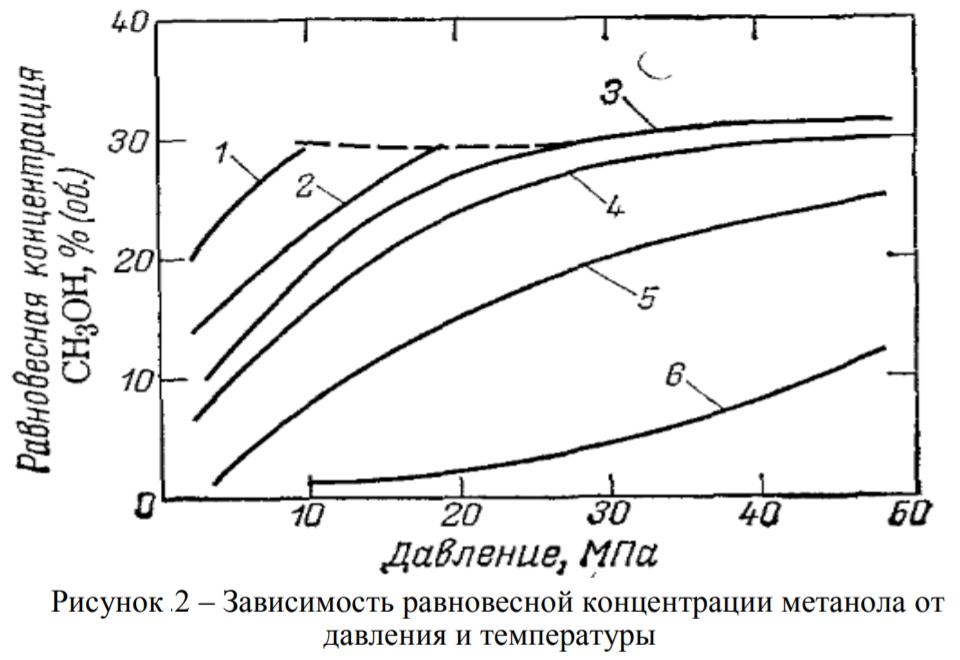 Также, увеличение давления влияет на равновесную концентрацию воды. Для увеличения выхода метанола, необходимо, при всех прочих равных условиях, увеличить соотношение H2:CO в исходном сырье. Соответственно, наиболее оптимальным условием проведения реакции, необходимо поддерживать температуру в диапазоне 200-260оС, давление в диапазоне 5-30 МПа, а стехиометрический состав исходного газа H2:CO = 2 [2]. 1.2.2 Химизм и кинетика синтеза метанола Во время получения метилового спирта, протекает несколько химических реакции, часть которых является основной реакцией, то есть целевой реакцией при котором получается метиловый спирт. Кроме того, по мере протекания процесса могут протекать и побочные реакции, которые не являются основным и снижают выход целевого продукта, то есть метанола. Данные по этим реакция собраны в таблице 3 [10, 11]. Таблица 3 – Реакций протекающие при синтезе метилового спирта
При этом образуются еще и парафиновые углеводороды по следующей схеме: 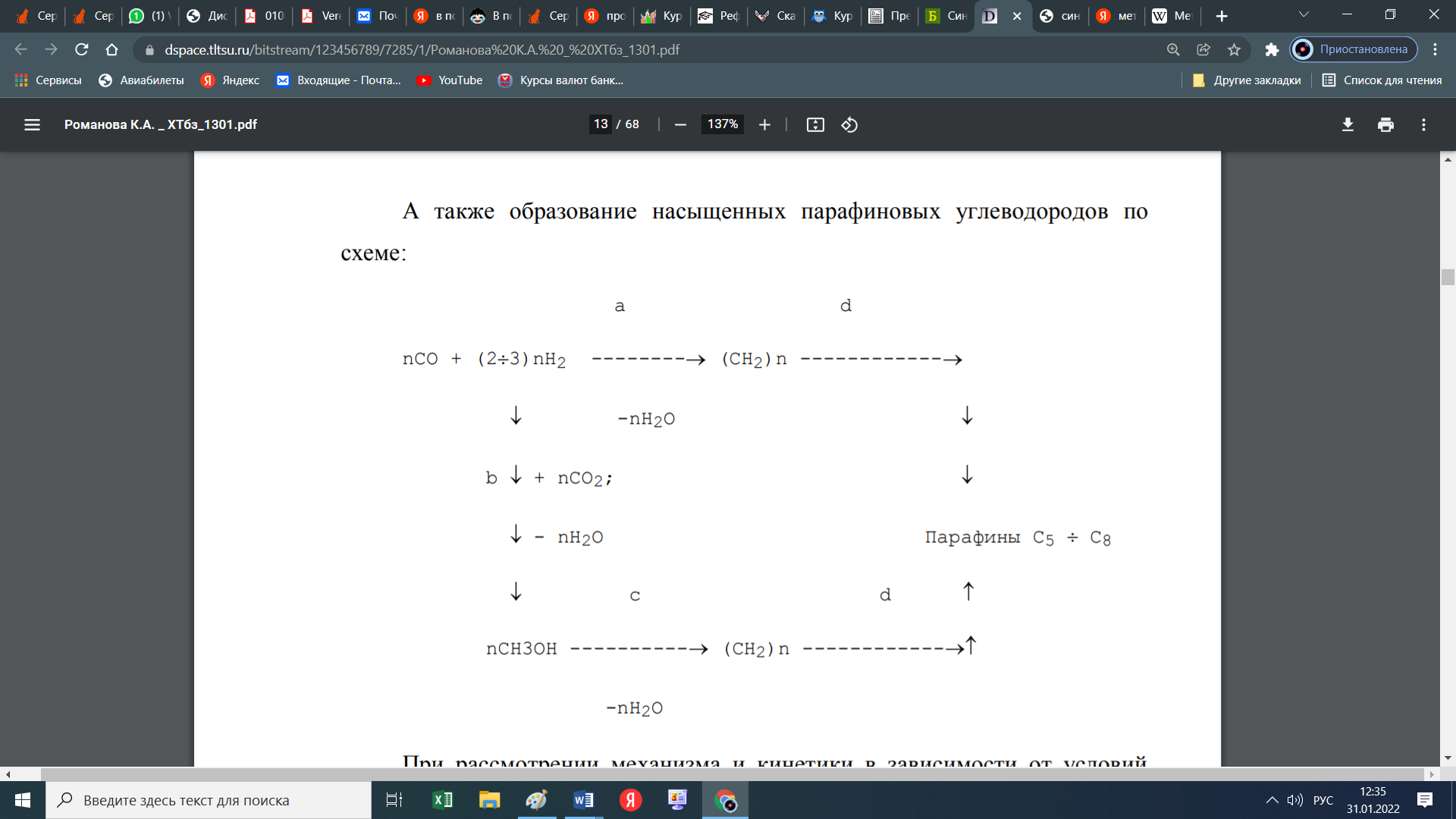 Мы уже отмечали, что процесс экзотермический и каталитический. В зависимости от условий проведения и используемого катализатора, могут протекать те или иные реакций из отмеченных выше. Но следует отметить, что реакции 1 и 3 протекают во всех возможных случаях, независимо от состава применяемого катализатора и параметров процесса В настоящее время существует несколько кинетических моделей процесса синтеза метанола. Одной из них является модель Клиера [7], которая была представлена авторами 1982 году и основана на двухстадийности синтеза –образование метанола из СО и СО2. Следующая кинетическая модель представлена Сайфертом и Луфтом [8], согласно которому водород и углекислый газ одсарбируясь на поверхности катализатора без диссоциации молекул сразу образуют молекулу метилового спирта. Также имеется кинетическая модель Вилла [10], где автор предположил на поверхности катализатора адсорбцию одной молекулы СО и двух молекул водорода. Обе эти модели были представлены на основе подхода Ленгмюра-Хиншелвуда в 1985 году. Кинетические уравнения этих моделей мы давать не будем, а остановимся только на наиболее исследованной кинетической модели Граафа (1988), в котором коллектив авторов предположил, что метиловый спирт образуется одновременно как из СО, так и из СО2. При этом, процесс синтез метанола из СО состоит из четырех стадий с образованием хемосорбированного комплекса по схеме: 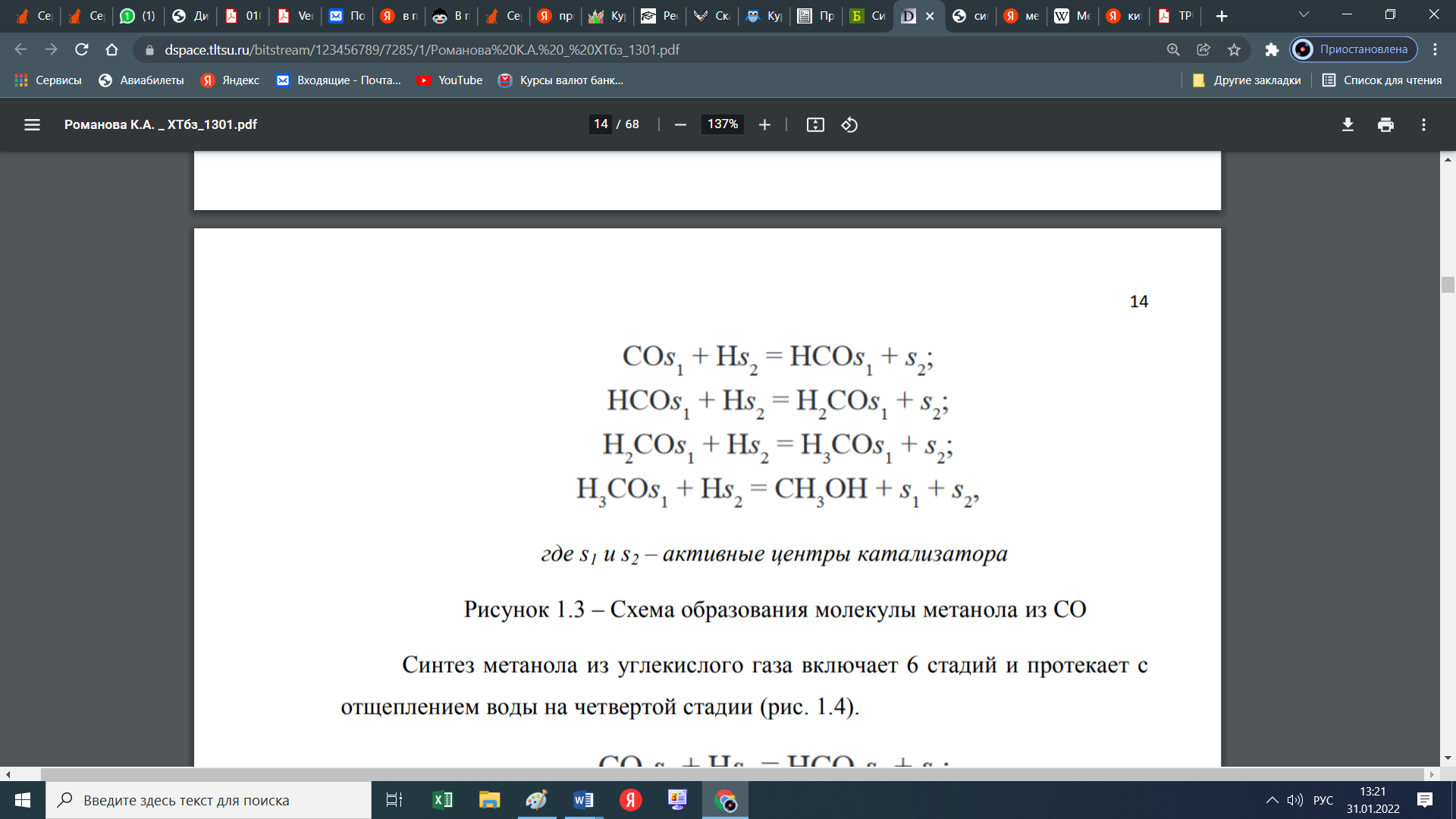 а синтез метанола из СО2 состоит из шести стадий. На четвертой стадий происходит отщепление воды 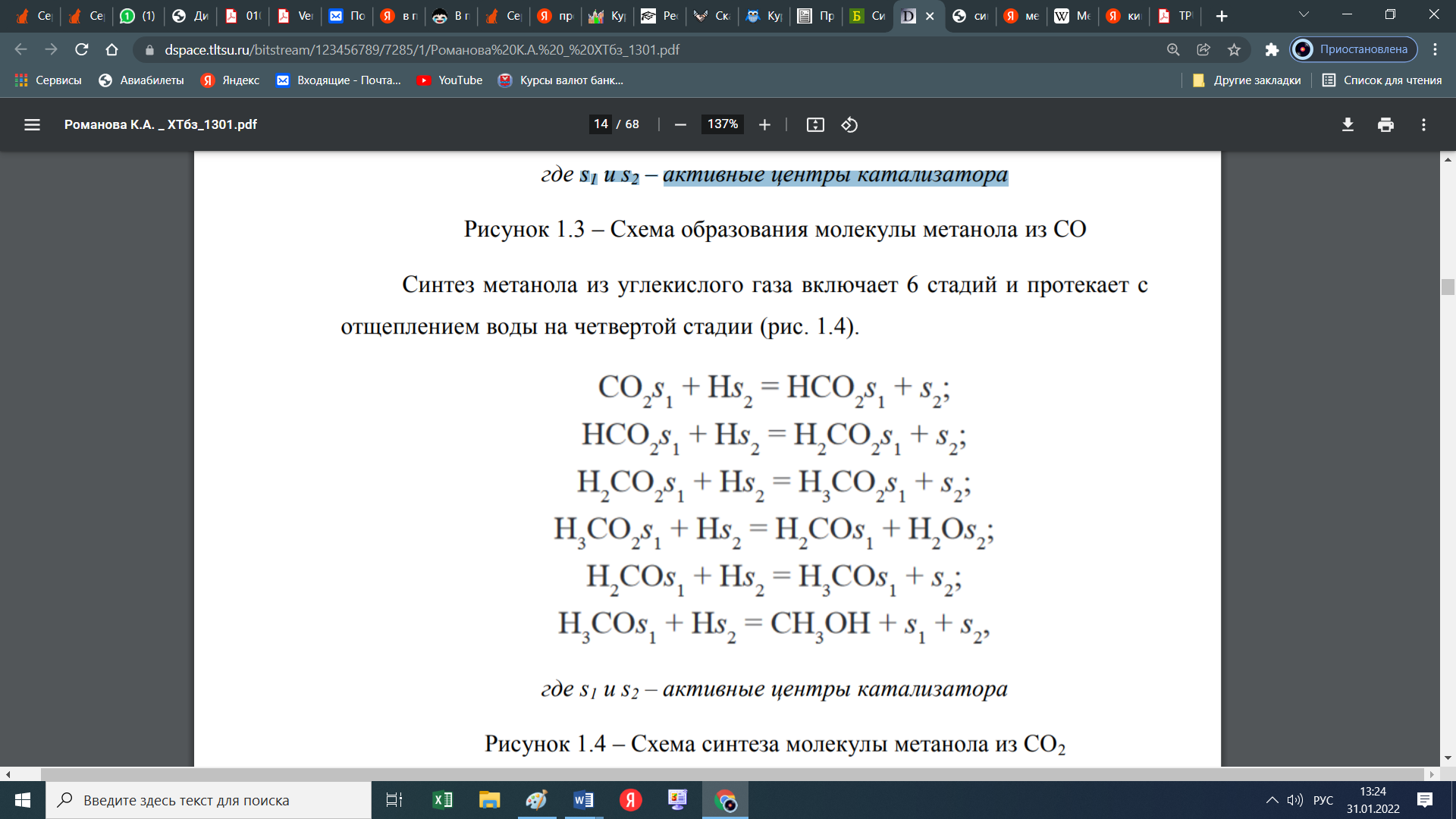 где s1 и s2 – активные центры катализатора. Уравнения скоростей реакций в этом случае имеют следующий вид: Для первой реакции 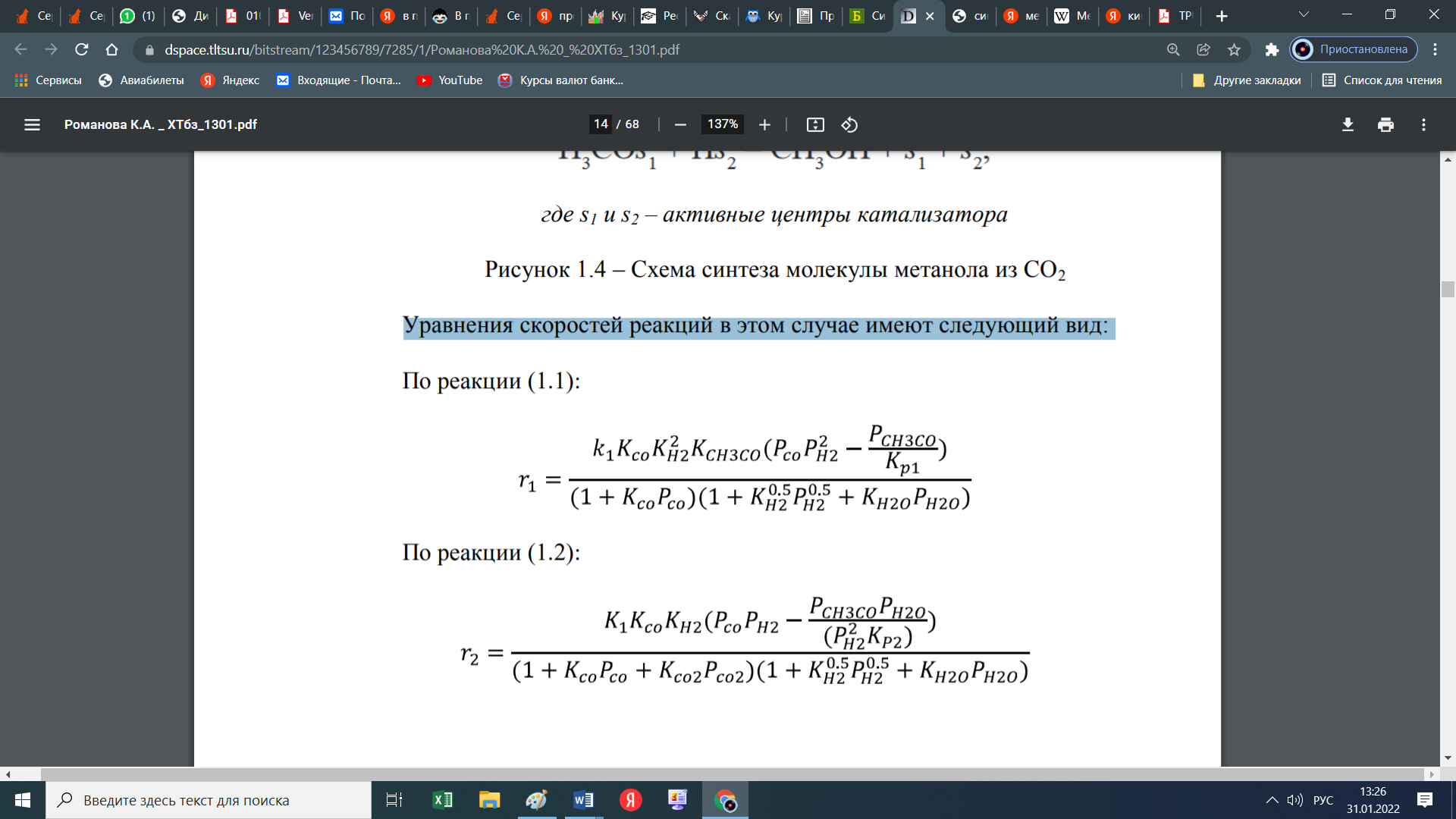 Для второй реакции  1.3 Катализаторы синтеза метанола Было уже отмечено, что в процессе синтеза метанола, особую роль играет качественный и количественный состав исходного сырья, условия проведения процесса и используемый катализатор. Основными требованиями, предъявляемыми к катализаторам синтеза метанола, являются стойкость к ядам, высокая активность и селективность (направлять процесс в сторону преимущественного образования метанола), стабильность в работе, стойкость к колебаниям температуры и большая механическая прочность. Первым промышленным катализатором при производстве метанола был цинк-хромовый оксидный катализатор, разработанный фирмой BASF. При использовании цинк-хромового оксидного катализатора процесс синтеза метилового спирта протекал при температуре 300-400°С и давлении 30 МПа. В настоящее время у нас и в странах СНГ, все еще больше используют цинк-хромовые оксидные катализаторы при температуре процесса 380-400°С и давлении 250-400 кгс/см2. Цинк-хромовый катализатор состоит из окиси цинка и хромита цинка. Химический состав его следующий: ZnO-ZnCrO, 3ZnO-ZnCr2O4, 3,3ZnO-ZnCr2O. Однако надо отметить, тот факт, что катализаторы для синтеза метанола постепенно переходят на медьсодержащие катализаторы. Это связано с тем, что многие предприятия по синтезу метанола, в качестве исходного сырья, используют природный газ (который предварительно очищают от примесей), технологическое развитие шагнула далеко вперед, и катализаторы первого поколения удовлетворяют не по всем требованиям настоящего времени. Кроме того, медьсодержащие катализаторы проводят процесс в более низком температурном диапазоне, более активны и их максимальная активность проявляется при температуре 220-260°С и давлении 200 кгс/см2. А это, минимальные затраты на проведение процесса и упрощённое аппаратное оформление процесса синтеза метилового спирта. В качестве примера, можно привести катализатор марки СНМ-1 (Северодонецкий низкотемпературный метанольный) который состоит на 52-54% CuO, 26-28% ZnO, 5-6% Al2O3. Справедливости ради, следует отметить, что цинк-хромовые катализаторы более устойчивы к отравлению тяжелыми металлами. Однако, в настоящее время, способы предварительной очистки природного газа, так усовершенствовались, что остаточные следовые количества примесей не особо влияют на отравление катализатора. Кроме того, медьсодержащие катализаторы осуществляют синтез метилового спирта и из СО, и из СО в присутствии СО2 и отдельно из СО2. Поэтому в последнее время медьсодержащие катализаторы все больше вытесняют свои цинк-хромовые аналоги. Для различных процессов, готовят разные катализаторы. Катализаторы для синтеза метанола готовят, в основном, в две стадий. Первая само приготовление катализатора и вторая стадия восстановление его до активного состояния, как правило водородом. Так как, процесс протекает в присутствии водорода, в процессе еще и происходит восстановление отработанного катализатора. Кроме того, промышленные катализаторы синтеза метанола могут быть приготовлены "сухим" и "мокрым" методами.   2. Описание химико-технологической схемы При синтезе метанола основным аппаратом является реактор. Конструкция реактора зависит от способа отвода тепла и принципа по которому осуществляется сам синтез метанола. В настоящее время существует три типа реакторов. 1. трубчатый реактор; 2. адиабатический реактор; 3. реактор в трёхфазной системе. Остановимся на каждом из них: 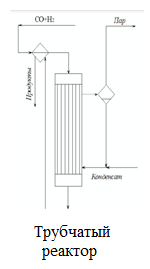 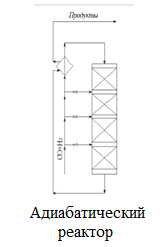 1. В трубчатом реакторе по трубам через неподвижный слой катализатора протекает реакционная масса, а в межтрубном пространстве протекает теплоноситель (охлаждающая жидкость-вода). Теплота, выделяемая при реакции, обычно используется для подогрева исходной смеси и получения водяного пара высокого давления. При таком режиме получается высокий коэффициент полезного действия. Единственный минус, огромная металлоемкость в следствии большого количества труб. Реакторы бывают шахтные и трубчатые. 1. В трубчатом реакторе по трубам через неподвижный слой катализатора протекает реакционная масса, а в межтрубном пространстве протекает теплоноситель (охлаждающая жидкость-вода). Теплота, выделяемая при реакции, обычно используется для подогрева исходной смеси и получения водяного пара высокого давления. При таком режиме получается высокий коэффициент полезного действия. Единственный минус, огромная металлоемкость в следствии большого количества труб. Реакторы бывают шахтные и трубчатые.В шахтных реакторах температуру процесса регулируют с помощью байпасов, а в трубчатых реакторах катализатор находится в трубках, охлаждаемых кипящей водой. 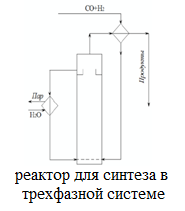 2. В адиабатическом реакторе катализатор располагается в несколько слоев, обычно четыре. Температуру процесса поддерживают подачей холодного газа между слоями катализатора, внутренние теплообменники отсутствуют 2. В адиабатическом реакторе катализатор располагается в несколько слоев, обычно четыре. Температуру процесса поддерживают подачей холодного газа между слоями катализатора, внутренние теплообменники отсутствуют3. В реакторе, для синтеза в трехфазной системе тепло отводится за счет циркуляции жидкости через котел-утилизатор или с помощью встроенных в реактор теплообменников. Процесс протекает в жидкой фазе углеводорода, не вступающего в реакцию ни с одним из компонентов реакционной смеси 3. Усеченный тепловой баланс В данном разделе, состав материальных потоков и материальный баланс процесса дан в виде табличных данных. Таблица 4 – Состав материальных потоков [регламент]  Таблица 5 - Материальный баланс реактора синтеза метилового спирта 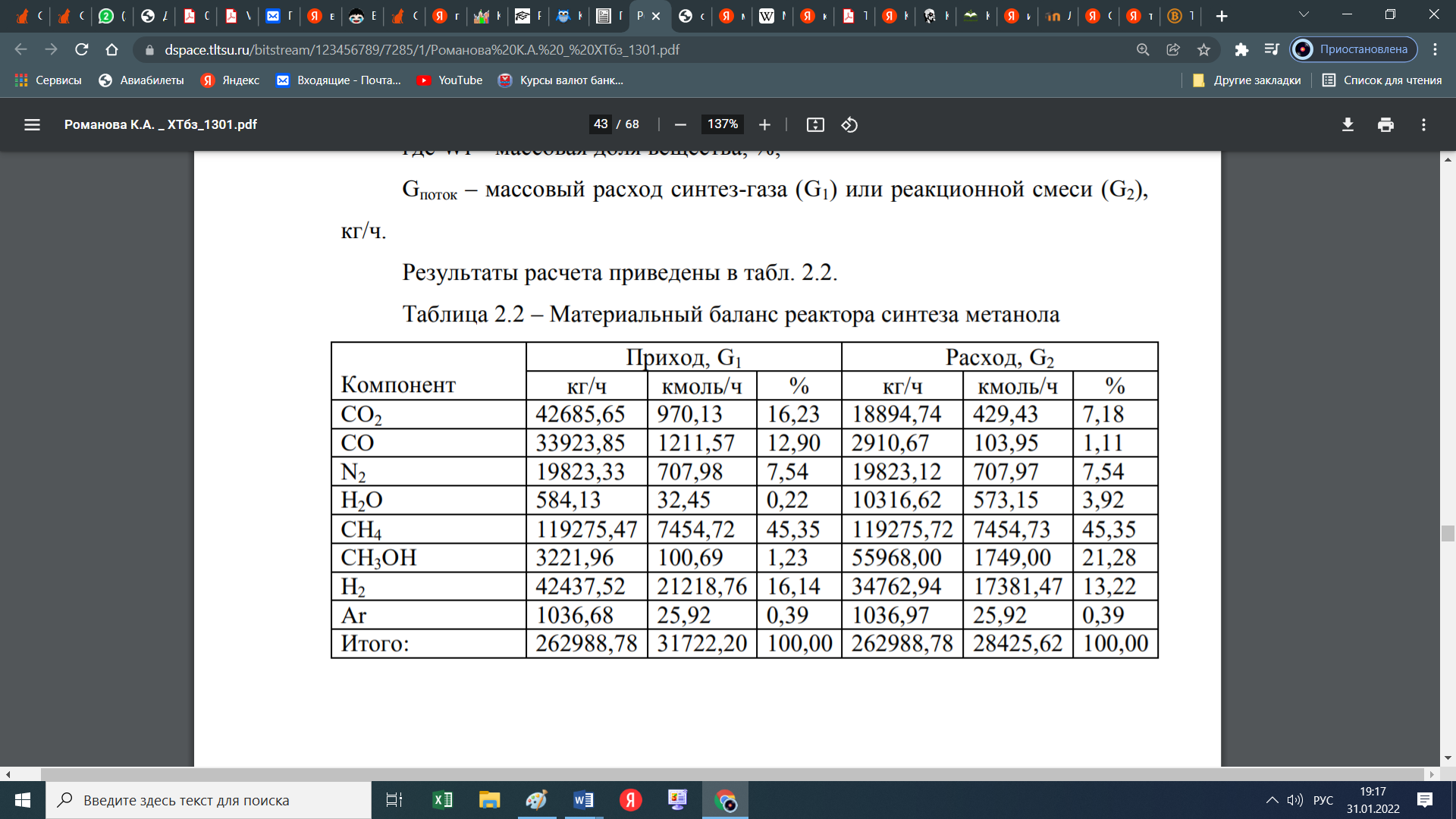 Заключение Основными выводами и результатами данной работы являются: 1. Дана характеристика сырья и готовой продукции; 2. Рассмотрены физико-химические основы процесса, а точнее: термодинамика синтеза метанола; химизм и кинетика синтеза метанола; кинетическое уравнение по Граафу; 3. Рассмотрены катализаторы синтеза метанола; 4. Описаны химико-технологической схемы трех видов реакторов; 5. Тепловой баланс процесса синтеза метанола показан в табличной форме . Список использованной литературы 1 METHANOL (CAS Reg. No. 67-56-1), INTERIM ACUTE EXPOSURE GUIDELINE LEVELS (AEGLs) // EPA, 2005: "Odor: Alcoholic odor; pungent odor when crude; pungent " 2. Технология синтетического метанола/ М.М. Караваев, В.Е. Леонов, И.Г. Попов, Е.Т. Шепелев. М. : Химия, 1984. 239 с. 7. Klier K., Chatikavanij V. Herman R.G. Catalytic synthesis of methanol from CO/H2 // J. Catal. – 1982 – Vol. 74 – P. 343–360. 8. Seyfert W., Luft G. Untersuchungenzur Methanolsyntheseirn Mitteldruckbereich // Chemie-Ingr-Techn. – 1985 – Vol. 57 – P. 482–483. 9. Villa P., Forzatti P., Buzzi-Ferraris G. Synthesis of alcohols from carbon oxides and hydrogen // Ind. Engng Chem. Process Des. Dev. – 1985 – Vol. 24 – P. 12–19. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
