Промышленной токсикологии
 Скачать 2.49 Mb. Скачать 2.49 Mb.
|
|
Раздел этой науки, касающийся токсичных веществ промышленного происхождения, называется промышленной токсикологией. Первой важнейшей задачей промышленной токсикологии является токсикологическая оценка вредных веществ промышленного происхождения с целью их гигиенической регламентации. Таким образом, речь идет о нормировании загрязняющих веществ, т.е. об установлении ПДК или других ограничительных нормативов. В условиях производства человек, как правило, находится под воздействием не одного, а нескольких разных ксенобиотиков, а также под совместным (комбинированным) воздействием химических веществ и физических факторов. В совокупности все они называются вредными и опасными производственными факторами. Отсюда второй задачей промышленной токсикологии является изучение и регламентация совместного воздействия на организм различных неблагоприятных факторов окружающей (в том числе и производственной) среды. В задачи токсикологии входят также исследования механизмов воздействия ядов на организм, их поведения в живых системах, включая распространение по пищевым цепям в экосистемах и др. Распределение ядовитых веществ в организме подчиняется определенным закономерностям. Вначале происходит динамическое распределение вещества в соответствии с интенсивностью кровообращения, а затем основную роль начинает играть сорбционная способность тканей, в состав которых входят: внеклеточная жидкость (для человека массой 70 кг – 14 л), внутриклеточная жидкость (28 л) и жировая ткань. Поэтому распределение веществ зависит от таких свойств, как водорастворимость, жирорастворимость и способность к диссоциации. Исследование всех этих вопросов – сложный процесс, затрудненный и тем обстоятельством, что эксперименты непосредственно на людях недопустимы. Они проводятся на белых мышах, крысах, морских свинках, кроликах, некоторых птицах, рыбах и других животных. Поэтому перед токсикологией стоит задача разработки научных основ экстраполяции экспериментальных данных с животных на человека. Кроме того, токсикология изучает проявление различных эффектов действия ядов в организме: гонадотропных (влияние на половые железы), эмбриотропных (воздействие на зародыши), мутагенных (вызывающие мутации в генно-хромосомном аппарате), канцерогенных (вызывающие злокачественные новообразования). Следует отметить, что опыты на животных занимают от 2 до 5 лет и обходятся в 0,2…2млн долларов на исследование одного вещества. Стоимость комплексного определения токсичности, канцерогенности, мутагенности, тератогенности и эффектов воздействия вещества на иммунную, эндокринную и нервную систему составляет несколько миллионов долларов. В силу указанных обстоятельств, достоверные данные о вредности и токсичности известны лишь для нескольких тысяч веществ из сотен тысяч соединений, применяющихся человеком в процессе его производственной деятельности. 8.1.1. Критерии и концепции оценки вредных веществ Любая оценка химического вещества в плане его опасности для организма или риска применения в природных объектах складывается из двух независимых и равных по своему значению составляющих – экспозиции и токсичности. Любая из них сама по себе не дает возможности оценить воздействие вещества на окружающую среду. Ранее было отмечено, что токсичность (ядовитость) характеризуется как мера несовместимости вещества с жизнью или здоровьем. Следует различать токсичность и опасность вещества. Опасность характеризует лишь вероятность отравления. Оценки токсичности должны иметь четкую количественную интерпретацию, т.е. быть основанными на измерениях. Совокупность методов и приемов исследований для количественной оценки токсичности и опасности ядов является разделом токсикологии и называется токсикометрией. Её задачей является определение зоны токсического действия химического вещества. В основе токсикометрических исследований находится изучение зависимости между количеством ядовитого вещества, содержащимся в конкретной среде (субстрате) или поступившем в организм, и реакцией последнего в виде острого, хронического или смертельного отравления, а также в форме того или иного отдаленного эффекта. При этом имеют значение не только собственно дозы, но и пути поступления вещества в организм, продолжительность его воздействия, состояние самого организма, условия окружающей среды. Степень токсичности вещества характеризуется величиной токсичной дозы – количеством вещества, отнесенным, как правило, к единице массы животного или человека, вызывающим определенный токсичный эффект. Чем меньше токсичная доза, тем выше токсичность. В токсикометрических исследованиях устанавливаются три количественные характеристики вещества. – пороговая доза (или концентрация), иначе называемая порогом однократного воздействия. Это наименьшее количество вещества, вызывающее при однократном воздействии такие изменения в организме, которые обнаруживаются при помощи специальных биохимических или физиологических тестов при отсутствии внешних признаков отравления у подопытного животного – Кмин (Смин) или Дмин (Dмин) – минимальная концентрация или доза; – токсическая не смертельная доза (концентрация), которая вызывает видимые отравления без смертельного исхода и обозначается символами ЕD или ЕК; – токсическая смертельная доза (концентрация), которая вызывает отравление, заканчивающееся смертью подопытного животного; обозначается символом ЛК и ЛД, где Л – означает «леталис»– смертельный. Различают средне смертельные дозы (ЛД50, LD50), абсолютно смертельные (ЛД90-100, LD90-100), минимально смертельные (ЛД0-10, LD0-10), где цифры в индексе указывают вероятность в % появления определенного токсического эффекта, т.е. гибель 50%, 100% и 10% подопытных животных. Аналогично обозначается и токсическая не смертельная доза – ЕD50. Наиболее часто используют величины LD50 (ЛД50) и ЕД50, которые статистически более достоверны по сравнению с другими. Острую токсичность определяют на крысах и мышах как внутрижелудочную, внутрибрюшинную, ингаляционную и кожную (ЛК50, ЛД50). Дозы, обладающие минимальным действием, определяют на кроликах (при ингаляции), крысах (по изменению картины крови), на людях (по запаху, действию на биоэлектрическую активность мозга, иммунологическим показателям). Для токсикометрии используют довольно большой набор экспериментальных организмов, включая обезьян. Одной из существенных проблем является различие в их чувствительности к воздействию химических веществ. Так, действие гистамина (содержится в организме человека, вызывает аллергические реакции) на мышей, крыс и морских свинок отличается по количественным параметрам токсичности в 600-3000 раз, брадикинина – в 10000 раз. Наиболее надежные экстраполяции на человека получаются в том случае, если данные по токсичности у разных видов животных близки. Полагают, что в случае монотонности реагирования 4-х видов лабораторных животных на яд (коэффициент видовых различий не более 3), совпадение чувствительности человека и лабораторных животных в острых (смертельных) эффектах наблюдается в 70% случаев, а в хронических – в 90% случаев. Воздействие вредных веществ на организм может вызывать два вида отравлений: острое и хроническое. При авариях или нарушениях регламента работы оборудования возможно резкое скачкообразное увеличение содержания вредных веществ. При этом могут наступать острые отравления, которые возникают после однократного воздействия и могут приводить к смертельному исходу, хотя и не сразу после отравления (например, оксиды азота могут привести к такому исходу через неделю или более после острого отравления). Хроническое отравление – это заболевание, развивающееся в результате систематического воздействия таких доз вредного вещества, которые при однократном поступлении в организм не вызывают отравления. Действие многих промышленных ядов связано именно с хроническим отравлением, поскольку в обычных производственных условиях, как правило, не создается концентраций, способных вызвать острое отравление. Это относится, например, к соединениям свинца, марганца, парам ртути и др. Но некоторые вещества (например, синильная кислота, окись углерода) вызывают только острые отравления. Поэтому для обоснования нормирования загрязняющих веществ в окружающей среде необходимо устанавливать не одно, а два значения пороговых концентраций: для однократного Кмин. остр. и хронического Кмин.хрон. воздействия. Значения пороговых хронических концентраций ниже, чем острых (однократных). Например, некоторое вещество может вызвать заболевание при длительном воздействии в концентрации в воздухе 0,05 мг/м3, а острое отравление – при разовом воздействии в концентрации 1 мг/м3. Если значения таких показателей как ЛД50 или ЛК50 характеризуют токсичность вредных веществ (их несовместимость с жизнью и здоровьем), то вероятность угрозы отравления (опасность) оценивается другими показателями. Это, в частности, так называемая зона однократного острого (Zостр.) и хронического (Zхрон.) действия и зона (коэффициент) возможного ингаляционного отравления (КВИО). Под зоной острого воздействия понимают разрыв между дозами (концентрациями), вызывающими начальные признаки отравления, и дозами (концентрациями), вызывающими гибель организмов. Например, амиловый спирт имеет очень узкую зону острого токсического действия и считается опасным веществом, из-за того, что быстро приводит к острому отравлению Величина Zостр характеризует диапазон концентраций между среднесмертельной концентрацией ЛК50 и порогом однократного воздействия К мин.ост и определяется по формуле: Понятно, что чем ближе друг к другу значения числителя и знаменателя, тем меньше отношение между ними и тем более опасным является данное вещество. Чем уже зона острого токсического действия, тем быстрее легкая интоксикация при увеличении дозы может перейти в отравление с летальным исходом. Правда, эти значения могут оказаться близкими как для высокотоксичных, так и для малотоксичных веществ, вследствие чего значения Z оцениваются с указанием фактических границ токсичности. Величина Zхрон. характеризует опасность хронического поступления (интоксикации): чем шире данная зона, тем выше опасность, поскольку при этом возрастает угроза накопления (т.е. кумуляции) вещества в организме. Это величина определяется как отношение Что касается КВИО, то этот показатель характеризует эффективную токсичность вещества и определяется как отношение его насыщенной концентрации в воздухе при температуре 200С (К20) к среднесмертельной ЛД50 : Естественно, что чем выше степень токсичности того или иного вещества, тем более жестокие требования предъявляются при работе с ним или к его присутствию в окружающей среде. Для описания функциональной связи между эффектом токсичного вещества на организм и его концентрацией (зависимость «доза-эффект») предложены различные уравнения. Наиболее простым является уравнение Хабера: где Е – эффект токсичности, мг мин/м3 С – концентрация вещества, мг/м3, t – время воздействия вещества, мин. Уравнение Хабера применимо для ядов с кумулятивным действием. Для ядов, не обладающим кумулятивным эффектом, используется формула Майера: где К – константа, зависящая от свойств яда. Под временем (экспозицией) понимают период, в течение которого организм находится под воздействием исследуемого фактора, в частности химического вещества. Отличия во времени реагирования на одно и то же вещество у разных тест-организмов будут отражать отличия в их чувствительности. Таким образом, биологическое действие яда начинает проявляться с некоторой минимальной дозы (минимальной действующей концентрации) – порога, т.е. биологическая активность токсина определяется количеством молекул (ионов) способных вступить во взаимодействие с биоструктурами клетки и вызвать токсический эффект. Полагают, что нижний предел биологической активности чужеродных соединений в организме (т.е. минимальная концентрация, необходимая для начала химического взаимодействия) составляет 7•1012 молекул на 1г биологической ткани. Для водных организмов это соответствует концентрации токсина в воде 10-8 г-моль/л или 104 атомов токсичных элементов на одну клетку (для канцерогенов этот показатель равен 1013…1017 атомов или молекул на одну клетку). С превышением этого порога возрастает вероятность взаимодействия токсина с биохимическими структурами, а значит и опасность появления нарушений. При определении токсической дозы исследуют (экспериментально) зависимость «эффект-доза», которую затем анализируют с помощью статистических методов. Величина токсической дозы зависит от способа введения вещества или пути его поступления в организм, от вида животных, возрастных, половых и индивидуальных различий, а также от конкретных условий воздействия вещества. При внутривенном, внутримышечном, подкожном и пероральном (через рот) введении, а также при накожной аппликации токсичные дозы имеют размерности: мкг/кг, мг/кг, моль/кг и т.д. Иногда используют также токсичные дозы, отнесенные к единице поверхности тела: мг/м2, г/м2 и т.п. Это связано с тем, что подобные дозы некоторых веществ для разных лабораторных животных и человека различаются в меньшей степени, чем дозы, отнесенные к единице массы. Этим пользуются в ряде случаев для анализа видовой чувствительности и переноса данных с лабораторных животных на человека. Пересчет доз из размерности мг/м2 в мг/кг проводят с использованием специальных таблиц и номограмм или по формуле, например: ED50 (мг/м2)=K . ED50 (мг/кг), (8.6) где К – коэффициент пересчета, который для стандартных лабораторных животных, как правило, определяется их массой – m: K=m 0,309. Для характеристики токсичности при ингаляции обычно указывают концентрации паров или аэрозолей в воздухе (мг/м3,мг/л и т.п.) и время их воздействия. Иногда применяют соотношения объёмных единиц, имеющих преимущества безразмерных параметров (%, ppm , ррb), хотя они и не соответствуют рекомендациям ВОЗ и Международного Стандарта (ISO). В американской литературе в качестве объёмных критериев используют величину ррm (parts per million), что соответствует 1 части на миллион, особенно для газов (1ppmоб =1 см3/м3), а иногда и в виде массовых величин для твердых веществ (1ppmмас =1 мг/кг). При очень малых концентрациях в воздухе пользуются данными в ppb, соответствующих 1:109 (1ppbоб =1мм3/м3). В США величина 109 носит наименование биллион, а в Европе – миллиард. Для идеального газа при 298К (250С) и давлении 101,325 кПа перевод 1 ррm (об) в мг/м3 осуществляется согласно зависимости: 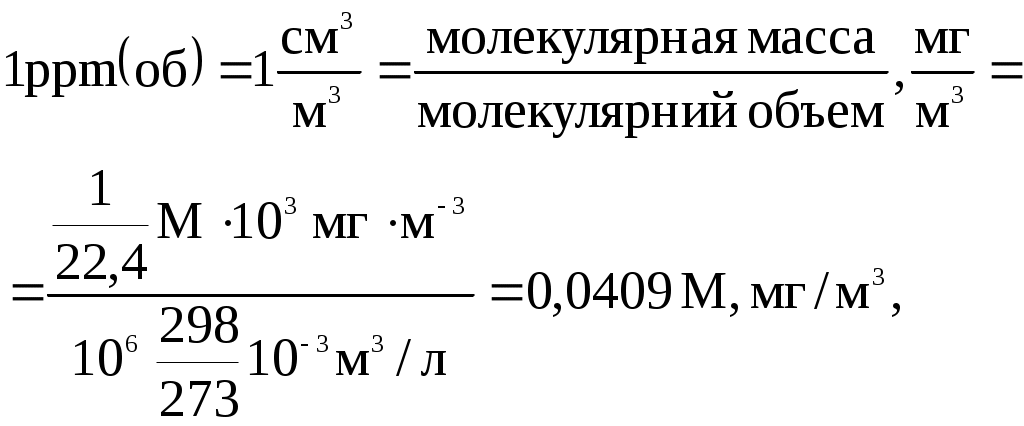 Получаем следующее уравнение для пересчёта: где С – концентрация примеси газа в воздухе, мг/м3; См.д. – та же концентрация, в единицах ppm (млн-1); М - молекулярная масса газа. С учетом температуры и давления уравнение (8.7) приобретает вид: где Р – давление газа, Па; Т – температура, К. 8.1.2. Классификация веществ по токсичности. Первые попытки создания классификации химических веществ по токсичности базировались на учете скорости развития острого токсического эффекта и степени его выраженности. С развитием широких исследований по разработке ПДК появились классификации химических веществ, основанные на учете величин средне смертельных доз и концентраций. В настоящее время в промышленной токсикологии наибольшее распространение получила классификация, предусматривающая 4 класса вредных веществ (иногда вместо термина «опасные» используют термин «токсичные») (табл. 8.1). Эффект токсического действия различных веществ зависит от количества (дозы) вещества, попавшего в организм, его физических свойств, длительности поступления, химизма взаимодействия с биологическими средами и тканями, пола, возраста, индивидуальной чувствительности, путей поступления, распределения и выведения из организма. Яды, наряду с общей, обладают избирательной токсичностью, т.е. они представляют наибольшую опасность для определенного органа или системы. В токсикологии выделяют следующие группы ядов: сердечные, нервные, печеночные, почечные, кровяные, легочные. Таблица 8.1–Классификация вредных веществ по степени токсичности и опасности
Первые три показатели – характеризуют степень токсичности, а три последние – степень опасности вещества. Классификация химических веществ по степени их токсичности и, особенно, опасности играет важную роль в решении проблем санитарной регламентации при разработке ПДК, если время контакта с токсикантом заранее установлено. Классы токсичности ряда соединений приведены в приложении 1. Среди многих механизмов реализации токсичности ксенобиотиков в токсикологии выделяют два, как наиболее универсальные: 1. необратимое связывание токсина с биомолекулами различных клеточных и внутри клеточных структур; 2. окислительный стресс, сопровождающийся активизацией не ферментативного свободно - радикального окисления и перекисного окисления лепидов. Многие ксенобиотики способны «включать» одновременно несколько механизмов токсического действия. И в том и в другом случае происходит, в конечном счете, нарушение обмена веществ, поведенческих реакций организма, его энергетического баланса, гибель клеточных структур и жизнеобеспечивающих органов. Для проникновения в клетку токсины используют различные «приемы»: «дырявят» мембраны, обманывают клетку, маскируясь под жизненно необходимые для неё соединения и элементы, связывают и выводят из организма жизненно важные микроэлементы и т.д. Так, никотин воспринимается нервными клетками как ацетилхолин – вещество-медиатор, которое после проведения нервного импульса легко расщепляется ферментом ацетилхолинэстеразой (тем самым снимается длительное раздражение ацетилхолином нервных окончаний). Однако никотин не является медиатором (а это значит, что он не разрушается ацетилхолинэстеразой), поэтому подобная ошибка выводит нервные клетки из строя вследствие длительного непрерывного их раздражения. Другие ксенобиотики действуют на нервные окончания, используя особенности конфигурации своих молекул. Так, молекула диоксина, имеющая форм прямоугольника размером 3...10 Ǻ, удивительно точно и надолго «вписывается» в рецепторы живых организмов. Диоксины способны подавлять и искажать жизненные функции организма. При этом в малых количествах они могут «не убивать» человека годами, но, накопившись в организме, они дают о себе знать многими болезнями, в том числе – злокачественными новообразованиями, врожденными аномалиями развития, уродствами и различными мутациями. Кроме того, диоксины проявляют свойства иммуносупрессора, т.е. при интоксикации организма развивается иммунодефицит. Существует мнение, что диоксины являются одной из причин возникновения СПИДа. Вредное действие ряда ксенобиотиков (некоторые пестициды, четыреххлористый углерод и др.) на организм человека обусловлено высокой токсичностью промежуточных и конечных продуктов их превращений, в первую очередь, активными окислителями – свободными радикалами и перекисными соединениями. Так, оксиды азота вызывают воспаленные верхних дыхательных путей, фиброзный бронхит, токсикозы, врожденные аномалии, сердечную недостаточность, нервные расстройства, рак. Диоксид серы инициирует бронхиты, пневмонию, дистрофические изменения, в печени, почках и сердце, а в сочетании с бензпиреном – усиливает канцерогенное действие. Присутствие оксида углерода ведет к нарушению жирового, углеводного и витаминного баланса, поражению центральной нервной системы, карбоксигемоглобинемии. Нарушение функции организма наступает при содержании в крови 10…20% карбоксигемоглобина, смерть – при 60%. У жителей крупных промышленных городов уровень карбоксигемоглобина в крови варьирует от 0,8…3,7% (у некурящих) до 1,2…9% (у курящих). Сходное заболевание (метгемоглобинемию) вызывают нитриты и нитраты. Тяжёлые металлы нарушают проницаемость клеточных мембран, блокируют реакции в клетках и их активные центры, замещают жизненно важные биомикроэлементы. По сравнению с первичным человеком организм современника в среднем содержит больше: ртути – в 19 раз, железа – в 40 раз, свинца – в 70 раз. В ряде случаев для токсинов используют следующие характеристики: -агрегатные состояние: газообразные, жидкие, твёрдые; -химический состав: кислоты, щелочи, соли, металлы, органические вещества, оксиды; -вид: химические, биологические, биотические; -происхождение: естественные (яды растений, микроорганизмов, животных), антропогенные; -спектр действия на организм: избирательного, общего действия; -токсический эффект: физиологические, психо - физиологические, цитогенетические, мутагенные, тератогенные, канцерогенные и др; -характер действия: общеядовитые (вещества, преимущественно нарушающие энергетический обмен, транспорт кислорода кровью, угнетающие цепи дыхательных ферментов и биологического окисления); нейротропные (вещества, преимущественно нарушающие процессы генерации, проведения и передачи нервного импульса); цитотоксичные (вещества, преимущественно нарушающие пластические функции клетки, синтез белка и клеточное деление). Наибольшей токсичностью обладают токсины бактерий. Их высокая активность обусловлена способностью вызывать нарушения молекулярных механизмов в обменных процессах в организме. Они характеризуются строгой специфичностью к биомишеням разных органов тканей: тетанические токсины вызывают столбняк, ботулинические – ботулизм, дифтерийный токсин – дифтерию и т.д. Указанные токсины представляют собой обычно простые белки с молекулярной массой 3,5·104…1,5•105 и выделяются в окружающую среду во время роста бактерий. Самый мощный зоотоксин – диамфотоксин (одно-цепочечный полипептид с М=60тыс), который содержится в личинках жуков листоедов – диамфидий (Африка). Вызывает внутрисосудистый гемолиз, сопровождающийся интенсивной гемоглобинурией, развитием нефрита; резкое падение мышечного тонуса и паралич. Ядовитые свойства личинок диамфидий давно известны бушменам, которые использовали их для приготовления яда для стрел: одной такой стрелой можно убить жирафа массой до 500кг. Токсичное начало ядов всех змей – нейтротоксин (вещество белковой природы с М=6…14 тыс). Симптомы отравления – паралич скелетной и дыхательной мускулатуры, приводящий к ослаблению дыхания вплоть до полной остановки; наблюдаются также отеки с последующей дегенерацией мышечных волокон. Смертельным является укус змеи – тайпан: не известен ни один случай, чтобы укушенный этой змеей человек выжил. Яд австралийской тигровой змеи из семейства аспидовых может убить 400 человек. Самой ядовитой считается морская змея – голубой ластохвост: её яд в 100 раз сильнее яда тайпана. Среди токсинов рыб, медуз, амфибий и моллюсков следует отметить батрахотоксин – яд небелковой природы, свойственный некоторым тропическим лягушкам-древолазам. Относится к ксенобиотикам: при вводе под кожу (0,002 мг/кг) подопытные мыши погибают через 8 мин. Обладает сильным кардиотоксическим действием, вызывая аритмию, фибрилляцию и остановку работы сердечной мышцы. Тетродотоксин – содержится в коже и яйцах некоторых жаб, яйцах калифорнийского тритона, слюнных железах осьминога, моллюсках, яичниках и печени рыб-иглобрюхов (рыба фугу и др.). Яд небелковой природы вызывает паралич скелетной мускулатуры, падение кровяного давления и остановку дыхания. Яд медузы «морская оса» действует только на сердечную мышцу и способен убить человека за 30 с. Присутствующий в коралловых полипах палитоксин обладает кардиотоксичным действием: гибель животных наблюдается в течение 5…30 мин в результате сужения коронарных сосудов и остановки дыхания. Смертельная доза для человека – 2Ÿ10-5 мг/кг. Аборигены о.Таити и Гавайских островов издавна использовали кораллы зонтарии для приготовления отравленного оружия. Известно более 250 видов грибов, продуцирующих несколько сотен микотоксинов. Многие из них обладают мутагенными, тератогенными и канцерогенными свойствами. К ним относятся описанные ранее афлатоксины (см. 7.6). Смертельный яд анатоксин (летальная доза для человека – 5,7 мг) содержится в бледной поганке в количестве 0,4 мг/г тела гриба, поэтому даже один съеденный гриб вызывает смерть. Механизм действия анатоксинов связан с блокированием ДНК. Смерть наступает в результате токсического гепатита и острой сердечной недостаточности. Крайне опасными для человека и водных организмов являются токсичные вещества небелковой природы, продуцируемые одноклеточными жгутиковыми, содержащимися в некоторых видах планктона. Многие токсины сине-зеленых водорослей представляют собой алкалоиды, по химическому и патологическому эффекту близкие к термостабильному яду гриба бледной поганки и обладают протоплазматическим, а некоторые, кроме того, гемолитическим действием. Токсино–экологические последствия «цветения» водоёмов опасны тем, что на действие прижизненных токсинов – сакситоксина, анатоксина А и других токсинов цианобактерий накладывается действие высокотоксичных продуктов их разложения: фенолов, аминов и их производных (в том числе, трупных ядов – кадаверина и путресцина). Таким образом, вредное действие токсинов на живое вещество связано с их способностью искажать течение метаболических и физиологических процессов, а также разрушать биоструктуры, являющиеся носителями наследственной информации (ДНК). Сравнительные данные о токсичности природных токсинов и некоторых химических веществ приведены в таблице 8.2. Таблица 8.2 – Сравнительная характеристика активности токсинов и вредных веществ.
Примечание: *-ЛК50; в/м – внутримышечно; в/бр –внутрибрюшинно; п/к-подкожно; в/в-внутривенно; п/р – перорально(макаки); р/к-резорбция через кожу; ви-газ – о-этил – S – β – диизопропиламиноэтилметилфосфат. Анализ приведенных данных позволяет сделать два вывода: 1. Каждой выборке веществ с сопоставимыми значениями молекулярных масс соответствует некоторое предельное значение минимальных токсичных доз. 2. Для совокупности наиболее токсичных веществ природного и синтетического происхождения наблюдается линейная зависимость токсичности соединений от их молекулярных масс (рис 8.1). Черными кружками обозначены синтетические яды.
                2 3 4 5 - 4 - 6 - 8 -10 -12 -14 -16 lg M                       синильная к-та оксид бериллия  нереистотоксин  тетродотоксин  сакситоксин    палитоксин  диамфотоксин  зарин  зоман    ви-газ  диоксин  батрахотоксин   столбнячий токсин ботулинические токсины   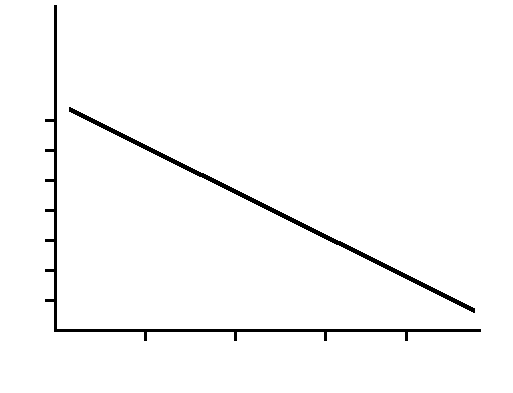 Рис. 8.1 – Зависимость токсичности соединений от молекулярной массы Рис. 8.1 – Зависимость токсичности соединений от молекулярной массы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
