Проявление морфы Striata у лягушки остромордой на территории Стерлитамакского района
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
Глава 3. Исследование проявления морфы Striata у лягушки остромордой на территории Стерлитамакского района 3.1. Морфогенетическая структура популяций озёрной лягушки Pelophylax ridibundus (Amphibia, Anura) на территории Стерлитамакского района Известно, что антропогенное влияние на окружающую среду вызывает самые разнообразные реакции у животных. При этом наиболее сильно от воздействия человека страдают представители гидросферы, как наиболее мобильной части биосферы. Сельскохозяйственные и бытовые стоки, а также отходы промышленных производств, поступающих в водоёмы, приводят к глубоким изменениям условий обитания отдельных животных и биоты в целом. Земноводные являются важным компонентом экосистем. Они являются ключевыми звеньями пищевых цепей, регулируют численность насекомых и других беспозвоночных, а также являются промежуточными хозяевами различных паразитов. Кроме того, амфибии очень чувствительны к изменениям факторов среды, что делает их удобными биоиндикаторами [1–4]. Для более объективной оценки ответной реакции популяции на изменения в окружающей среде (ОС), рекомендуется использование комплекса признаков, который включает в себя экологические и морфогенетические показатели, чувствительные к изменению ОС. Цель данной работы заключалась в анализе морфогенетической структуры популяции озёрной лягушки (Pelophylax ridibundus Pallas, 1771) для оценки её уровня жизнеспособности в условиях г. Стерлитамак и его окрестностей. Сбор животных проводили в летний полевой сезон 2021 г. Всего было исследовано 78 особей из 6 пунктов. Пункты отличались по градиенту антропогенного пресса, в частности по степени загрязнения воды органическими отходами. Для оценки окраски и рисунка тела животных фотографировали. У озёрной лягушки известны две цветовые морфы «striata» с дорсомедиальной полосой и «maculata» – без полосы Далее осуществляли морфометрический анализ, где каждое животное измеряли по общепринятой для бесхвостых земноводных схеме [5]: L. – расстояние от кончика морды до центра клоакального отверстия, Lt. с. – максимальная ширина головы у основания нижних челюстей, F. – длина бедра от клоакального отверстия до наружного края сочленения, Т. – длина голени, D. р. – длина первого пальца задней ноги от дистального основания внутреннего пяточного бугра до конца пальца, С. int. – наибольшая длина внутреннего пяточного бугра в его основании. Кроме того, у животного определяли вес тела (mb) и внутренних органов: сердца (mc), почек (mn) печени (ml). Далее вычисляли отношения этих показателей (индексы), которые являются хорошими морфофизиологическими индикаторами, позволяющими судить о состоянии как отдельно взятых организмов, так и популяции в целом [6]. Анализ генетической структуры популяций проводили с использованием локусов неспецифических эстераз. Ферменты экстрагировали из мышечной ткани путём заморозки и механическим измельчением тефлоновым гомогенизатором в 40% растворе сахарозы. Электрофорез осуществляли в камере VE-20 (Helicon, Россия) в вертикальных пластинках 10% полиакриламидного геля (ПААГ) [7]. В качестве электродного буфера использовали трис-глициновый буфер (рН 8,3). Продолжительность электрофореза составлялa 3–4 ч при напряжении 200 В и температуре +4 о C. Для окрашивания на неспецифические эстеразы гель выдерживали в растворе борной кислоты в течение 15 мин, затем в растворе 0,1 М буфера Tris-HCl рН 7,8 с добавлением α-нафтилацетата и красителя прочного красного (Fast Red TR). Полученные результаты обрабатывали стандартными методами вариационной статистики [8], при этом рассчитывали среднюю арифметическую величину метрических показателей (М) и её ошибку (m), осуществляли однофакторный дисперсионный анализ (ANOVA) и кластерный анализ выборок. Статистическую обработку проводили при помощи программ MS Excel, и Staistica 6.0. Для анализа гентических данных использовали программу GenAlEx [9]. У P. ridibundus нами были диагностированы два локуса неспецифических эстераз EST1 и EST2 с тремя аллелями каждый, наследуемых по кодоминантному типу. Границы локусов определяли путём сопоставления эмпирических частот полученных комбинаций с теоретически ожидаемыми частотами, рассчитанными по закону Харди-Вайнберга. При этом у ряда особей были выявлены лёгкие фракции эстераз, отсутствующие у большинства изученных лягушек. Примечательно, что по некоторым таксономическим признакам этих особей нельзя было отнести не к P. ridibundus, не к родственному виду Pelophylax lessonae Camerano, 1882 (прудовая лягушка), также обитающего в районе исследования. Вероятно, данные особи являются межвидовыми гибридами, которые традиционно присутствуют в местах контакта популяций этих двух видов. В анализе их не учитывали. Возможно, что по наличию указанных лёгких фракций эстераз в будущем можно будет диагностировать случаи гибридизации между указанными видами. На первом этапе исследований нами был осуществлён анализ частот встречаемости в популяциях озёрной лягушки цветовых вариантов, обозначаемых как морфа «striata» и «maculata»: 1) N = 15, «striata»/ «maculata» тире 86,6%/13,4%; 2) N = 15, 80%/20%; 3) N = 14, 92,8%/7,2%; 4) N = 12, 41,6%/58,4; 5) N = 5, 33,3%/66,7%; 6) N = 10; 70%/30%. Наибольшее число особей, имеющих дорсомедиальную полосу и обозначаемых как морфа «striata», отмечено в пунктах «Разумная-2», «Северский Донец» и «Разумная-1». Из литературных источников известно, что морфа «striata» доминирует в популяциях озёрной лягушки, обитающих в более загрязнённых биотопах урбанизированных территорий [10, 11], к категории которых, вероятно, относятся указанные пункты. Максимальное количество особей, у которых дорсомедиальная полоса отсутствует (морфа «maculata») отмечено в более чистых районах «Севрюково» и «Дубовое». Результаты морфометрического анализа приведены в таблице 1. Ввиду того, что для морфометрического анализа использовались половозрелые, но разновозрастные особи, мы сочли необходимым провести сравнение популяций не по абсолютным показателям, а по вычисленным индексам тела. Результаты однофакторного дисперсионного анализа выявили достоверное отличие изученных популяций по следующим пропорциям: L./Lt.c., L./F., L./T., L./D.p., L./C.int., F./T, что свидетельствует о морфологической дифференциации изученных популяций по указанным признакам, вызванной, вероятно, неоднородностью городской среды. Известно, что достоверные отличия по индексам внутренних органов, по которым можно оценить физиологическое состояние организма земноводных, позволяют косвенно судить о степени загрязнённости биотопов и кормообеспеченности [6]. Так, по индексу печени (ml/mb) выделяется группа «Северский Донец», что свидетельствует о её хорошей кормовой базе, так как запасные питательные вещества депонируются у лягушек в этом органе. По индексу сердца (mc/mb) наименьшие показатели отмечены в пункте «Везёлка», что говорит о пониженном уровне метаболизма в данной группе. По индексу почек (mn/mb), который также свидетельствует об уровне метаболизма, достоверных отличий между группами не отмечено. Таблица 1 - Индексы метрических показателей и внутренних органов P. ridibundus (M±m)* 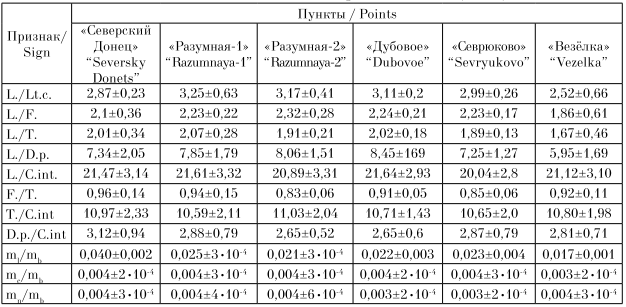 Полученные данные по локусам эстраз демонстрируют повышенное генетическое разнообразие в популяциях озёрной лягушки, обитающих в относительно чистых биотопах (пункты «Дубовое» и «Севрюково»). В остальных группах отмечается тенденция к снижению аллельного разнообразия и переход ряда локусов в мономорфное (гомозиготное) состояние (например, пункты 1 и 2). А это, в свою очередь, может снизить жизнеспособность этих групп, так как определённый уровень генетической изменчивости, будучи «мобилизационным резервом», обеспечивает устойчивость популяции как системы [12]. Экспериментально доказано, например, что увеличение гомозиготности в популяциях некоторых видов на 10% приводит к снижению их репродуктивной способности не менее, чем на 25% [13]. Тем не менее, низкие значения коэффициента инбридинга, отмеченные во всех изученных популяциях P. ridibundus свидетельствуют о стабильном состоянии их генофондов. Анализ молекулярной дисперсии (табл. 5) показал, что в изученных группах преобладает внутрипопуляционная генетическая дифференциация над межпопуляционной. При этом в среднем индекс дифференциации Fst составил 0,264, а уровень потока генов между популяциями (Nm) колебался от 0,107 до 32 особей за поколение. Cогласно «теории эволюции со смещающимся равновесием» [14], для поддержания панмиксии в метапопуляции требуется поток генов 1– 2 особи за поколение. Полученные значения Nm свидетельствует о том, что, несмотря на условия урбанизации, способствующей изоляции колоний, большинство исследуемых групп P. ridibundus являются, вероятно, членами одной панмиктической популяции. Большую генетическую близость между большинством изучаемых групп лягушек подтвердил кластерный анализ выборок на основе вычисленных генетическим дистанций по Неи методом ближайшего связывания (UPGMA). Только группа «Северский Донец» (№ 1) дистанцировалась от остальных групп. Таким образом, анализ популяционной структуры P. ridibundus в районе исследования продемонстрировал определённые тренды морфогенетической составляющей в зависимости от степени загрязнения биотопов и кормообеспеченности. Тем не менее, относительно высокие значения генетической изменчивости, низкие показатели инбридинга и высокая доля панмиксии указывают на сбалансированное состояние генофонда и повышенный уровень жизнеспособности анализируемых групп озёрной лягушки в районе исследования. Данный факт, вероятно, свидетельствует о микроэволюционных процессах, протекающих в популяциях изучаемого вида, направленных на их адаптацию к условиям урбанизированной среды. Вместе с тем, стоит отметить, что продолжающееся загрязнение водоёмов региона может превысить диапазон толерантности озёрной лягушки, следствием чего может быть сокращение численности или полное исчезновение этого ключевого вида в водных и прибрежных биоценозах. 3.2. Особенности полиморфизма по признаку striata в популяциях озерной лягушки на территории Стерлитамакского района У большого числа представителей рода Rana встречаются особи с дорсомедиальной полосой, обозначаемой как морфа или фенотип «striata» [27]. Наиболее изучены особенности полиморфизма по признаку striata у озерной Rana ridibunda Pallas, 1771 и остромордой R. Arvalis Nilsson, 1842 лягушек. Наличие признака «striata» определяет доминантный аллель диаллельного аутосомного гена, что установлено для озерной [4] и остромордой [9] лягушек. Для полосатой морфы остромордой лягушки выявлены следующие физиологические особенности. С.С. Шварц и В.Г. Ищенко [36] указывают на высокую чувствительность особей морфы striata у R. arvalis к «заморным» явлениям и их более высокую энергоемкость. Также у сеголетков R. arvalis установлено более высокое выделение СO 2 в единицу времени на 1 г массы у striata по сравнению с бесполосыми морфами выше в 1,5-2 раза [7]. Данная особенность обусловливает у них высокую миграционную способность и засухоустойчивость [17]. В другой работе [25] показано, что сеголетки полосатой морфы у остромордой лягушки обладают низкой чувствительностью к тироксину, связанную с исходно высоким уровнем окислительно-восстановительных процессов. В целом отмечено более раннее половое созревание и короткая общая продолжительность жизни у полосатых особей [22]. Исследование натриевой проницаемости кожи R. arvalis [6] показало существенное ее снижение (более чем в 3 раза) у полосатых особей по сравнению с бесполосыми. Данные физиологические особенности приводят к усилению легочного дыхания, что обуславливает высокое содержание железа в организме полосатых особей остромордой лягушки [4, 5]. Многочисленные исследования на разных видах рода Rana показали, что полосатые особи обладают большей массой тела и печени [36], также для них характерен повышенный обмен веществ [7], понижена проницаемость кожи [6]. Отмечаются также различия по накоплению тяжелых металлов для особей с различными фенотипами у остромордой [35] и у озерной [22] лягушек. Распределение доли полосатых и бесполосых особей также связывают с особенностями местообитаний – наличием водно-воздушной растительности (где проявляется криптическое значение дорсомедиальной полосы), а также скорости течения водотока [20]. По литературным данным наблюдается зависимость проявления полиморфизма от степени антропогенного воздействия [3, 8–10, 16, 19, 23, 24]. Следует отметить, что для соотношения фенотипов striata и nonstriata наблюдается сезонная изменчивость [20]. При обитании земноводных в условиях загрязнения данные физиологические различия между полосатыми и бесполосыми особями могут быть причиной адаптивного преобладания фенотипа striata в популяциях озерной лягушки [2–5, 24]. Изучены особенности географического распределения встречаемости полосатых морф у зеленых лягушек [27, 41]. Цель работы – проанализировать особенности проявления полиморфизма по признаку striata в популяциях озерной лягушки в условиях Стерлитамакского района, а также выявить особенности аккумуляции тяжелых металлов полосатыми и бесполосыми морфами. В качестве объекта исследования выбрана озерная лягушка – наиболее устойчивый к антропогенной трансформации местообитаний вид амфибий, населяющий в том числе и урбанизированные территории [14]. Анализ полиморфизма проводился по соотношению числа полосатых (морфа «striata») (рис. 1а) и бесполосых (морфа «non-striata») (рис. 1б) особей в популяции. Оценку антропогенного воздействия проводили по результатам химического анализа проб воды из мест обитания озерной лягушки по содержанию тяжелых металлов (Cu, Zn, Cd, Pb) и других показателей. Анализы проводились атомно–абсорбционным методом на аппарате Contrl A (Германия) в центральной лаборатории Сибайского филиала ОАО «Учалинский горно-обогатительный комбинат», а также в испытательном лабораторном центре филиала ФГУЗ «Центр Гигиены и Эпидемиологии в РБ» г. Учалы. Анализ состояния биотопов озерной лягушки представлен в таблице 1. По содержанию тяжелых металлов в воде обследованные местообитания озерных лягушек подразделены на 4 группы с критическим, высоким, средним и низким (относительно фона) содержанием тяжелых металлов. Из таблицы 1 следует, что основными загрязнителями водоемов в регионе исследования являются медь, цинк и кадмий. По ранее опубликованным данным о накоплении тяжелых металлов в организме основным биотоксикантом является кадмий, аккумулирующийся в печени озерной лягушки [15]. Анализ накопления в коже меди, цинка, свинца, кадмия выполнен в центральной лаборатории СФ ОАО «УГОК» атомно-абсорбционным методом с расчетом по принятой методике. Таблица 2 - Характеристика местообитаний озерных лягушек по содержанию тяжелых металлов в водоемах для периода исследования 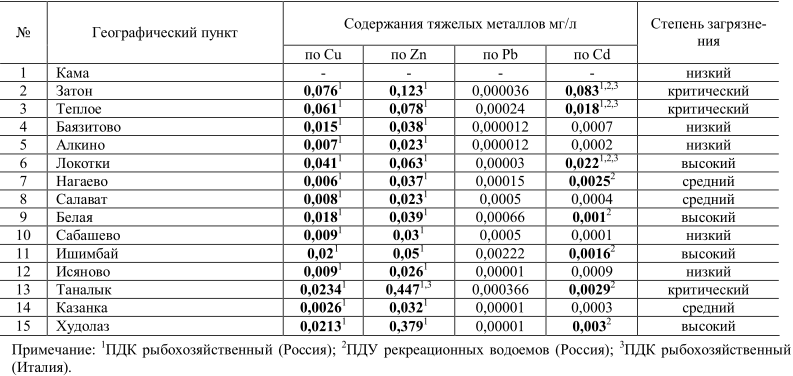 Как видно из рисунка 2, морфа «striata» отсутствует в 5 популяциях. Редки с частотой до 20% полосатые особи в 6 популяциях. Средняя частота встречаемости от 25 до 40%% зарегистрирована в 3, а доминируют с частотой от 50 до 75%% только в 1 популяции. Анализ соотношения полосатых и бесполосых особей в двух зонах республики показал высокую долю особей с морфой striata в зоне Зауралья (20,6%), а в Предуралье их доля насчитывает 8,8%. На бесполосых особей приходится 17,6 и 53,0% соответственно. Распределение фенотипов среди озерных лягушек можно объяснить географической изменчивостью встречаемости признака «striata» в популяциях озерной лягушки. По существующим данным доля особей с признаком «striata» снижается к востоку Республики Татарстан [11, 12] и северо-востоку Самарской области (наши данные) от центральной и западной части региона [29, 31-33]. По данным Е.А. Чибилева [34], доля полосатых особей превышает 50% только в юго-восточной части региона. Следует отметить, что восточнее Башкортостана в г. Челябинск доля морфы striata изменяется от 98% (очистные сооружения) и 46–57%% (пруд Коммунар) до 10% (Шершеневское водохранилище) [34]. В отличие от района исследования в других регионах отмечается доминирование особей с признаком striata. В частности для Центрально- Черноземного региона, по данным Г.А. Лады [20], доля полосатых особей (по сборам в мае – июне) составляет – 97,2–98,6%%, для р. Северский Донец (Белгородской области, с. Новотаволжанка) – 92,3%, р. Усманка (Воронежский заповедник) – 100%, пойма р. Цна (окр. г. Тамбова) – 97,2%. В Калужской области также преобладают полосатые особи озерной лягушки – от 100% в большинстве исследованных популяций [28]. В частности в Калуге доля полосатых особей составляет от 95,46 до 95,24% в северо-западной, 95% в центральной и восточной части, до 90–84,62% для западной части города [28]. На Нижней Волге доля полосатых особей составляет от 52,1% левого берега Ахтубы (рисовые чеки) до 58,4% окр. оз. Хара (водоемы правобережья старосты Ахтубы) [21]. Нами проведен анализ накопления тяжелых металлов полосатыми и бесполосыми особями озерной лягушки в районе исследования (табл. 2). Таблица 3 - Накопление тяжелых металлов в коже озерных лягушек (по сухой массе) полосатых и бесполосых морф 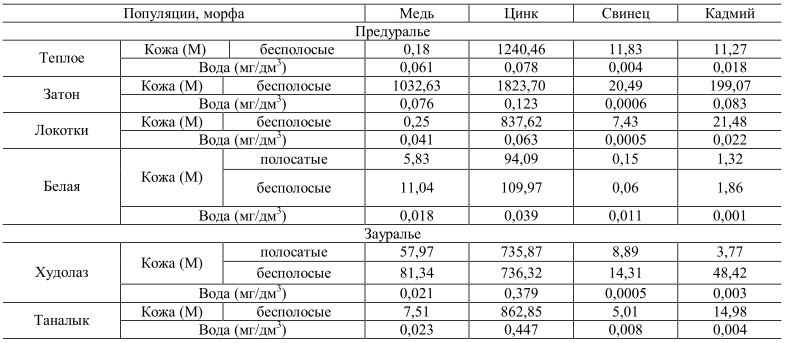 По данным таблицы 2 видно, у бесполосых происходит наибольшее, за исключение свинца, накопление кадмия, цинка, меди в местообитании со средним фоновым содержанием и высоким антропогенным воздействием (район г. Салават). В условиях высокого природного фона и техногенного загрязнения водоемов горно-обогатительными предприятиями для популяции «Худолаз» также у бесполосых особей наблюдается более высокое накопление таких тяжелых металлов, как медь, свинец, кадмий (за исключением цинка). Следует отметить, что в условиях критического загрязнения – выборка из популяции «Таналык», накопление меди и свинца ниже, чем у полосатых особей из популяции «Худолаз». Наши данные (табл. 3) по озерной лягушке из Предуралья показывают снижение накопления в ряду медь (в 1,9 раз)→кадмий (в 1,4 раза)→цинк (в 1,2 раза), при этом полосатые особи накапливают свинец в среднем в 2,5 раза больше, чем бесполосые. В Зауралье ряд снижения накопления имеет вид: кадмий (в 12,8 раза)→свинец (в 1,6 раз)→медь (в 1,9 раза), цинк накапливается у полосатых и бесполосых особей на одном уровне. В литературе указывается, что «относительно слабая способность к биоаккумуляции и высокая скорость физиологических процессов у амфибий обусловили увеличение частоты встречаемости морфы striata в пределах естественных и искусственных геохимических аномалий [4] и «антропогенно дестабилизированных территорий» [5, c. 68]. По данным С.А. Шарыгина [35] полосатые особи striata остромордой лягушки накапливают, в отличие от бесполосых, в 5 раз меньше стронция–90, марганца в 3,5 раза, хрома в 5 раз, никеля в 4 раза, олова в 6 раз, цинка в 2,5 раза меньше, за исключением железа, которое полосатые особи накапливают в 2 раза больше. Более низкое накопление данных металлов в организме полосатых особей R. arvalis обуславливает высокую встречаемость полосатых особей в Уральском регионе [35]. Наши данные из таблицы 3 показывают, что только накопление кадмия ниже у особей озерной лягушки с морфой striata в Предуралье («Белая»), в отличие от Зауралья («Худолаз»). Данные таблицы 3 подтверждают более низкое накопление морфами striata отдельных видов металлов. С другой стороны, в условиях высокого техногенного и природного уровня территории Республики Башкортостан преобладают популяции, где доля полосатых особей незначительна или они отсутствуют. Данный факт не согласуется с выводами А.С. Шарыгина [35] о влиянии геохимической провинции Урала на встречаемость в популяции особей с дорсомедиальной полосой. По нашим данным, для Зауралья также отмечается доминирование полосатых особей остромордой лягушки по сравнению с Предуральем. Таким образом, наши данные подтверждают выводы В. Л. Вершинина [5] о проявлении адаптационных свойств морфы striata у представителей рода Rana. При этом наблюдаются географические особенности в распределении полосатых морф озерной лягушки, не связанные с уровнем тяжелых металлов в местообитаниях. В большинстве литературных данных отмечается увеличение доли особей морфы striata в условиях антропогенного воздействия городов Урала [5], Предкавказья [24], Самарской [29–31] и Ульяновской [26] областей. За пределами России, в Болгарии, увеличение доли полосатых особей озерной лягушки отмечается для популяций г. Пловдива [8]. Напротив, в целом или в отдельных популяциях, отмечают почти равное соотношение полосатых и бесполосых особей [37], снижение доли полосатых отмечается для Калужской области [28], Нижнего Поволжья [21, 37, 38] и даже практически полное отсутствие особей с признаком striata в Самарской области [31; наши данные] и Республики Башкортостан [16]. По данным А.А. Шиян [37, с. 20]: «В популяции лягушек с полей фильтрации сахарных заводов отмечено либо равное соотношение особей морф striata и maculata, либо преобладание (в 2,0 раза) особей морфы maculatа». Доля полосатых особей выше на 6,3% в контроле, по сравнению с рисовыми чеками [21]. При этом в условиях Республики Башкортостан – территории с высоким фоновым содержанием в среде меди, цинка и кадмия, в большинстве популяций озерной лягушки преобладают бесполосые особи. Увеличение доли бесполосых особей данного вида характерно для сопредельных с Республикой Башкортостан регионов – в восточных районах Республики Татарстан [10, 12] и в Самарской области (окр. пос. Яблоня, района) (наши данные). По нашему мнению, в условиях техногенного загрязнения меньшее накопление тяжелых металлов может свидетельствовать о проявление адаптивной реакции. Обитание в условиях высокого техногенного загрязнения водоемов тяжелыми металлами приводит к изменениям морфофизиологических показателей – относительной массы внутренних органов [13]. Следует отметить, что высокие концентрации тяжелых металлов могут приводить как к снижению массы органов в результате высоких энергетических затрат, направленных на детоксикацию, так и к гипертрофии ткани в результате патологических процессов. Отсутствие полосатых особей в большинстве популяций Республики Башкортостан, по нашему мнению, связано с особенностью локального распределения встречаемости морфы «striata», которая редка и в сопредельных регионах. Таким образом, эколого-физиологические особенности фенотипов, маркируемых признаком «striata», имеют адаптивные преимущества, свя-занные как с высоким уровнем обмена, так и с более коротким личиночным периодом развития и повышенной проницаемостью кожных покровов в условиях техногенного загрязнения местообитаний. |
