Лекции аппаратчика химводоочистки. лекции Аппаратчик химводоочистки. Q2 H2 Fe
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
Аппаратчик химводоочистки. Химия – наука о веществах, свойствах, превращениях друг в друга. Изучает простые и сложные соединения вещества. Простое вещество – вещества молекулы которых состоят из атомов одного и того же вида. Q2 H2 Fe Сложное вещество- это вещество в состав которого входят атомы разного вида HCl NaCl. Молекула – наименьшая частица вещества, способная к самостоятельному существованию и сохраняющая свойства данного вещества. Атом – наименьшая частица элемента, входящая в состав молекулы. Атомная масса – масса атома, выраженная в углеродных единицах (у.е.) Атомная масса определяется по периодической системе химических элементов Менделеева. Молекулярная масса – масса молекулы выраженная в углеродной единице. Она определяется по сумме атомных масс элементов, входящих в состав молекул. М Н2О = 1 * 2 + 16 = 18 у.е. М Н2SO4 = 1 * 2 + 16 * 4 = 98 у.е. Валентность – свойство атома присоединяться и удерживать определенное количество атомов другого элемента или замещать их в соединении. Валентность бывает положительной и отрицательной. У водорода во всех соединениях Н+ у кислорода О2- Металлы обладают только положительной валентностью: она определяется по номеру групп в которой расположен элемент: Na+ Ca2+ Al3+ Неметаллы обладают как положительной, так и отрицательной валентностью: C4+- N5+ S6+ Cl7+ C4- N3- S2- Cl1- Молекулы должны быть электронейтральны, т.е. количество положительных и отрицательных единиц валентности должно быть равно H2SO2-4 2+6+8- В неорганической химии изучают 4 класса сложных веществ: 1. Оксиды, 2. Кислоты, 3. Основания, 4. Соли. Оксиды – сложные вещества, состоящие из 2х элементов, один из которых кислород О Na+2O2- Ca2+O2 Al3+2O2-3 C4+O2-2 N5+2O2-5 S6+O2-3 Оксиды различают: основные кислотные амфотерные Основные – образованны металлами. Им соответствуют основания: MgO Na2O CaO При растворении в воде они образуют основания CaO + H2O = Ca(OH)2 Na2O +Н2O = 2NaOH Количество атомов, вступивших в реакцию. Должно быть равно количеству атомов образованных в результате реакции. Кислотные – оксиды, образованные неметаллами СО2 N2O5 SO3 При растворении в воде образуют кислоты. SO3 + H2O = H2SO4 Амфотерные оксиды в зависимости от условий могут проявлять как кислотные, так и основные свойства. AI2O3 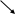 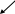 Al(OH)3 H3AlO3 2. Кислоты - сложные вещества, состоящие из атомов водорода и кислородного остатка. Различают: 1. бескислородные кислоты: HCl H2S соляная сероводородная 2. кислородосодержащие кислоты: HNO3 (азотная); H2СO3 (угольная); H2SO4 (серная); H2SiO3 (кремневая); H3PO4 (фосфорная). Валентность кислотного осадка определяется по количеству атомов водорода, входящих в состав молекулы H+Cl- H2S2- HNO-3 H2CO2-3 Кислоты бесцветные, имеют специфический запах и кислые на вкус. Индикатор – вещество меняющее свою окраску в зависимости от реакции среды. Индикатор лакмус в присутствии кислоты меняет а кислот: 1  . взаимодействие с месвой фиолетовый цвет на красный, метил-оранж на розовый. . взаимодействие с месвой фиолетовый цвет на красный, метил-оранж на розовый.Химические свойствталлами 2HCl + Zn = ZnCl2 + H2 2. взаимодействие с основными оксидами H2SO4 + CaO = CaSO4 + H2O 3. взаимодействие со щелочами Реакция между кислотой и щелочью называется реакцией нейтрализации. HCl + NaOH = NaCl (Соль) + H2О 3. Основания – это сложные вещества, состоящие из атомов Ме и одной или нескольких ОН- - гидроксидных групп. Основания делятся на растворимые и нерастворимые в воде. Растворимые в воде основания называются щелочи. Нерастворимые в воде основания выпадают в осадок Al(OH)3; Fe(OH)3 - основания. Растворы щелочей бесцветны, горькие на вкус, мылкие на ощупь. Индикатор лакмус в присутствии щелочей приобретает синее окрашивание. Характерным индикатором на щелочи является фенолфталеин (бесцветный). В присутствии щелочей приобретает малиновое окрашивание. Химические свойства оснований. взаимодействие с кислотами NaOH + H2SO4 = Na2SO4 + H2O взаимодействие с кислотными оксидами KOH + SO3 = KSO4 + H2O взаимодействие с солями Ca(OH)2 + Na2SO4 = CaSO4 + 2NaOH Соли – сложные вещества, состояние из атомов металла и кислотного остатка. Соли делятся: средние кислые основные комплексные Средняя соль - продукт полного замещения водорода кислоты на металл. 2NaOH + H2SO4 = Na2SO4 + H2O Соли соляной кислоты – хлориды Cl Соли азотной кислоты – нитраты NO-3 Соли угольной кислоты – карбонаты СО2-3 Соли серной кислоты – сульфаты SO2-4 Соли кремневой кислоты – силикаты SiO2-3 Соли фосфорной кислоты – фосфаты РО3-4 Al3+Cl-3 Ca2+(NO3)2
Кислые соли – продукт неполного замещения водорода – кислоты на металл NaOH + H2SO4 = NaHSO4 + H2O недостаток гидросульфат Na Называют кислые соли так же как и средние только добавляют приставку – гидро – Гидросульфат Na Na+2HPO2-4 H+PO3-4 Кислые соли образуются только от многоосновных кислот Гидросульфат Са Ca2+(HSO4)2 Среди средних солей есть соли постоянной жесткости воды. CaCl2 MgCl2 CaSO4 MgSO4 хлорид сульфат Среди кислых солей есть соли временной жесткости. Ca(HCO3)2 Mg(HCO3)2 гидрокарбонат Соли постоянной и временной жесткости обязуются общую жесткость воды. Теория электролитической диссоциации. Все вещества делятся на электролиты и неэлектролиты. Электролиты – вещества, растворы или расплавы которые проводят электрический ток. К ним относятся: 1. щелочи 2. кислоты 3. соли Эти вещества проводят электрический ток потому, что при растворении или расплавлении распадаются на ионы (заряженные частицы) Ион+ - катион – положительно заряженный ион Ион - - анион – отрицательно заряженный ион Неэлектролиты – вещества, растворы которых не проводят электрический ток. При растворении распадаются на молекулы (сахар). Распад электролита на ионы при растворении или расплавлении называется электролитической диссоциацией. П   роцесс диссоциации обратимый обозначается роцесс диссоциации обратимый обозначается с точки зрения электролитической диссоциации кислоты – вещества, которые диссоциируют (распадаются) на катионы водорода и анионы кислотного остатка
2.  Щелочи – диссоциируют на катионы металла и анионы гидроксильной группы Щелочи – диссоциируют на катионы металла и анионы гидроксильной группы
Типы химической реакции. Реакция соединения – между 2-мя или несколькими простыми веществами, в результате которых образуются сложные вещества с новыми свойствами 2Н2 + О2 = 2Н2О Реакция замещения – между простыми и сложными веществами, в результате которой атомы простого вещества замещают один из атомов сложного вещества. 2НСl + Zn = ZnCl2 + H2 Реакция обмена – между сложными веществами, при которых они обмениваются своими составными частями CaCl2 + Na2SO4 = 2NaCl + CaSO4 R – катионит 2NaR + CaCl2 = CaR2 + 2NaCl (натр. соль) Растворы. Растворами называется система, состоящая из 2-х или более компонентов (растворителя и растворенного вещества) и продуктов их взаимодействия. Растворенное вещество в растворе может быть в виде молекул или ионов. Раствор находящийся в равновесии с растворяющимся веществом называется насыщенным. Насыщенными растворами пользуются редко, чаще употребляют ненасыщенные растворы, т.е. растворы с меньшей концентрацией растворенного вещества чем насыщенный. Важной характеристикой любого раствора является его состав, который выражается концентрацией – количество растворенного вещества, содержащегося в определенном количестве раствора или растворителе. Раствор с большой концентрацией называется концентрированным, с малой – разбавленным. Концентрация может быть выражена по разному: % концентрация, молярная (моль), нормальная (Н), и титр (Т) 8% NaCl Процентная концентрация – количество грамм вещества, содержащегося в 100 гр. раствора. Нормальная концентрация – количество грамм эквивалентов (гр/экв.) растворенного вещества, содержащегося в 1 л. Раствора. Раствор в 1 л. Которого содержится 1 гр/экв. Растворенного вещества называется нормальным. Чаще употребляют децинормальный (0,1 Н) и сантинормальный (0,01 Н). чтобы приготовить 0,1 Н HCl надо приготовить нормальный раствор. Мк Экг = ---------------- количество Н МHCl 1+35,5 ЭгHCl = ----------- = ---------------- = 36,5 1 HHCl = 36.5 гHCl + 963,5гН2О - нормальный 0,1 НHCl = 3,65гHCl + 996.5гH2O – децинормальный 0,01 НH2SO4 0,365=НCl + H2O 1*2 + 32 + 16*4 98 ЭгH2SO4 = ------------------- = ---- = 49 = 2 0,01Н Н2SO4 0,49 = H2SO4 HNaOH = 40= NaOH + H2O HNaOH = 0.4 = NaOH + 999.6 = H2O Если нормальности растворов равны (Н = Н), то и объемы растворов равны. Если нормальности растворов не равны, то V растворов обратнопропорциональны их нормальностям. Vкисл. Н щел. ------------ = --------------- Vщел. Н кисл. Какое вещество 0,1 Н щелочи необходим для нейтрализации 100 гр. 0,01 Н кислоты. Д  ано: 100 0.1 ано: 100 0.1100 гр. Кислоты -------- = -------- 0,1 Н кислонта V щел. 0,01 0,1 Н щелочи 100*0,01  V щел. = -------------------- = 10=0,1 Н щелочи. V щел. = -------------------- = 10=0,1 Н щелочи.V щелочи – ? 0,1 Титр – количество грамм растворенного вещества, содержащегося в 1 мл. раствора. q T=------ г/мл. V Раствор с известным титром называется титрованным. Определить т 0,1 НH2SO4 Н*Эг Т = -------- 1000 0,1 * 49 Т = ------------ = 0,0049 г/мл. 1000 Способы приготовления растворов. Существует 2 способа: из фиксонала весовым Вещество, применяемое для приготовления раствора называется исходным веществом. Оно применяется для определения титра другого раствора. Исходное вещество должно удовлетворять следующим требованиям: должно быть 1. химически чистым, 2. точно соответствовать формуле, указанной на этикетке, 3. должно быть устойчивым при хранении как в твердом, так и в растворенном виде. |