|
|
Химия р-элементов лекц.. Рэлементы и их соединения общая характеристика рэлементов (рблок)
р-ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
1. Общая характеристика р-элементов (р-блок).
К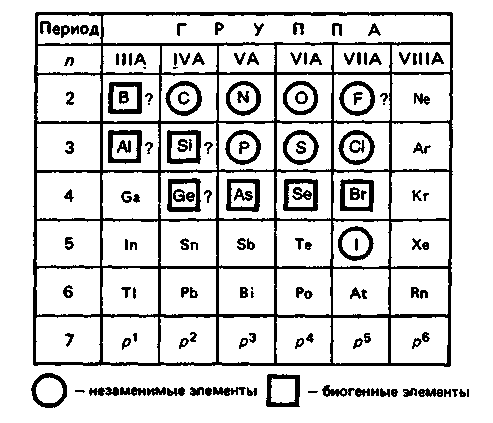 р-блоку относят 30 элементов IIIА—VIIIА-групп периодической системы. р-Элементы входят во второй и третий малые периоды, а также в четвертый — шестой большие периоды. У элементов IIIА-группы появляется первый электрон на р-орбитали. В других группах IVА—VIIIА происходит последовательное заполнение р-подуровня до 6 электронов (отсюда название р-элементы). р-блоку относят 30 элементов IIIА—VIIIА-групп периодической системы. р-Элементы входят во второй и третий малые периоды, а также в четвертый — шестой большие периоды. У элементов IIIА-группы появляется первый электрон на р-орбитали. В других группах IVА—VIIIА происходит последовательное заполнение р-подуровня до 6 электронов (отсюда название р-элементы).
Строение внешних электронных оболочек атомов элементов р-блока (общая формула пs2npa, где а = 1-6).
В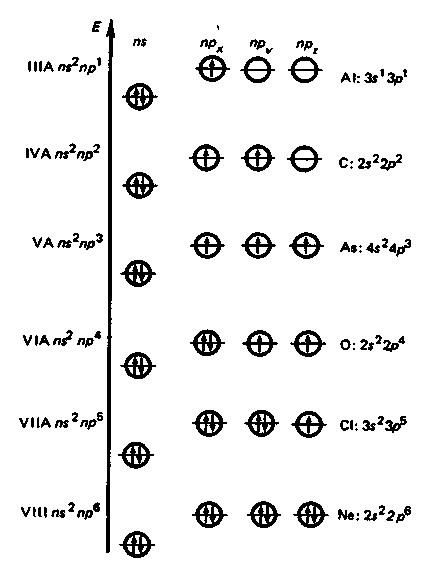 периодах слева направо атомные и ионные радиусы р-элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность элементных веществ и неметаллические свойства усиливаются. периодах слева направо атомные и ионные радиусы р-элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность элементных веществ и неметаллические свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам.
С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, аметаллические усиливаются.
На свойства р-элементов и их соединений оказывает влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение подуровней внутренних электронных оболочек. р-Элементы второго периода — В, С, N, О, F — резко отличаются от элементов нижеследуюших периодов Так, начиная с р-элементов третьего периода, появляется низколежащий свободный d-подуровень, на который могут переводить электроны с р-подуровня при возбуждении атомов Полностью заполненный 3d-полуронень у d-элементов четвертого периода — Gа, Gе, Аs, Sе, Вr — обусловливает отличие их свойств от элементов третьего периода Максимальное заполнение 4f-подуровня в шестом периоде аналогично сказывается на различии свойств р-элементов шестого и пятого периода.
Вдоль периода у р-элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы. Наоборот, способность к образованию отрицательных ионов с зарядом, равным разности (8 — № группы), возрастает при движении вдоль периода.
р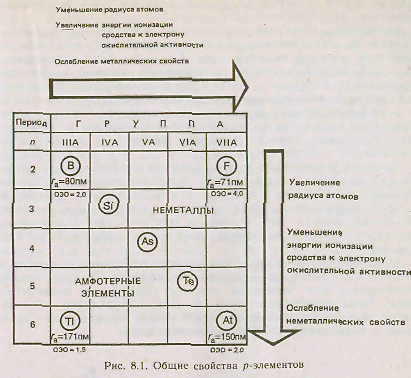 -Элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы Э2 элементов второго периода — N2, О2 и F2. При переходе от IIIА- к IVА- и VА-группам устойчивость молекул возрастает, а затем при переходе к VIIIА-группе понижается. В группах при движении вниз прочность связи Э—Э уменьшается. -Элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы Э2 элементов второго периода — N2, О2 и F2. При переходе от IIIА- к IVА- и VА-группам устойчивость молекул возрастает, а затем при переходе к VIIIА-группе понижается. В группах при движении вниз прочность связи Э—Э уменьшается.
р-Элементы второго периода — азот, кислород и фтор — обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующих периодов эту способность теряют.
Сходство р-элементов второго периода с р-элементами последующих периодов заключается в основном только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот сильно отличаются от остальных элементов своих групп (наличие d- и f-подуровней).
При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химической связи. В этом направлении увеличивается склонность элементов образовывать комплексные соединения и повышаются координационные числа.
Т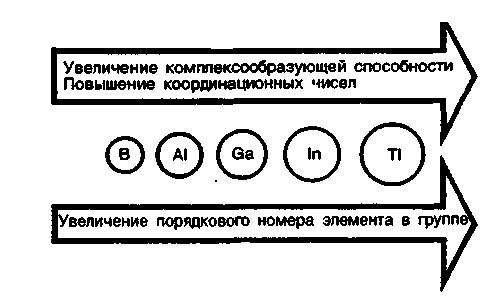 ак, если р-элементы второго периода имеют в соединениях координационные числа 2, 3, 4, то р-элементы последующих периодов могут иметь координационные числа 5, 6, 7, 8 и даже 12. ак, если р-элементы второго периода имеют в соединениях координационные числа 2, 3, 4, то р-элементы последующих периодов могут иметь координационные числа 5, 6, 7, 8 и даже 12.
При переходе вниз по группе устойчивость максимальной положительной степени окисления у р-элементов уменьшается и возрастает устойчивость низших степеней окисления. Так, например, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1.
Физические свойства простых веществ р-элементов сильно различаются. Одни вещества — кислород, азот (газы) — кипят и плавятся при очень низких температурах, другие — бор, углерод — при очень высоких. По группам и периодам физические свойства изменяются немонотонно, и не всегда характер изменений легко связать со строением электронных оболочек атомов, типом химической связи, координационным числом атома.
Таким образом, у p-элементов различия в свойствах соседних элементов как внутри группы, так и по периоду выражены значительно сильнее, чем у s-элементов.
Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N. Р, О, S, Si, Сl) образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений — это соединения р-элементов.
Таким образом, изучение р-элементов особенно важно для медиков, так как пять из них — С, N. Р, О и S — являются органогенамии составляют основу живых систем, а ряд других — Р, Сl, I — незаменимые микроэлементы.
2. Общая характеристика р-элементов IIIА-группы.
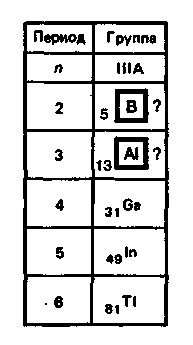
В IIIА-группу периодической системы элементов Д.И. Менделеева входят бор, алюминий, галлий, индий и таллий.
О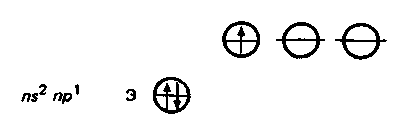 бщая электронная формула валентной оболочки атомов элементов IIIА-группы, где п — номер периода, к которому относится элемент Э. бщая электронная формула валентной оболочки атомов элементов IIIА-группы, где п — номер периода, к которому относится элемент Э.
Атомы этих элементов имеют по три валентных электрона на s- и р-орбиталях внешнего энергетического уровня. В невозбужденном состоянии неспарен только р-электрон. Соответственно в соединениях эти элементы могут проявлять степень окисления +1. Однако, за исключением таллия, для элементов IIIА-группы более характерна степень окисления +3. Это обусловлено тем, что переход электронов с s- на р-подуровень требует не очень большой затраты энергии (возбужденное состояние). Затраты полностью компенсируются при образовании дополнительных химических связей. Так, у бора переход электрона с 2s- на 2р-подуровень требует затраты энергии ΔЕ 530 кДж/моль.
Д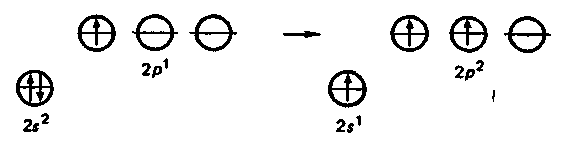 ля таллия степень окисления +3 менее характерна. С увеличением радиуса атома участие s2-электронов в образовании связей уменьшается. Особенно инертна электронная пара 6s2 (Тl — 6s26р1), поэтому таллий в соединениях обычно проявляет степень окисления +1. ля таллия степень окисления +3 менее характерна. С увеличением радиуса атома участие s2-электронов в образовании связей уменьшается. Особенно инертна электронная пара 6s2 (Тl — 6s26р1), поэтому таллий в соединениях обычно проявляет степень окисления +1.
В организме элементы IIIА-группы находятся в степени окисления + 3.
Металлические свойства p-элементов IIIА-группы выражены значительно слабее, чем у соответствующих элементов IIА-и особенно IА-группы. У бора преобладают неметаллические свойства. Так, вода не действует на элементный бор.
В целом с ростом порядкового номера металлические свойства элементов IIIА-группы усиливаются. Однако различие в структуре предвнешних оболочек обусловливает немонотонное изменение металлических свойств элементов в этой группе. От бора к алюминию радиус атома значительно возрастает, и металлические свойства резко увеличиваются.
На свойствах Gа, In, Тl сказывается заполнение d-орбиталей. Так, от Аl к Gа радиус атома (d-сжатие) уменьшается, а энергия ионизации увеличивается. При переходе от In к Тl происходит лишь незначительное увеличение радиуса атома (лантаноидное сжатие) и даже некоторое возрастание энергии ионизации. В результате таллий по своим свойствам резко отличается от свойств других элементов группы.
В отличие от бора элементные алюминий, галлий, индий и таллий представляют собой серебристо-белые мягкие металлы. Они легко растворяются в кислотах, а Аl, Gа и In — в щелочах. Их оксиды Э2О3 и гидроксиды Э(ОН)3 амфотерны, за исключением таллия гидроксида Тl(ОН)3, обладающего только основными свойствами.
Наличие свободных d-орбиталей во внешней электронной оболочке у атомов Аl, Gа, In, Тl сказывается на способности этих элементов проявлять более высокие координационные числа по сравнению с бором. Для бора характерно координационное число 4 (sр3-гибридизация; образуется, например, анион [В(ОН)4]-). Для Аl, Gа, In, Тl кроме координационного числа 4 типично координационное число 6 (sр3d2-гибридизация; образуется, например, анион [Аl(ОН)6]3-).
Из соединений элементов IIIА-группы наибольший интерес в биологии и медицине представляют как обычные, так и комплексные кислородные соединения бора и алюминия.
Химические свойства кислородных соединений бора. Оксид бора В2О3 имеет кислотный характер. В2О3 растворяется в воде с образованием ортоборной кислоты:
В2О3 + 3Н2О = 2Н3ВО3
Ортоборная кислота Н3ВО3 — белое кристаллическое вещество, относится к очень слабым кислотам.
В отличие от других кислот, ее протолитические свойства связаны не с отщеплением протонов, а с присоединением ионов ОН-:
Н3ВО3 + Н2О ⇄ [В(ОН)4]- + Н+
Ортоборная кислота при нагревании легко теряет воду и превращается в метаборную кислоту НВО2, затем в тетраборную кислоту Н2В4О7 и, наконец, в оксид В2О3.
При нейтрализации Н3ВО3 щелочью образуются комплексные анионы, например:
Н3ВО3 + ОН- ⇄ [В(ОН)4]-
При избытке щелочи получаются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например:
4Н3ВО3 + 2NаОН + 3Н2О = Nа2В4О7∙10Н2О
Ортобораты даже щелочных металлов не образуются, так как кислота Н3ВО3 очень слабая и ее соли подвергаются гидролизу.
Ортоборную кислоту применяют в качестве антисептического средства. Высокая растворимость борной кислоты в липидах обеспечивает быстрое проникновение ее в клетки через липидные мембраны. В результате происходит свертывание белков (денатурация) цитоплазмы микроорганизмов и их гибель.
Как антисептик широко применяют и буру — кристаллогидрат натрия тетрабората Nа2В4О7∙10Н2О. Фармакологическое действие препарата обусловлено гидролизом соли с выделением борной кислоты:
Nа2В4О7 + 7Н2О = 4Н3ВО3 + 2NаОН
Образующиеся щелочь и кислота вызывают свертывание белков микробных клеток.
В зубопротезировании борную кислоту Н3ВО3 используют в качестве наполнителя формы при отливке стальных зубов.
В состав стоматологических паст, применяемых как клей-прослойка для зубных протезов, входит натрий метаборат NаВО2 в смеси с алюминием гидроксидом Аl(ОН)3.
В водном растворе с многоатомными спиртами и полифенолами борная кислота реагирует по схеме (биологически важная реакция):
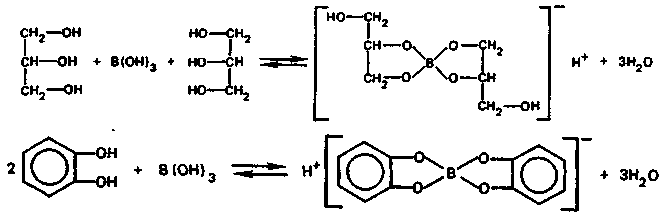
Химические свойства кислородных соединении алюминия. Алюминий, в отличие от бора, является типичным амфотерным элементом. Металлические свойства выражены у алюминия гораздо сильнее, чем у бора. В большинстве соединений атомы алюминия находятся в состоянии sp3d2-гибридизации. Поэтому для алюминия наиболее характерно координационное число 6. Реже в соединениях атом алюминия находится в состоянии sp3-гибридизации (координационное число 4).
Элементный алюминий — активный металл белого цвета. Имеет большое сродство к кислороду, поэтому на воздухе металл быстро покрывается защитной оксидной пленкой. Несмотря на отрицательное значение окислительно-восстановительного потенциала, алюминий, вследствие покрытия его поверхности прочной оксидной пленкой, не вытесняет водород из воды. После удаления защитной пленки алюминий энергично взаимодействует с водой, вытесняя из нее водород:
2Аl(т) + 6Н2О(ж) = 2Аl(ОН)3(т) + 3Н2(г)
Являясь амфотерным, алюминий растворяется в кислотах — соляной, разбавленной серной,, а также в щелочах, образуя соответствующие катионные и анионные комплексы:
2Аl + 6НСl + 12Н2О = 2[Аl(Н2O)6]Сl3 + 3Н2
2Аl + 6NаОН + 6Н2О = 2Nа3[Аl(ОН)6] + 3Н2
В водном растворе, даже очень кислом, свободные ионы Аl3+ не существуют из-за гидратации.
Оксид алюминия — составная часть зубоврачебных цементов — «цемента для фиксации несъемных протезов», силикатного цемента «силиции», применяемого для пломбирования зубов, фиксации одиночных коронок, мостов. При употреблении напитков (например, «фанта») и пищи с повышенной кислотностью такие цементы довольно быстро разрушаются.
Алюминий гидроксид легко образуется при действии щелочей на растворы солей алюминия:
Аl3+(р) + 3ОН-(р) = Аl(ОН)3(т)
Алюминий гидроксид растворяется как в кислотах, так и в щелочах, т.е. является типичным амфотерным соединением.
В щелочных растворах наряду с гексагидроксоалюминат-ионами присутствуют и другие ионы, например [Аl(ОН)5]2-, [Аl(ОН)4]-.
Соли алюминия и кислородсодержащих кислот растворимы в воде. Исключение составляет алюминий фосфат АlРО4. Образование малорастворимого фосфата играет важную роль в жизнедеятельности организмов. Усвоение фосфора организмом уменьшается в присутствии катионов Аl3+ вследствие образования в кишечнике малорастворимого алюминий фосфата. Это обстоятельство необходимо учитывать при назначении препаратов алюминия, например средства против повышенной кислотности желудка Аl(ОН)3.
В желудке алюминий гидроксид образует гель, который нейтрализует оксоний-ионы желудочного сока:
Аl(ОН)3 + 3Н3О+ = Аl3+ + 6Н2О
Перешедшие в раствор ионы алюминия в кишечнике переходят в малорастворимую форму — алюминий фосфат:
Аl3+(р) +РО43-(р) = АlРO4(т)
Вследствие сильного гидролиза многие соли алюминия не удается выделить из водных растворов (например, сульфид, карбонат, цианид и др.):
Аl2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S
Из кристаллогидратов солей алюминия в медицинской практике находят применение калий-алюминий сульфат (квасцы алюмокалиевые) КАl(SО4)2∙12Н2О и жженые квасцы КАl(SО4)2, которые получают нагреванием алюмокалиевых квасцов при температуре не выше 433 К. Эти препараты обладают вяжущим действием.
Фармакологическое действие солей алюминия основано на том, что ионы Аl3+ образуют с белками (протеинами Рr) комплексы, выпадающие в виде гелей:
Аl3+ + Рr → АlРr
Это приводит к гибели микробных клеток и снижает воспалительную реакцию.
Квасцы применяют для полосканий, промываний и примочек при воспалительных заболеваниях слизистых оболочек и кожи. Кроме того, этот препарат применяют как кровоостанавливающее средство при порезах (свертывающее действие).
Жженые квасцы используют в виде присыпок как вяжущее и высушивающее средство при потливости ног. Осушающее действие связано с тем, что жженые квасцы медленно поглощают воду:
КА1(5О4)2 + хН2О= КА1(5О4)2-*Н2О
Вяжущим действием обладает и жидкость Бурова — 8%-ный раствор алюминия ацетата Аl(СН3СОО)3.
В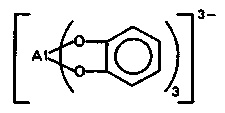 живых организмах с биолигандами (оксикислотами, полифенолами, углеводами, липидами) алюминий образует хелатные комплексные соединения. Как правило, связи с органическими лигандами он образует через атомы кислорода. Например, при взаимодействии Аl3+ с полифенолами получаются комплексные соединения следующего состава: живых организмах с биолигандами (оксикислотами, полифенолами, углеводами, липидами) алюминий образует хелатные комплексные соединения. Как правило, связи с органическими лигандами он образует через атомы кислорода. Например, при взаимодействии Аl3+ с полифенолами получаются комплексные соединения следующего состава:
В стоматологической практике находят широкое применение соединения алюминия, например белая глина (каолин) Аl2О3∙SiO2∙2Н2О. Каолин входит в состав цементов, которые используют как временный пломбировочный материал, а также для штамповки коронок.
Химические свойства кислородных соединений галлия, индия, таллия. Аналогично алюминию для Gа, In и Тl наиболее характерно координационное число 6. Как и для алюминия, при растворении гидроксидов и оксидов этих элементов в кислотах образуются аквакомплексы состава [Э(Н2О)6]3+, а при растворении в щелочах — гидроксокомплексы состава М[Э(ОН)4] или М3[Э(ОН)6]. Оксиды и гидроксиды Gа (III), In (III) и Тl (III) являются амфотерными соединениями.
Таллий в соединениях проявляет степень окисления +1. Ион Тl+ имеет радиус и строение валентной оболочки, близкие ионам К+, Аg+. Вследствие этого химические и токсические свойства соединений Тl (I) похожи на свойства соединений серебра.
Таллий оксид и гидроксид обладают ярко выраженными основными свойствами. Соли таллия (I) либо не гидролизуются, либо при гидролизе образуют щелочную среду. Соединения галлия, индия и, в особенности, таллия ядовиты. |
|
|
 Скачать 0.81 Mb.
Скачать 0.81 Mb.