Химия р-элементов лекц.. Рэлементы и их соединения общая характеристика рэлементов (рблок)
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
3. Биологическая роль р-элементов IIIА-группы. Применение их соединений в медицине. 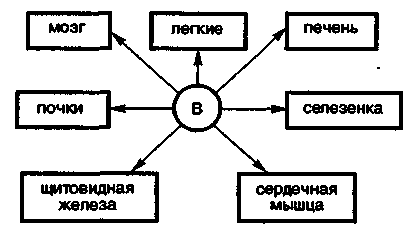 Бор. Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5%. Бор концентрируется главным образом в легких (0,34мг), щитовидной железе (0,30мг), селезенке (0,26мг), печени, мозге (0,22мг), почках, сердечной мышце (0,21мг). Биологическое действие бора еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, очевидно, в виде труднорастворимых солей борной кислоты с катионами металлов Бор. Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5%. Бор концентрируется главным образом в легких (0,34мг), щитовидной железе (0,30мг), селезенке (0,26мг), печени, мозге (0,22мг), почках, сердечной мышце (0,21мг). Биологическое действие бора еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, очевидно, в виде труднорастворимых солей борной кислоты с катионами металловИзбыток бора вреден для организма человека. Имеются данные, что большой избыток бора угнетает амилазы, протеиназы, уменьшает активность адреналина. Предполагается, что снижение активности адреналина, являющегося производным полифенола, связано с его взаимодействием с ортоборной кислотой. Давно известно, что бор необходим высшим растениям, однако данные о его биологической роли противоречивы. Исследования, проведенные в последние годы, показали, что бор является необходимым элементом для некоторых животных. Установлено, что бор участвует в углеродно-фосфатном обмене, взаимодействует с рядом биологически активных соединений (углеводами, ферментами, витаминами, гормонами). Вместе с тем употребление пищевых продуктов с большим содержанием , бора нарушает в организме обмен углеводов и белков, что приводит к возникновению эндемических кишечных заболеваний — энтеритов. 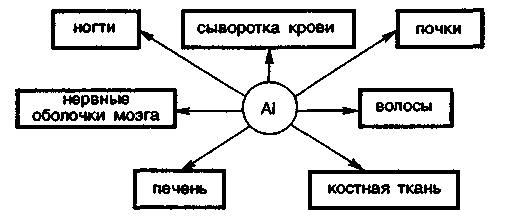 Алюминий. По содержанию в организме человека (10-5%) алюминий относится к примесным микроэлементам. Алюминий концентрируется главным образом в сыворотке крови, легких, печени, костях, почках, ногтях, волосах, входит в структуру нервных оболочек мозга человека. Алюминий. По содержанию в организме человека (10-5%) алюминий относится к примесным микроэлементам. Алюминий концентрируется главным образом в сыворотке крови, легких, печени, костях, почках, ногтях, волосах, входит в структуру нервных оболочек мозга человека.Суточное потребление алюминия человеком составляет 47 мг. Алюминий влияет на развитие эпителиальной и соединительной тканей, на регенерацию костных тканей, влияет на обмен фосфора. Алюминий оказывает воздействие на ферментативные процессы. В большинстве случаев катион Аl3+ замещает ионы Э2+ — активаторы ферментов Е, например ионы Мg2+, Са2+: Э2+Е + Аl3+ ⇄ Э2+ + Аl3+Е Такая взаимозамещаемость возможна вследствие сходства ряда свойств ионов Аl3+ и Мg2+, Са2+. Например, ионы Аl3+ и Мg2+ имеют близкие радиусы, одинаковые координационные числа — 6. Ионы Аl3+ и Са2+ имеют близкие энергии ионизации, одинаковые координационные числа — 6. Избыток алюминия в организме тормозит синтез гемоглобина, так как благодаря довольно высокой комплексообразующей способности алюминий блокирует активные центры ферментов, участвующих в кроветворении. Имеются данные, что алюминий может катализировать реакцию трансаминирования (перенос NH2-группы). Галлий. Галлий — примесный микроэлемент (содержание в организме человека 10-6—10-5%). Биологическая роль галлия в живых организмах почти не выяснена. Индий. В настоящее время биологическое действие индия неизвестно. Не имеется достоверных сведений о его наличии в живых организмах. Учитывая близость атомного строения и физико-химических свойств индия и галлия, можно прогнозировать сходство их биологического действия. Очевидно, индий, как и алюминий, попадая в организм, должен накапливаться в костной и других тканях в виде малорастворимого фосфата. Соединения индия в медицине не применяют. Таллий. Таллий относится к весьма токсичным элементам. Ион Тl+ склонен, подобно Аg+, образовать прочные соединения с серосодержащими лигандами: Тl+ + R—SН → R—S—Тl + Н+ Вследствие этого он очень токсичен, так как подавляет активность ферментов, содержащих тиогруппы —SН. Даже весьма незначительные количества соединений Тl+ при попадании в организм вызывают выпадение волос. Вследствие близости радиусов К+ и Тl+ они обладают сходными свойствами и способны замещать друг друга в ферментах. Ионы Тl+ и К+ являются синергистами. Этим объясняется тот факт, что ферменты пируваткиназа и диолдегидратаза активируются не только ионами К+, но и ионами Тl+ (ион Тl+ замещает ион К+ в каталитическом центре ферментов). Синергизм таллия и калия проявляется и в том, что, подобно ионам К+, ионы Тl+ накапливаются в эритроцитах. В качестве противоядия при отравлении ионами Тl+ используют серосодержащий лиганд — аминокислоту цистин НS—СН2СН(NН2)СООН. В заключение необходимо отметить, что биологическая роль р-элементов IIIА-группы изучена недостаточно. В настоящее время известно, что бор и галлий взаимодействуют в растениях с ингибиторами их развития полифенолами, уменьшая токсичность последних. Установлена также несомненная роль алюминия в построении эпителиальной и соединительной тканей, а кроме того, его участие в ферментативных процессах как в качестве активатора, так и в качестве ингибитора. Свойством ингибировать многие серосодержащие ферменты обладает ион Тl+. Биологическая активность р-элементов IIIА-группы связана главным образом с их способностью к образованию комплексных соединений с кислородсодержащими лигандами и нерастворимых фосфатов. 4. Общая характеристика р-элементов IVА-группы. I 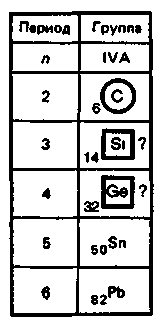  VА-группу периодической системы элементов Д.И. Менделеева составляют углерод, кремний, германий, олово, свинец. Общая электронная формула валентной оболочки атомов элементов IVА-группы. VА-группу периодической системы элементов Д.И. Менделеева составляют углерод, кремний, германий, олово, свинец. Общая электронная формула валентной оболочки атомов элементов IVА-группы.Атомы этих элементов имеют по четыре валентных электрона на s- и р-орбиталях внешнего энергетического уровня. В невозбужденном состоянии не спарены два р-электрона. Следовательно, в соединениях эти элементы могут проявлять степень окисления +2. Но в возбужденном состоянии электроны внешнего энергетического уровня приобретают конфигурацию пs1пр3 , и все 4 электрона оказываются неспаренными. Н 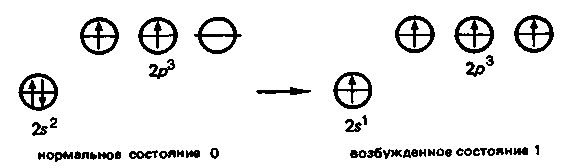 апример, для углерода переход с s-подуровня на р-подуровень можно представить следующим образом. апример, для углерода переход с s-подуровня на р-подуровень можно представить следующим образом.В соответствии с электронным строением возбужденного состояния элементы IVА-группы могут проявлять в соединениях степень окисления +4. Радиусы атомов элементов IVА-группы закономерно возрастают с увеличением порядкового номера. В этом же направлении закономерно снижается энергия ионизации и электроотрицательность. П 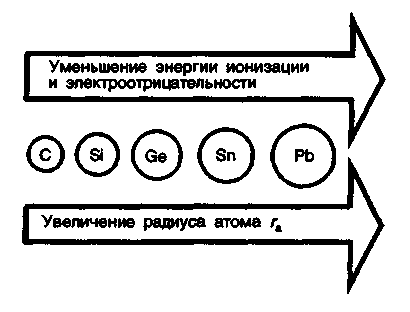 ри переходе в группе С—Si—Gе—Sn—Рb уменьшается роль неподеленной электронной пары на внешнем s-подуровне при образовании химических связей. Поэтому если для углерода, кремния и германия наиболее характерна степень окисления +4, то для свинца +2. ри переходе в группе С—Si—Gе—Sn—Рb уменьшается роль неподеленной электронной пары на внешнем s-подуровне при образовании химических связей. Поэтому если для углерода, кремния и германия наиболее характерна степень окисления +4, то для свинца +2.В живом организме углерод, кремний и германий находятся в степени окисления +4, для олова и свинца характерна степень окисления +2. В 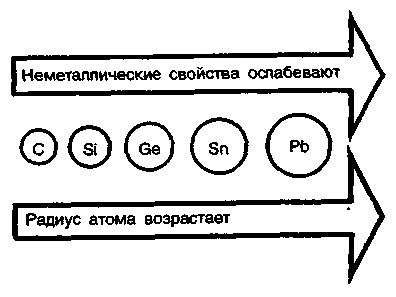 соответствии с возрастанием размеров атомов и падением энергии ионизации при переходе от углерода к свинцу неметаллические свойства ослабевают, так как снижается способность присоединять электроны и увеличивается легкость их отдачи. Действительно, первые два члена группы: углерод и кремний — типичные неметаллы, германий, олово и свинец — амфотерные элементы с ярко выраженными металлическими свойствами у последнего. соответствии с возрастанием размеров атомов и падением энергии ионизации при переходе от углерода к свинцу неметаллические свойства ослабевают, так как снижается способность присоединять электроны и увеличивается легкость их отдачи. Действительно, первые два члена группы: углерод и кремний — типичные неметаллы, германий, олово и свинец — амфотерные элементы с ярко выраженными металлическими свойствами у последнего.Усиление металлических признаков в ряду С—Si—Gе—Sn—Рb проявляется и в химических свойствах простых веществ. В обычных условиях элементы С, Si, Gе и Sn устойчивы по отношению к воздуху и воде. Свинец же окисляется на воздухе. В электрохимическом ряду напряжений металлов Gе располагается после водорода, а Sn и Рb непосредственно перед водородом. Поэтому германий не реагирует с кислотами типа НСl и разбавленной Н2SО4. Электронное строение и размер атома, среднее значение электроотрицательности объясняют прочность связи С—С и склонность атомов углерода к образованию длинных гомоцепей: 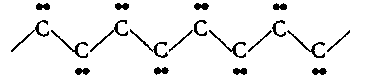 Благодаря промежуточному значению электроотрицательности углерод образует малополярные связи с жизненноважными элементами — водородом, кислородом, азотом, серой и др. Молекулы, содержащие С—С-связи, могут иметь линейное, разветвленное и циклическое строение. Различные органические молекулы, содержащие связанные между собой атомы углерода с разнообразными заместителями, образуют громадное число биомолекул. Химические свойства кислородных соединений углерода и кремния. Среди неорганических соединений углерода, кремния и их аналогов для медиков и биологов наибольший интерес представляют кислородные соединения этих элементов. Углерод (IV) и кремний (IV) оксиды ЭО2 являются кислотными, и соответствующие им гидроксиды Н2ЭО3 — слабыми кислотами. Соответствующие оксиды и гидроксиды остальных элементов IVА-группы амфотерны. Диоксид углерода СО2. постоянно образуется в тканях организма в процессе обмена веществ и играет важную роль в регуляции дыхания и кровообращения. Диоксид углерода является физиологическим стимулятором дыхательного центра. Большие концентрации СО2 (свыше 10%) вызывают сильный ацидоз — снижение рН крови, бурную одышку и паралич дыхательного центра. Диоксид углерода растворяется в воде. При этом в растворе образуется угольная кислота: Н2О + СО2 ⇄ Н2СО3 Равновесие смещено влево, поэтому большая часть углерода диоксида находится в виде гидрата СО2∙Н2О, а не Н2СО3. Угольная кислота Н2СО3 существует только в растворе. Относится к слабым кислотам. Как двухосновная кислота, Н2СО3 образует средние и кислые соли: первые называются карбонатами: Nа2СО3, СаСО3 —карбонаты натрия и кальция; вторые — гидрокарбонатами: NаНСО3, Са(НСО3)2 —гидрокарбонаты натрия и кальция. Все гидрокарбонаты хорошо растворимы в воде; из средних солей растворимы карбонаты щелочных металлов и аммония. Растворы солей угольной кислоты вследствие гидролиза имеют щелочную реакцию (рН>7), например: Nа2СО3 + НОН ⇄ NаНСО3 + NаОН СО32- + НОН ⇄ НСO3- + ОН- Водородкарбонатная буферная система (Н2СО3—НСО3-) служит главной буферной системой плазмы крови, обеспечивающей поддержание кислотно-основного гомеостаза, постоянного значения рН крови порядка 7,4. Так как при гидролизе карбонатов и гидрокарбонатов получается щелочная среда, эти соединения применяют в медицинской практике в качестве антацидных (нейтрализующих кислоты) средств при повышенной кислотности желудочного сока. К ним относятся гидрокарбонат натрия NаНСО3 и карбонат кальция СаСО3: NаНСО3 + НСl = NaСl + Н2О + СО2 СаСО3 + 2НСl = СаСl2 + Н2О + СО2 В силикатный цемент, содержащий SiO2, добавляется жидкость, которая представляет собой водный раствор ортофосфорной кислоты Н3РО4, частично нейтрализованный оксидом цинка ZnО и гидроксидом алюминия Аl(ОН)3. Процесс «схватывания» силикат-цемента начинается с разложения порошка ортофосфорной кислотой с образованием коллоидных растворов фосфата алюминия и кремниевых кислот переменного состава xSiO2∙yН2О: Аl2О3 + 2Н3РО4 = 2АlРО4 + 3Н2О хSiO2 + уН3О+ = хSiO2∙уН2О+ yН+ В процессе приготовления пломб в результате перемешивания происходят химические реакции с образованием фосфатов металлов, например 3СаО + 2Н3РО4 = Са3(РО4)2 + 3Н2О В воде хорошо растворимы силикаты только щелочных металлов. При действии минеральных кислот на растворы силикатов получают кремниевые кислоты, например метакремниевую Н2SiO3 и ортокремниевую Н4SiO4. Кремниевые кислоты слабее угольной, они выпадают в осадок при действии СО2 на растворы силикатов. Силикаты сильно гидролизуются. Это является одной из причин разрушения силикатов в природе. При сплавлении различных смесей силикатов друг с другом или с кремнием диоксидом получаются прозрачные аморфные материалы, называемые стеклами. Состав стекла может изменяться в широких пределах и зависит от условий получения. Кварцевое стекло (почти чистый кремнезем) переносит резкие изменения температуры, почти не задерживает ультрафиолетовые лучи. Такое стекло используют для приготовления ртутно-дуговых ламп, которые широко применяют в физиотерапии, а также стерилизации операционных. Фарфоровые массы, применяемые в ортопедической стоматологии, состоят из кварца SiO2 (15—35%) и алюмосиликатов: полевого шпата Э2О∙Аl2О3∙6SiO2, где Э— К, Na или Са (60—75%), и каолина Аl2О3∙2SiO2∙2Н2О (3—10%). Соотношение компонентов может меняться в зависимости от назначения фарфоровой массы. Полевой шпат К2О∙Аl2О3∙6SiO2 — основной материал для получения стоматологических фарфоровых масс. При плавлении он превращается в вязкую массу. Чем больше полевого шпата, тем прозрачнее фарфоровая масса после отжига. При отжиге фарфоровых масс полевой шпат, как более легкоплавкий, понижает температуру плавления смеси. Каолин (белая глина) — необходимая часть стоматологического фарфора. Добавка каолина уменьшает текучесть фарфоровой массы. Кварц, входящий в состав стоматологического фарфора, упрочняет керамическое изделие, придает ему большую твердость и химическую стойкость. Моноксид углерода СО. Из соединений элементов IVА-группы, в которых они проявляют степень окисления +2, интерес для медиков и биологов представляет оксид углерода (II) СО. Это соединение ядовито и чрезвычайно опасно, потому что не имеет запаха. Оксид углерода (II) — угарный газ — продукт неполного окисления углерода. Как это ни парадоксально, одним из источников СО является сам человек, организм которого производит и выделяет во внешнюю среду (с выдыхаемым воздухом) за сутки около 10мл СО. Это так называемый эндогенный оксид углерода (II), который образуется в процессах кроветворения. Проникая с воздухом в легкие, оксид углерода (II) быстро проходит через альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает в обратимое химическое взаимодействие как с окисленным НbО2, так и с восстановленным гемоглобином Нb: НbО2 + СО ⇄ НbСО + О2 Нb + СО ⇄ НbСО Образующийся карбонилгемоглобин НbСО не способен присоединять к себе кислород. Вследствие этого становится невозможным перенос кислорода от легких к тканям. Высокое химическое сродство оксида углерода (II) СО к двухвалентному железу является основной причиной взаимодействия СО с гемоглобином. Можно полагать, что и другие бионеорганические соединения, содержащие ионы Fе2+, должны реагировать с этим ядом. Так как реакция взаимодействия оксигемоглобина с угарным газом обратима, то повышение в дыхательной среде парциального давления О2 будет ускорять диссоциацию карбонилгемоглобина и выделение СО из организма (равновесие смешается влево по принципу Ле Шателье): НbО2 + СО ⇄ НbСО + О2 В настоящее время имеются лечебные препараты, которые используют в качестве антидотов при отравлении организма оксидом углерода (II). Например, введение восстановленного железа резко ускоряет удаление СО из организма в виде, очевидно, карбонила железа. Действие этого препарата основано на способности СО выступать в качестве лиганда в различных комплексах. Химические свойства соединений олова и свинца. Оксиды олова (II) и свинца (II), SnО и РbО амфотерны, так же как и соответствующие им гидроксиды Sn(ОН)2 и Рb(ОН)2. Соли Рb2+ — ацетат, нитрат — хорошо растворимы в воде, малорастворимы хлорид и фторид, практически нерастворимы сульфат, карбонат, хромат, сульфид. Все соединения свинца (II), в особенности растворимые, ядовиты. Биологическая активность свинца определяется его способностью проникать в организм и накапливаться в нем. Свинец и его соединения относятся к ядам, действующим преимущественно на нервно-сосудистую систему и непосредственно на кровь. Химизм токсического действия свинца весьма сложен. Ионы Рb2+ являются сильными комплексообразователями по сравнению с катионами остальных р-элементов IVА-группы. Они образуют прочные комплексы с биолигандами. Ионы Рb2+ способны взаимодействовать и блокировать сульфгидрильные группы SН белков, в молекулах ферментов, участвующих в синтезе порфиринов, регулирующих синтез тема и других биомолекул: R—SН + Рb2+ + НS—R → R—S—Рb—S—R + 2Н+ Часто ионы Рb2+ вытесняют естественные ионы М2+, ингибируя металлоферменты ЕМ2+: ЕМ2+ + Рb2+ → ЕРb2+ + М2+ Вступая в реакции с цитоплазмой микробных клеток и тканей, ионы свинца образуют гелеобразные альбуминаты. В небольших дозах соли свинца оказывают вяжущее действие, вызывая гелефикацию белков. Образование гелей затрудняет проникновение микробов внутрь клеток и снижает воспалительную реакцию. На этом основано действие свинцовых примочек. По мере увеличения концентрации ионов Рb2+ образование альбуминатов приобретает необратимый характер, накапливаются альбуминаты белков R—СООН поверхностных тканей: Рb2+ + 2R—СООН = Рb(R—СОО)2 + 2Н+ Поэтому препараты свинца (II) оказывают преимущественно вяжущее действие на ткани. Их назначают исключительно для наружного применения, поскольку, всасываясь в желудочно-кишечном тракте или дыхательных путях, они проявляют высокую токсичность. Неорганические соединения олова (II) не очень ядовиты, в противоположность органическим соединениям олова. |
