Химия р-элементов лекц.. Рэлементы и их соединения общая характеристика рэлементов (рблок)
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
9. Биологическая роль р-элемеитов VIА-группы. Применение их соединений в медицине. Кислород. По содержанию в организме человека (мас. доля 62%) кислород относится к макроэлементам. Он незаменим и принадлежит к числу важнейших элементов, составляющих основу живых систем, т.е. является органогеном. Кислород входит в состав огромного числа молекул, начиная от простейших и кончая биополимерами. Исключительно велика роль кислорода в процессах жизнедеятельности, так как окисление кислородом питательных веществ — углеводов, белков, жиров — служит источником энергии, необходимой для работы органов и тканей живых организмов. Большинство окислительно-восстановительных реакций в организме протекает при участии кислорода и его активных форм. Фагоцитарные (защитные) функции организма также связаны с наличием кислорода, и уменьшение содержания кислорода в организме понижает его защитные свойства. В фагоцитах (клетках, способных захватывать и переваривать посторонние тела) кислород О2 восстанавливается до супероксид-иона О2-. Ион О2- — радикал, инициирующий радикальноцепные процессы окисления инородных органических веществ RН, захваченных фагоцитами. При недостатке кислорода эти процессы замедляются, и в результате сопротивляемость организма к инфекциям снижается. В медицинской практике кислород применяют для вдыхания при болезненных состояниях, сопровождающихся кислородной недостаточностью (гипоксией), заболеваниях дыхательных путей, сердечно-сосудистой системы, отравлениях оксидом углерода (II) СО, синильной кислотой НСN, а также при заболеваниях с нарушениями функций дыхания. Широко используется в клинической практике гипербарическая оксигена-ция — применение кислорода под повышенным давлением. Установлено, что гипербарическая оксигенация значительно улучшает кислородное насыщение тканей, гемодинамику, защищает головной мозг от гипоксии. Этот метод лечения с высокой эффективностью применяют в кардиологии, реанимации, неврологии, хирургии и других областях медицины. Для общего улучшения обменных процессов при лечении сердечно-сосудистых заболеваний в желудок вводят кислородную пену в виде так называемого кислородного коктейля. Аллотропную модификацию кислорода — озон О3 как очень сильный окислитель используют для дезинфекции помещений, обеззараживания воздуха и очистки питьевой воды. Небольшая примесь озона в воздухе создает ощущение приятной свежести и благотворно действует на состояние человека, особенно легочных больных. При использовании кислорода О2 и озона О3 следует учитывать их токсичность, обусловленную интенсификацией процессов окисления в организме. Сера. По содержанию в организме человека (мас. доля 0,16%) сера относится к макроэлементам. Как и кислород, она жизненно необходима. Суточная потребность взрослого человека в сере около 4—5г. Сера входит в состав многих биомолекул — белков, аминокислот (цистина, цистеина, метионина и др.). гормонов (инсулина), витаминов (витамин В12). Много серы содержится в каротине волос, костях, нервной ткани. Аминокислоты, содержащие серу, характеризуются наличием водородсульфидных (тиоловых) —SН-групп (например, цистеин) или наличием дисульфидных связей —S—S— (например, цистин). При окислении тиоловых групп образуются дисульфидные связи и, наоборот, при восстановлении связей —S—S— образуются SН-группы, т.е. эти переходы обратимы: R1—S—S—R2 ⇄ R1SН + R2SН В некоторой степени этот обратимый переход защищает организм от радиационных поражений. Под влиянием ионизирующего облучения в результате радиолиза воды в организме образуются свободные радикалы, в том числе весьма активные Н• и ОН• , инициирующие процессы окисления. Водородсульфидные группы вступают в реакции со свободными радикалами: RSН + ОН• → RS• + Н2O Радикалы RS• малоактивны. Тем самым предотвращается воздействие активных радикалов на нуклеиновые кислоты и другие биомолекулы. В 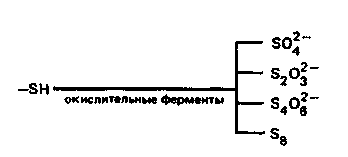 живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Кроме того, образуются тиосульфаты, элементная сера и политионовые кислоты: живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Кроме того, образуются тиосульфаты, элементная сера и политионовые кислоты:Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений — фенола, крезола, индола, вырабатываемых в кишечнике из аминокислот микробами. Кроме того, серная кислота связывает многие чужеродные для организма соединения (ксенобиотики) —лекарственные препараты и их метаболиты. Со всеми этими соединениями серная кислота образует относительно безвредные вещества — конъюгаты, в виде которых они и выводятся из организма. Например, с мочой человека выделяется конъюгат — калиевая соль сернокислого эфира фенола: В медицинской практике широко применяют как саму серу, так и многие ее соединения: сера осажденная, натрий тиосульфат, сульфаты натрия, меди, цинка и др. Селен. По содержанию в организме (мас доля 10-5—10-7%) селен относится к микроэлементам. Некоторые исследователи относят его к жизненно необходимым элементам. Селен поступает с пищей — 55—110мг в год. Селен в основном концентрируется в печени и почках. Концентрация селена в крови составляет 0,001—0,004 ммоль/л. Несомненна связь селена с серой в живых организмах. При больших дозах селен в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты. Очевидно, селен как аналог серы замещает ее в различных соединениях: R—S—S—R → R—Sе—Sе—R Токсическое действие селенитов и селенатов на сельскохозяйственных животных давно известно Связанные с селеном заболевания скота наблюдались в местах, где в почве в повышенных количествах присутствуют эти соли. Тем неожиданнее оказались результаты опытов, в которых было обнаружено, что селен, правда, в значительно меньших количествах должен содержаться в пище крыс, цыплят, телят, ягнят и кроликов. Установлено, что недостаток селена ведет к уменьшению концентрации фермента глутатионпероксидазы, что, в свою очередь, приводит к окислению линидов и серосодержащих аминокислот. Проведенные в последние годы исследования показали, что селен в комплексе с какой-либо кислотой входит в состав активных центров нескольких ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы. В частности, в активном центре глутатионпероксидазы содержится остаток необычной аминокислоты — селеноиистеина: 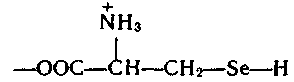 Этот фермент вместе с белком глутатионом и защищает клетки от разрушающего действия органических пероксйдов RООН и пероксида водорода. Возможно, что водородселенидная группа —SеН остатка селеноцистеина обладает какими-то преимуществами по сравнению с водородсульфидной группой —SН в механизме действия этого и других селенсодержащих ферментов. Следует отметить, что компенсация недостатка селена в организме путем добавления в рацион крыс натрия селенита Nа2SеО3 способствовала предохранению от некроза тканей. Это еще раз подчеркивает физиологическую роль селена в процессе жизнедеятельности. Хорошо известна и способность селена предохранять организм от отравления ртутью Нg и кадмием Сd. Оказалось, что селен способствует связыванию этих токсичных металлов с другими активными центрами — с теми, на которые их токсическое действие не влияет. Интересным является и факт взаимосвязи между высоким содержанием селена в .рационе и низкой смертностью от рака. В больших дозах, как уже отмечалось, селен токсичен. Распад соединений селена в организме животных приводит к выделению высокотоксичного диметилселена СН3—Sе—СН3, имеющего чесночный запах. Установлен механизм этой реакции. При взаимодействии селенистой кислоты H2SеО3 с глутатионом образуются соединения, содержащие группу —S—Sе—S— Н2SеО3 + 4GSН → GSSeSG + GSSG + 3Н2О Под действием ферментов соединения, содержащие группу —S—Sе—S—, восстанавливаются до диводородселенида: GSSeSG → H2Sе который затем присоединяет метильные группы, образуя диметилселен. Теллур и полоний. Теллур обнаружен в живых организмах. Норма его содержания в тканях и органах не установлена. Не выяснен и вопрос, играет ли он какую-нибудь биологическую роль в живых организмах. Известно только, что введение в организм в избытке соединений теллура ведет, как и в случае селена, к замещению серы в тиоловых группах, что приводит к ингибированию ферментов. Данные о влиянии полония на живые организмы отсутствуют. Таким образом, среди элементов VIА-группы жизненно необходимыми являются макроэлементы кислород и сера. Селен физиологически активен, а биологическое действие теллура и полония не выявлено. В живых организмах кислород, сера и селен входят в состав биомолекул в степени окисления —2, причем вследствие близости физико-химических характеристик их атомов сера, селен и теллур могут замещать друг друга в соединениях Наблюдаются как случаи синергизма, так и антагонизма этих элементов. 10. Общая характеристика р-элементов VIIA-группы. Галогены. Э 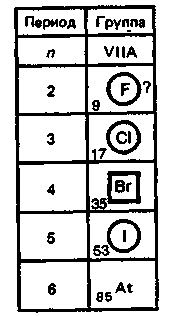 лементы фтор F, хлор Сl, бром Вr, иод I, астат Аt, входящие в VIIА-группу, называются галогенами (общее обозначение Г). В переводе с греч. галогены означают «солепорождающие». В эту группу часто включают также водород Н, однако свойства его существенно отличаются от свойств галогенов, и поэтому химические свойства водорода целесообразно рассматривать отдельно. лементы фтор F, хлор Сl, бром Вr, иод I, астат Аt, входящие в VIIА-группу, называются галогенами (общее обозначение Г). В переводе с греч. галогены означают «солепорождающие». В эту группу часто включают также водород Н, однако свойства его существенно отличаются от свойств галогенов, и поэтому химические свойства водорода целесообразно рассматривать отдельно.Н 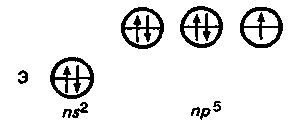 а валентных орбиталях атомов галогенов находится по семь электронов — два на s- и пять на p-орбиталях. Электронная формула валентной оболочки пs2пр5, где п — номер периода. а валентных орбиталях атомов галогенов находится по семь электронов — два на s- и пять на p-орбиталях. Электронная формула валентной оболочки пs2пр5, где п — номер периода.До завершения оболочки благородных газов недостает одного электрона. Поэтому галогены обладают большим сродством к электрону и являются сильными окислителями. Атомы галогенов, присоединяя электрон, образуют однозарядные галогенид-ионы с электронной структурой соответствующего благородного газа (пs2пр6). Т 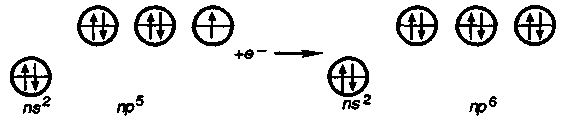 акая склонность к присоединению электронов характеризует галогены как типичные неметаллы. Галогенид-ионы, особенно Сl-, устойчивы в биосредах. акая склонность к присоединению электронов характеризует галогены как типичные неметаллы. Галогенид-ионы, особенно Сl-, устойчивы в биосредах.Одинаковое строение внешнего электронного слоя атомов галогенов обусловливает большое сходство в химических свойствах простых и сложных веществ, образуемых галогенами. Однако сопоставление свойств однотипных соединений галогенов показывает, что между ними имеются и существенные различия. Последние связаны с изменением атомных радиусов и различным строением внутренних электронных оболочек. Так, например, у хлора валентным электронам предшествует 8-электронная оболочка, а у брома и иода — более рыхлая, склонная к деформации 18-электронная оболочка. Поэтому можно ожидать, что свойства соединений хлора будут отличаться от свойств соединений брома и иода, особенно в тех случаях, когда в образовании химических связей принимают участие предвнешние атомные орбитали. С повышением заряда ядра в группе от F к Аt: увеличиваются радиусы атомов. Это находит отражение в уменьшении в ряду F—Аt энергии ионизации и сродства к электрону, электроотрицательности, стандартного потенциала восстановления. У 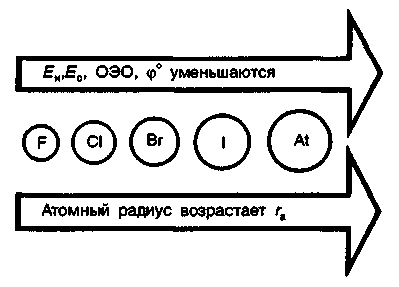 меньшение энергии ионизации помимо возрастания атомного радиуса объясняется усиливающимся (по мере заполнения электронных оболочек) экранированием заряда ядра электронами внутренних слоев. Также закономерно происходит в ряду Сl—Аt уменьшение энергии сродства к электрону. Это связано с ослаблением притяжения свободного электрона к ядру вследствие увеличения радиуса атома и экранирования. В результате, как и в других группах р-элементов, с увеличением числа заполняемых электронных оболочек неметаллические свойства ослабевают. меньшение энергии ионизации помимо возрастания атомного радиуса объясняется усиливающимся (по мере заполнения электронных оболочек) экранированием заряда ядра электронами внутренних слоев. Также закономерно происходит в ряду Сl—Аt уменьшение энергии сродства к электрону. Это связано с ослаблением притяжения свободного электрона к ядру вследствие увеличения радиуса атома и экранирования. В результате, как и в других группах р-элементов, с увеличением числа заполняемых электронных оболочек неметаллические свойства ослабевают.Меньшее сродство к электрону у фтора (328 кДж/моль), чем у хлора (349 кДж/моль), объясняется значительным межэлектронным отталкиванием. Увеличение отталкивания свободного электрона атомом фтора обусловлено меньшим размером атома. Так как в ряду F—Сl—Вr—I—Аt энергия сродства вцелом уменьшается, окислительная активность в этом ряду также снижается. Необходимо отметить, что хотя сродство к электрону у фтора меньше, чем у хлора, элементный фтор тем не менее является наиболее сильным окислителем среди галогенов. Это можно объяснить следующим образом Энергия, необходимая для восстановления газообразного фтора и хлора до отрицательно заряженных ионов слагается из энергии разрыва связи между атомами галогенов Г и сродства к электрону. Т  ак как химическая связь в молекуле хлора значительно прочнее, энергия разрыва связи в молекуле фтора существенно меньше, чем в молекуле хлора. Незначительный выигрыш в сродстве к электрону атома хлора не компенсирует большую затрату энергии на разрыв химической связи в молекуле хлора. В результате фтор оказывается более сильным окислителем. ак как химическая связь в молекуле хлора значительно прочнее, энергия разрыва связи в молекуле фтора существенно меньше, чем в молекуле хлора. Незначительный выигрыш в сродстве к электрону атома хлора не компенсирует большую затрату энергии на разрыв химической связи в молекуле хлора. В результате фтор оказывается более сильным окислителем.Д  ля галогенов характерно многообразие химических соединений. Элементные галогены (нулевая степень окисления) представляют собой двухатомные неполярные молекулы Г2. Появление нечетных положительных степеней окисления +1, +3, +5, +7 атомов Сl, Вr, I, Аt связано с переходом электронов на d-орбитали. Например, атом хлора имеет один неспаренный электрон в нормальном состоянии и 5 свободных d-орбиталей с низкой энергией. ля галогенов характерно многообразие химических соединений. Элементные галогены (нулевая степень окисления) представляют собой двухатомные неполярные молекулы Г2. Появление нечетных положительных степеней окисления +1, +3, +5, +7 атомов Сl, Вr, I, Аt связано с переходом электронов на d-орбитали. Например, атом хлора имеет один неспаренный электрон в нормальном состоянии и 5 свободных d-орбиталей с низкой энергией.Такой атом может быть переведен в зависимости от поглощаемой энергии в возбужденное состояние с тремя, пятью или семью неспаренными электронами. Исключение составляет фтор. Отсутствие низколежащих d-подуровней у его атома приводит к тому, что процесс возбуждения оказывается невыгодным. Переход электрона на высоколежащий 3d-подуровень требует очень большой затраты энергии. Поэтому для фтора характерна постоянная валентность, равная единице. Все галогены проявляют степень окисления —1 в водородгалогенидах НГ (например, НF, НСl) и в солях-галогенидах ЭГ (NаF, NаСl и др.). Водородгалогениды (НГ) — газы, хорошо растворимые в воде. Водные растворы НГ ведут себя как кислоты. Сила кислот НГ растет с уменьшением электроотрицательности галогенов сверху вниз по группе. Такой характер изменения силы кислот НГ объясняется уменьшением прочности связи Н—Г в ряду НF—НСl—НВr—НI и уменьшением энергии гидратации ионов Г-. Кислородные соединения галогенов (оксиды, кислоты) термически нестабильны. Устойчивость кислородных соединений галогенов в ряду F—Аt в целом возрастает. Галогены и галогениды. Элементные галогены — вещества общей формулы Г2, т.е. состоят из двухатомных молекул: F2, Cl2, Вr2, I2, Аt2. Связь Г—Г образуется за счет одной σ-связывающей молекулярной орбитали, полученной при перекрывании атомных nр-орбиталей. Остальным связывающим молекулярным орбиталям (π-орбиталям) соответствуют разрыхляющие, заполненные электронами: Образование двухатомных молекул галогенов из нейтральных атомов сопровождается выделением значительной энергии. В ряду Сl2 — Вr2 —I2 — Аt2 с увеличением межъядерного расстояния прочность связи между атомами уменьшается. Соответственно уменьшаются в этом ряду энтальпии диссоциации молекул Г2. Причиной уменьшения прочности связи в ряду является снижение степени перекрывания связывающих nр-орбиталей. Меньшую прочность связи Г—Г в молекулах фтора по сравнению с другими галогенами можно объяснить тем, что в образовании связи Г—Г не принимают участия d-орбитали. Элементные галогены Г2, как неполярные соединения, плохорастворимы в воде. При 20°С растворимость Сl2 — 0,091 моль/л, Вr2 — 0,22 моль/л, I2 — 0,001 моль/л. Однако равновесие Г2 (г) ⇄ Г2 (р) сдвигается вправо вследствие реакций галогенов с водой (принцип Ле Шателье). Фтор энергично реагирует с водой: 2F2 + 2Н2О = 4НF + О2. При взаимодействии других галогенов с водой помимо соответствующего водородгалогенида образуется кислородсодержащая кислота. Например, хлор реагирует следующим образом: Сl2 + Н2О ⇄ Н+ + Сl- + НСlO Здесь происходит окисление — восстановление хлора (диспропорционирование). Эта реакция протекает при хлорировании воды. Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях: этаноле, бензоле, диэтиловом эфире. Это их свойство используют для извлечения брома и иода из водных растворов. В медицинской практике в качестве обеззараживающего средства используются водно-спиртовые (w(I2) = 5%) и спиртовые (w(I2) = 10%) растворы иода. Для элементных галогенов характерны окислительно-восстановительные реакции. Эти реакции сопровождаются разрывом связи Г—Г с присоединением электронов к атомам галогена и образованием галогенид-ионов. Элементные галогены являются сильными окислителями и вступают во взаимодействие почти со всеми простыми веществами — металлами и неметаллами, образуя галогениды. С кислородом и азотом галогены непосредственно не взаимодействуют. Наиболее быстро с выделением большого количества теплоты протекает реакция галогенов с металлами. Так, например, металлический натрий, помещенный в атмосферу хлора, сгорает с образованием натрия хлорида: 2Nа (т) + Сl2 (г) = 2NаСl (т) Хлор непосредственно взаимодействует со многими неметаллами (фосфором, мышьяком, сурьмой и кремнием) даже при низкой температуре. Так, белый фосфор загорается в атмосфере хлора при комнатной температуре: 2Р + 5Сl2 = 2РСl5 Аналогичным образом бром и иод вступают в реакции с металлами и неметаллами. Однако химическая активность брома и иода ниже, чем хлора Особенно высокую химическую активность проявляет фтор. Так, щелочные металлы, железо, свинец, а также неметаллы S, Р уже при комнатной температуре загораются в атмосфере фтора. При нагревании со фтором реагируют даже благородные газы ксенон и криптон: Хе + 2F2 = ХеF4 Являясь наиболее электроотрицательным элементом, фтор образует соединения с элементами IIА-группы, устойчивость которых уменьшается в ряду ВеF2 — МgF2— СаF2— SrF2—ВаF2. Во многих биохимических процессах фтор выступает ингибитором, блокируя активные центры ферментов, содержащих Мg2+, Са2+ и ионы других металлов. Сопоставление свойств элементных галогенов показывает, что их химическая активность убывает в ряду F2 — Сl2 — Вr2 — I2—Аt2. Например, фтор реагирует с водородом со взрывом даже в темноте. Хлор без освещения не реагирует с водородом, но при нагревании или при ярком свете реакция протекает со взрывом (по цепному механизму). Бром с водородом взаимодействует только при нагревании, а иод — только при сильном нагревании, да и то не полностью, так как начинает идти обратная реакция разложения водородиодида. Различная окислительная способность галогенов проявляется и в их действии на биоорганические вещества и ткани живых организмов. Так, газообразный Сl2, являющийся сильным окислителем, представляет собой отравляющее вещество, вызывающее раздражение слизистых оболочек глаза, носа, гортани, тяжелое поражение легких. В отличие от хлора, иод — мягкий окислитель, обладающий антисептическим действием. Но при больших концентрациях иода и длительном применении возможны явления иодизма (насморк, крапивница, сыпь на коже и т.д.).  Водородгалогениды. Среди соединений галогенов, в которых они проявляют степень окисления —1, одними из наиболее важных в практическом и теоретическом отношении являются водородгалогениды. Химическая связь в газообразных НГ — полярная ковалентная. Электронная пара, осуществляющая связь, сильно смещена к более электроотрицательному элементу — галогену. Водородгалогениды. Среди соединений галогенов, в которых они проявляют степень окисления —1, одними из наиболее важных в практическом и теоретическом отношении являются водородгалогениды. Химическая связь в газообразных НГ — полярная ковалентная. Электронная пара, осуществляющая связь, сильно смещена к более электроотрицательному элементу — галогену. С точки зрения метода ВС химическая связь в НГ имеет одинаковый характер. 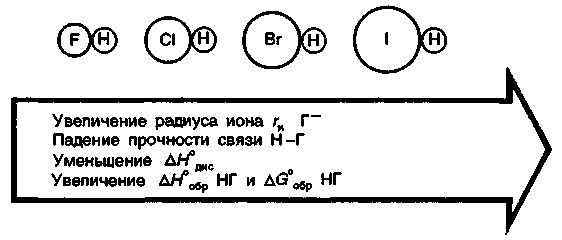 Так как электронная структура всех водородгалогенидов одинакова, с ростом ионного радиуса галогена свойства НГ в ряду F — I монотонно изменяются (исключение составляет НF). Снижение прочности химической связи в молекулах НГ в ряду НF — НСl — НВr — НI находит отражение в уменьшении энтальпий диссоциации молекул НГ на атомы и в увеличении энтальпии и энергии Гиббса образования молекул НГ. Так как электронная структура всех водородгалогенидов одинакова, с ростом ионного радиуса галогена свойства НГ в ряду F — I монотонно изменяются (исключение составляет НF). Снижение прочности химической связи в молекулах НГ в ряду НF — НСl — НВr — НI находит отражение в уменьшении энтальпий диссоциации молекул НГ на атомы и в увеличении энтальпии и энергии Гиббса образования молекул НГ.К Дипольный момент, характеризующий полярность связи в ряду НF—НСl—НВr—НI, уменьшается от 6,4 до 1,3. Исходя из максимальной полярности НF, можно предположить: 1) растворимость водородгало-генидов в воде в этом ряду должна уменьшаться; 2) сила образующихся галогеноводородных кислот: НF (фтороводородная — плавиковая), НСl (хлороводородная — соляная), НВr (бромоводородная), НI (иодоводородная) также должна падать. Однако из экспериментальных данных следует, что степень ионизации, соответственно и сила кислот Н—Г в ряду от F к I, наоборот, возрастают. Растворимость от НF к НСl падает, но от НСl к НI растет. Причиной наблюдаемого изменения растворимости и силы водородгалогенных кислот является увеличение радиуса Г--ионов от F- к I- и уменьшение их гидратации. П 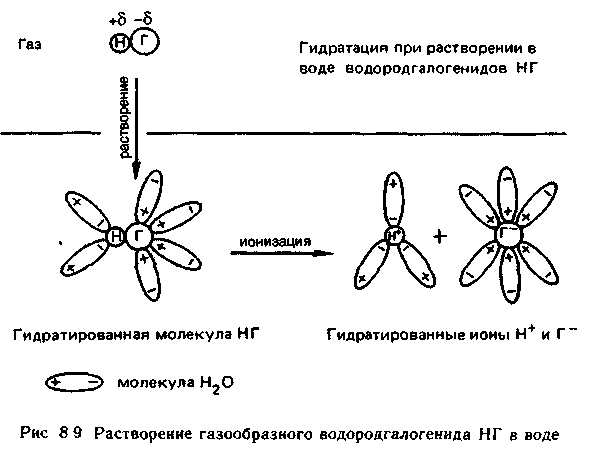 ри растворении газообразного НГ в воде происходит гидратация При этом наблюдается разрыв полярной связи Н—Г и образование гидратированных ионов. Гидратированные протоны Н+ и анионы I- оказываются изолированными друг от друга Их взаимодействие становится чисто электростатическим. Но так как ионные радиусы в ряду F- — Сl- — Вr- — I- увеличиваются, то кулоновское взаимодействие между ионом гидроксония Н3О+ и галогенид-ионами в этом ряду уменьшается, что и приводит к увеличению степени ионизации галогеноводородных кислот в ряду НF—НСl—НВr—НI. Исходя из тех же соображений, можно объяснить и изменение растворимости НГ в этом ряду. ри растворении газообразного НГ в воде происходит гидратация При этом наблюдается разрыв полярной связи Н—Г и образование гидратированных ионов. Гидратированные протоны Н+ и анионы I- оказываются изолированными друг от друга Их взаимодействие становится чисто электростатическим. Но так как ионные радиусы в ряду F- — Сl- — Вr- — I- увеличиваются, то кулоновское взаимодействие между ионом гидроксония Н3О+ и галогенид-ионами в этом ряду уменьшается, что и приводит к увеличению степени ионизации галогеноводородных кислот в ряду НF—НСl—НВr—НI. Исходя из тех же соображений, можно объяснить и изменение растворимости НГ в этом ряду.Рассмотренный пример показывает, что правильный теоретический прогноз физико-химических свойств растворенных веществ возможен лишь при учете не только характеристик молекул этих веществ, но и их взаимодействия с растворителем. По мере увеличения межъядерного расстояния в ряду НF—НСl—НВr—НI увеличивается восстановительная активность водородгалогенидов и галогеноводородных кислот. Так, O2 восстанавливается иодоводородной кислотой уже при обычной температуре: О2 + 4Н+ + 4I- = 2Н2О + 2I2. Бромоводородная кислота взаимодействует с дикислородом медленнее, а соляная кислота вообще не окисляется дикислородом. Индифферентность аниона Сl- в кислой среде весьма существенна с точки зрения физиологии и медицины. Используя индифферентность хлорид-иона, его вводят в состав многих лечебных препаратов. Вводные растворы натрия хлорида — изотонический (мас. доля 0,9%) и гипертонические (мас. доля 3—5—10%) широко применяют в медицинской практике. Использование гипертонических растворов основано на законах осмоса. Хлорид-ион присутствует в организме в макроколичествах. В форме соляной кислоты является необходимым компонентом желудочного сока. Соляная кислота играет важную роль в процессе пищеварения. Желудочный сок (рН от 1 до 3) содержит катион Н+ и анионы Сl-, Н2РО4-, НSО4-. Однако концентрация хлорид-ионов Сl- значительно превышает концентрацию других анионов. Поэтому говорят, что соляная кислота содержится в желудочном соке и ее массовая доля составляет около 0,3%. 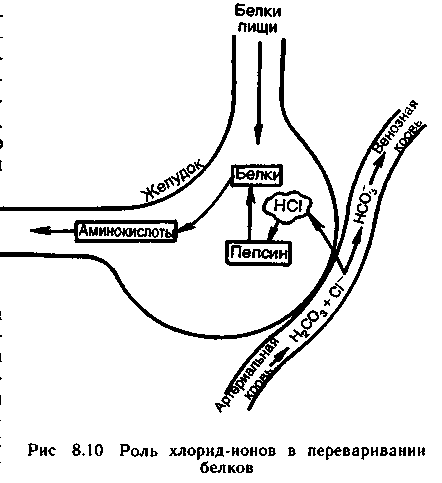 Для выработки соляной кислоты в желудке необходим NаСl — поваренная соль. Вы деление соляной кис лоты из клеток слизистой оболочки (рис 8.10) желудка можно описать следующим уравнением: Н2СО3(кровь) + Сl- = НСO3-(кровь) + НСl(желудок) Соляная кислота желудочного сока не обходима для перехода фермента пепсина в активную форму. Пепсин обеспечивает переваривание белков путем гидролитического расщепления пептидных связей (отсюда название фермента). Кислородные кислоты хлора и их соли. Среди кислородных соединений галогенов наибольшее значение для практического применения имеют кислородные кислоты хлора и их соли. Кислородные кислоты хлора значительно менее устойчивы, чем их соли. Кислота состава НСlО, где атомы хлора проявляют степень окисления +1. в свободном состоянии не выделена. Она называется гипохлористой (хлорноватистой), а соли ее — гипохлоритами. Гипохлористая кислота получается при взаимодействии хлора с водой: Сl2 + Н2О ⇄ Сl- + НСlO + Н+. При этом один из атомов молекулы хлора присоединяет электрон от другого атома и восстанавливается, а другой атом хлора, отдавая электрон, окисляется: 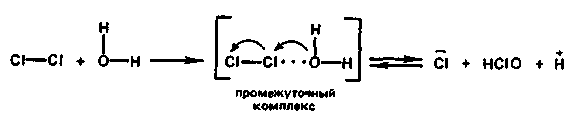 Реакция гидролиза хлора является обратимой и сильно смещена влево. Кислота НСlО настолько слабая, что даже угольной кислотой вытесняется из растворов гипохлоритов: NаСlO + Н2О + СО2 = NаНСО3 + НСlO Степень гидролиза хлора зависит от разбавления. Изменение общей концентрации хлора от 100 до 20 ммоль/л приводит к увеличению степени гидролиза от 0,33 до 0,73. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество НСlO. Гипохлористая кислота нестойка и даже в водном растворе распадается под действием света. Механизм распада можно представить в виде двух стадий: НСlO + hν = НСl + [О] 2О → О2, где [О] — монокислород, активная форма кислорода. Гипохлористая кислота является очень сильным окислителем, именно ее образованием объясняется бактерицидное и отбеливающее действие хлорной воды. Выделяющийся при распаде НСlO монокислород обесцвечивает красители и убивает микроорганизмы. Гипохлористая кислота способна реагировать с органическими соединениями RН (R — органический радикал) по следующим схемам: RН + НСlО= RОН + НСl RН + НСlO = RСl + Н2O т.е. и как окислитель, и как хлорирующее вещество. Например, НСlO разрушает (денатурирует) белки, из которых состоят микроорганизмы. При этом хлор замещает атомы водорода пептидных связей белка: R—СО—NН—R1 + НСlO → R—СО—NСl—R1 + Н2О В результате нарушается вторичная структура белков, что приводит к гибели микроорганизмов. Поэтому с целью обеззараживания воды можно применять ее хлорирование. Отсюда следует, что бактерицидное действие водных растворов хлора связано как с образованием монокислорода, так и с хлорирующим действием гипохлористой кислоты. Образующееся в хлорированной воде небольшое количество соляной кислоты безвредно, и такая вода пригодна для употребления. Гипохлористая кислота более сильный окислитель, чем газообразный Сl2. Это можно доказать экспериментально: сухой хлор менее эффективно отбеливает ткани, чем «сырой», содержащий НСlO. Бром и иод, проявляя степень окисления +1, образуют также кислородные кислоты НВrО (гипобромистая) и НIO (гипоиодистая). Сила кислородсодержащих кислот в ряду Сl—Вr—I уменьшается вследствие роста ковалентного радиуса атомов галогенов в этом ряду, что сопровождается ослаблением ковалентной связи О—Г. О 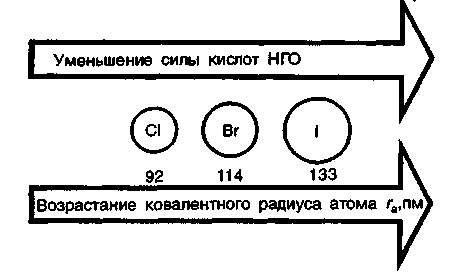 кислительные свойства НГО в ряду от Сl к I так же уменьшаются, а относительная устойчивость возрастает. Так, при нагревании НГО или действии на них света кислительные свойства НГО в ряду от Сl к I так же уменьшаются, а относительная устойчивость возрастает. Так, при нагревании НГО или действии на них света2НГО(р) = 2НГ(р) + О2(г). Химизм антисептического и дезинфицирующего действия иода во многом аналогичен действию хлора. Так, иод, подобно хлору, замещает водородные атомы у атомов азота в молекулах белков микроорганизмов, что приводит к их гибели: R—СО—NН—R1 + НIO → R—СО—NI—R1 + Н2О В медицинской практике, в быту и промышленности находят применение соли гипохлористой кислоты, а также препараты хлора и иода, отщепляющие активные формы галогенов. Если к хлорной воде добавить щелочь, то равновесие гидролиза хлора сместится вправо (принцип Ле Шателье) вследствие нейтрализации гипохлористой и соляной кислот: НСl + НСlO + 2КОН = КСl + КСlO + 2Н2О или в ионном виде: НСlO + ОН- = ОСl- + Н2О Полученный таким способом раствор калия хлорида и гипохлорита называется жавелевой водой. Она применяется для отбеливания тканей. Ее отбеливающие свойства обусловлены тем, что калий гипохлорит взаимодействует с оксидом углерода(IV) воздуха в присутствии воды: КСlO + Н2О + СО2 = НСlO + КНСО3 или в ионном виде: СlО- + Н2О + СО2 = НСlO + НСО3- т.е. образуется гипохлористая кислота, которая разрушает красящие вещества. Действуя хлором на гидроксид кальция (II), получают смесь, называемую белильной или хлорной известью: 2Са(ОН)2 + 2Сl2 = Cа(СlО)2 + 2Н2О + СаСl2 Хлорная известь — белый порошок с резким запахом, является сильным окислителем и применяется как дезинфицирующее, отбеливающее и дегазирующее средство. Во влажном воздухе СаОСl2 взаимодействует с оксидом углерода (IV), постепенно выделяя гипохлористую кислоту, которая, как рассматривалось ранее, разлагается с образованием монокислорода. НСlО выделяется также в результате гидролиза: Са(ОСl)Сl + Н2О ⇄ СаОН+ + НСlO + Сl- При действии на хлорную известь соляной кислотой происходит выделение свободного хлора: Са(ОСl)Сl + 2НСl = СаСl2 + Сl2 + Н2О Кислородсодержащая кислота НСlО2, в которой хлор проявляет степень окисления +3, называется хлористой, аее соли — хлориты. Обычно эту кислоту получают действием серной кислоты на хлорит бария: Ва(СlO2)2 + Н2SО4 = 2НСlО2 + ВаSО4 При нагревании гипохлористой кислоты легко протекает ее разложение с образованием хлорноватой кислоты НСlO3: 3НОСl = 2НСl + НСlО3 В молекуле хлорноватой кислоты атом хлора проявляет степень окисления +5.Соли хлорноватой кислоты называются хлоратами. Если не на холоду, а через горячий раствор щелочи, например КОН, пропускать хлор, то вместо КСlО образуется КСlO3: 3Сl2 + 6КОН = 5КСl + КСlO3 + 3Н2О Продуктами реакции являются калий хлорид и калий хлорат — КСlO3 (бертолетова соль). Хлорноватая кислота в свободном состоянии не выделена, но в отличие от НСlО и НСlО2 известны ее концентрированные растворы (до 40%). Хлорноватая кислота является сильной кислотой). По окислительной активности НСlO3 уступает НСlО2. В больших количествах хлораты токсичны. Перхлорная (хлорная) кислота НСlО4 (атом хлора имеет степень окисления +7) — бесцветная жидкость, способная взрываться, но ее водные растворы вполне устойчивы. Перхлорная кислота — самая сильная из всех известных кислот. Окислительная активность НСlО4 меньше, чем у НСlO3, а кислотные свойства выражены сильнее. Соли хлорной кислоты — перхлораты в сухом состоянии являются мощными окислителями и используются для минерализации различных биоматериалов при определении содержащихся в них неорганических компонентов. Сравнивая свойства кислородных кислот хлора, можно сделать следующие выводы: 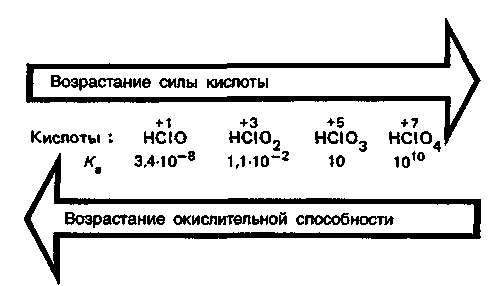 по мере увеличения степени окисления хлора в ряду НСlО—НСlО2—НСlO3—НСlО4 сила кислот увеличивается. по мере увеличения степени окисления хлора в ряду НСlО—НСlО2—НСlO3—НСlО4 сила кислот увеличивается.Такой характер изменения кислотных свойств объясняется тем, что по мере увеличения числа атомов кислорода в ряду НО—Сl, НО—СlO, НО—СlO2, НО—СlО3 прочность связи О—Н ослабевает. Резкое возрастание силы кислот с увеличением числа атомов кислорода (увеличение числа связей Сl—О) можно объяснить оттягиванием электронной плотности от связи Н—О на связь Сl—О. Сравнение окислительных свойств кислородных кислот хлора показывает, что в ряду анионов СlО- — СlО2- — СlО3- — СlO4- уменьшается окислительная способность. Такой характер изменения окислительной активности можно объяснить повышением устойчивости в указанном ряду анионов, обусловленной увеличением числа электронов, принимающих участие в образовании σ- и π-связей. Комплексные соединения галогенов. Галогены входят в состав комплексных соединений как в качестве лигандов, так и комплексообразователей. Более склонны элементы VIIА-группы к комплексообразованию в качестве лигандов с ионами металлов. Обычно устойчивость галогенидных комплексов уменьшается в ряду F>Сl>Вr>I, но для некоторых ионов металлов наблюдается обратный порядок. Образование комплексных галогенидов имеет место и в живых организмах. Так, токсическое действие избытка фторид-ионов на организм связано с образованием фторидных комплексов с катионами металлов, входящих в активные центры ферментов Е: Е—Мn++ F- → [Е—М—F]n-1 В результате блокирования свободной орбитали металла подавляется активность ферментов. Важными комплексными соединениями галогенов, применяемых в медицине, являются противоопухолевые препараты (химиотерапия). Активными считаются цис-диаминдихлороплатина (II) [Рt(NН3)2Сl2] и цис-диаминтетрахлороплатина (IV) [Рt(NН3)2Сl4]. Известны комплексы, где комплексообразователем является галогенид-ион, а лигандами — молекулы галогенов. Такие комплексы состава [Г∙(Г2)x]- называются полигалогенидами. Так, увеличение растворимости молекулярного иода в воде в присутствии калия иодида связано с образованием комплексного иона: I- + I2 ⇄ [I(I2)]- Диссоциация комплекса (реакция обратимая) обеспечивает присутствие в растворе полииодида элементного иода, обладающего бактерицидными свойствами. Поэтому в медицинской практике используют раствор иода с добавлением КI. |
