юный химик. Рабочая программа учебного курса внеурочной деятельности Юный химик
 Скачать 148.87 Kb. Скачать 148.87 Kb.
|
Тема 11. Гормоны и их роль в обмене веществКлассификация гормонов. Стероидные гормоны: кортикостерон, тестостерон, эстрадиол, экдизон. Механизм действия стероидных гормонов. Пептидные гормоны. Характеристика инсулина, гормона роста, тиреотропина, гастрина, вазопрессина. Механизм действия пептидных гормонов (на примере глюкагена и инсулина). Сахарный диабет и его виды. Прочие гормоны (адреналин, ауксин, гиббереллины, цитокинины, простагландины), их структура и механизм действия. Рилизинг- факторы гормонов. Нейрогормоны (эндорфины и энкефалины). Применение гормонов в медицине и сельском хозяйстве. Лабораторные работыКачественные реакции на инсулин Реакция адреналина с хлорным железом Реакция адреналина с йодом Тема 12. Взаимосвязь и регуляция обмена веществ. Проблемы биохимической экологииОбщие представления о взаимосвязи обмена веществ в клетке. Понятие о ключевых метаболитах (пировиноградная кислота, кофермент-А и др.). Взаимосвязь белкового и нуклеинового обмена, значение регуляторных белков. Взаимосвязь углеводного и белкового обмена. Роль пировиноградной кислоты и цикла Кребса в этой взаимосвязи. Взаимосвязь обмена углеводов и липидов; роль ацетилкоэнзима- А в этом процессе. Уровни регуляции обмена веществ: клеточный, организменный и популяционный. Транскрипционный (оперонный) уровень регуляции. Основные механизмы регуляции обмена веществ в клетке. Организменный уровень регуляции. Гормональная регуляция обмена веществ. Каскадный механизм регуляции с участием гормонов и вторичных посредников. Популяционный уровень регуляции. Антибиотики микробов, фитонциды растений, телергоны животных и их влияние на процессы жизнедеятельности. Эколого-биохимические взаимодействия с участием различных групп организмов: микроорганизмов, грибов, высших растений, животных. Токсины растений. Пищевые детерренты и антифиданты. Пищевые аттрактанты и стимуляторы. Хеморегуляторы, воздействующие на позвоночных животных. Накопление и использование животными вторичных метаболитов растений. Антропогенные биоактивные вещества и проблемы химического загрязнения биосферы. Экологически безопасные способы воздействия на различные виды животных, растений и микроорганизмов. Тема 13. Проектная работаПредлагается для проектной работы следующие темы (примерные): Качественные реакции на аминокислоты и белки. Приготовление раствора белка (яичного альбумина). Разделение белков куриного яйца по их растворимости. Денатурация белков (обратимая и необратимая). Сравнительный анализ продуктов кислотного и ферментативного гидролиза ди- и полисахаридов (на примере сахарозы и крахмала). Специфичность действия ферментов (амилаза). Влияние на активность ферментов температуры, рН, активаторов и ингиби- торов. Выделение рибонуклеопротеинов из дрожжей. Качественное определение продуктов гидролиза рибонуклеопротеинов. Выделение гликогена из печени животных. Сопоставление структуры гликогена и крахмала. Разделение углеводов методом тонкослойной хроматографии. Гидролиз жиров под действием липазы. Влияние желчи на активность липазы. Качественные реакции на гормоны. Биогенная классификация химических элементов. Биологически активные вещества. Витамины Биологически активные добавки: профанация или польза? Биологическая роль витаминов. Витамин С и его значение. Искусственные жиры — угроза здоровью. Использование дрожжей в пищевой промышленности. Исследование физико-химических свойств молока разных производителей, имеющих экологический сертификат. Иод в продуктах питания и влияние его на организм человека. Лабораторные работыЛабораторная работа № 1 «Определение среды растворов аминокислот» Теоретическая часть. Кислотно-основные свойства а –аминокислот  По протолитической теории кислот и оснований, а-аминокислоты относятся к амфолитам, так как содержат в составе молекулы кислотный и основной центры. В водном растворе молекула а-аминокислоты существует в виде биполярного иона. По протолитической теории кислот и оснований, а-аминокислоты относятся к амфолитам, так как содержат в составе молекулы кислотный и основной центры. В водном растворе молекула а-аминокислоты существует в виде биполярного иона.В зависимости от рН среды может преобладать тот или иной заряд. В сильнокислых средах (рН 1—2) формируется катионная форма а- аминокислоты. В сильнощелочной среде (рН 13—14) преобладает анионная форма а-аминокислоты. 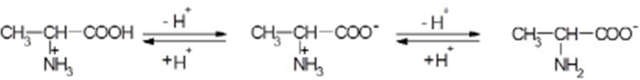 Существуют значения рН спецефические для каждой аминокислоты, в которой количество анионных форм в растворе равно количеству катионных форм. При этом необходимо учитывать наличие ионогенных группировок боковой цепи. Значение рН при котором общий заряд молекулы а-аминокислоты равен 0, называется изоэлектрической точкой а-аминокислоты (рIАК). Если рН раствора соответствует изоэлектрической точке а-аминокислоты, то при электрофорезе не происходит движения молекулы в растворе. Если р Н раствора < р I, то катионная форма а-аминокислоты движется к катоду. Если рН раствора > р I, то анионная форма а-аминокислоты движется к аноду. На этом основано разделение АК методом электрофореза. Для большинства белков животного происхождения изоэлектрические точки лежат в пределах от 5,5 до 7,0 (исключение: пепсин — р I = 1, сальмин — р I = 12), т. е. белки обладают более выраженными кислотными свойствами. При физиологических значения рН 7,34—7,36 in vivo ни одна а-аминокислота и ни один белок не находится в изоэлектрическом состоянии, а преобладает анионная форма, отрицательный заряд которой уравновешивается катионами натрия и калия (Na+ и К+). |
