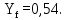Расчёт ректификационной установки
 Скачать 3.46 Mb. Скачать 3.46 Mb.
|
2 Материальный баланс установкиВведем обозначения: GР, XР–поток и концентрация НК дистиллята; Gw, Xw – поток и концентрация НК кубового остатка; Gf, Xf– поток и концентрация НК флегмы; Gv – количество пара, выходящего из колонны. Материальный баланс по всему потоку, кг/с:
Материальный баланс по низкокипящему компоненту, кг/с:
Массовая концентрация НКК в исходной смеси:
где μА и μБ – молекулярная масса компонентов (µH2O=18 кг/кмоль, µСH3COOH=60 кг/кмоль). 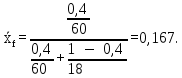 Массовая концентрация НКК в кубовом остатке:
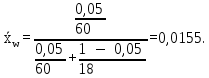 Массовая концентрация НКК в дистилляте:
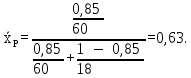 Составим систему уравнений: 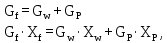 Решая получившуюся систему уравнений получим: 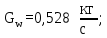 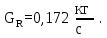 3 Конструкторский и тепловой расчёт колонны3.1 Определение числа тарелок3.1.1 Построение диаграммы фазового равновесия y=f(x)На диаграмму наносятся температуры кипения чистых компонентов. Сведем в таблицу 3.1 физико ‒ химические свойства воды и уксусной кислоты при 110 °С. Таблица 3.1 ‒ Физико ‒ химические свойства воды и бутилового спирта
Парциальное давление пара каждого компонента идеальных смесей зависит от температуры и содержания данного компонента и пропорционально молярной доле данного компонента в смеси. Это соотношение называется законом Рауля и может быть математически выражено следующим образом:
где  – молярная доля компонента А в жидкости; – молярная доля компонента А в жидкости; 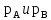 – парциальные давления паров компонента А и компонента В над смесью, МПа; – парциальные давления паров компонента А и компонента В над смесью, МПа; 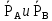 ‒ давления насыщения паров компонентов А и В при данной температуре. Тогда молярная доля компонента В в жидкой смеси будет ‒ давления насыщения паров компонентов А и В при данной температуре. Тогда молярная доля компонента В в жидкой смеси будет  . .Полное (общее) давление пара над жидкостью Робщ равно сумме парциальных давлений компонентов:
В то же время парциальные давления компонентов в системе следуют закону Дальтона:
где yв– концентрация ВКК в паровой фазе; Робщ – атмосферное давление, равное 0,1 МПА Для установившегося равновесия:
Откуда
Окончательные уравнения:
Величину давления насыщения компонентов А и В в зависимости от температуры находят по уравнению Антуана:
где А, В, С – некоторые числа для данных веществ; t – температура насыщения компонента смеси, оC. Выражаем давления насыщения паров компонентов А и В:
Задаваясь значением температур в промежутке от tА до tВ, из уравнения Антуана определяют давления насыщения высококипящего компонента при данных температурах. Данные сведем в таблицу 3.2. Таблица 3.2 ‒ Давление паров воды и уксусной кислоты в зависимости от температуры
Приведем пример расчета для температуры 104 оС: Давление насыщения паров компонента А при 100 оС: 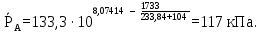 Давление насыщения паров компонента В при 100 оС: 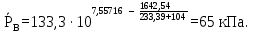 Концентрация НКК в жидкой фазе: 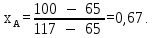 Концентрация ВКК в паровой фазе: 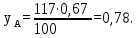 Остальные расчеты выполняем аналогично. Результаты сведены в таблицу 3.3. Таблица 3.3 ‒ Данные для построения диаграммы фазового равновесия у=f(x) и t=f(x,y)
Построение диаграммы фазового равновесия смеси вода – уксусная кислота представлено на рисунке 3.1 3.1.2 Построение диаграммы фазового равновесия t=f(x,y)Равновесные (сопряженные) концентрации компонента А в жидкой и газообразных фазах находятся на изотерме, пересекающей соответствующие линии кипения и конденсации, поэтому берутся эти значения (xi и yi) из таблицы 3.3 и наносятся на диаграмму в координатах t=f(x,y) (рисунок 3.2). 3.1.3 Построение диаграммы фазового равновесия h=f(x,y)Построение кривых рабочих линий сопряжено с большими трудностями: здесь необходимо учитывать энтальпии пара и энтальпии жидкости с изменением этих свойств. Изобарная мольная теплоемкость смеси: 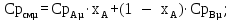 (3.11) (3.11)где 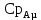 и и  – изобарные мольные теплоемкости низкокипящего и высококипящего компонентов в жидких фазах, кДж/кг. – изобарные мольные теплоемкости низкокипящего и высококипящего компонентов в жидких фазах, кДж/кг.Скрытая теплота парообразования смеси: 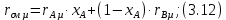 где 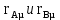 – мольная скрытая теплота парообразования, кДж/кг. – мольная скрытая теплота парообразования, кДж/кг. Энтальпия кипящей жидкости:  Энтальпия сухого насыщенного пара: 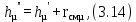 В диапазоне температур кипения чистых компонентов определяют энтальпию кипящей жидкости по формуле (3.13) и энтальпию насыщенного пара по формуле (3.14). Приведем расчет для температуры 104 оС: Изобарные мольные теплоемкости низкокипящего и высококипящего компонентов в жидких фазах:   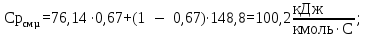   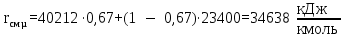 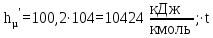  Расчеты для остальных температур выполняем аналогично и сводим в таблицу 3.4. Таблица 3.4 ‒ Данные для построения диаграммы фазового равновесия h=f(x,y)
Диаграммы фазового равновесия h=f(x,y) представлена на рисунке 3.3. 3.1.4 Графический метод определения теоретического числа тарелок методом Мак ‒ Кэба ‒ ТилеСтроим диаграмму фазового равновесия y=f(x). Построение точки а. XР = 0,85 пересекаем с главной диагональю. Построение точки с. Xw = 0,05 пересекаем с главной диагональю. Построение точки d. На оси ординат от «0» откладываем значение отрезка В, который рассчитывается по формуле:
 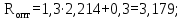 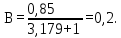 Через точку а и точку d проводим рабочую линию укрепляющей части колонны. Получаем отрезок аd. На эту рабочую линию выносим значение концентрации НКК Xf=0,4 в исходной смеси. Получаем точку в. Эта точка характеризует концентрацию НКК на питательной тарелке. Так как питательная тарелка разделяет укрепляющую и исчерпывающую части колонны, то здесь заканчивается укрепляющая часть и с нее начинается исчерпывающая часть. Через точку с в точку в проводим рабочую линию исчерпывающей части колонны. Построив рабочие линии, можно приступить к изображению процессов фазовых переходов, проходящих в жидкой фазе на тарелках. Очерчиваем область, лежащую между рабочими линиями abc и кривой равновесия. Находим теоретическое число тарелок, строя ступени в рабочей области из точки а в точку с. Количество таких ступеней до точки в определяет число теоретических тарелок в укрепляющей части колонны. Аналогичные построения от точки в до точки с дают число теоретических тарелок в исчерпывающей части колонны. Теоретическое число тарелок в укрепляющей части = 6 шт. Теоретическое число тарелок в исчерпывающей части =8 шт. Суммарное число тарелок ‒ 14 шт. 3.1.5 Графический метод Поншона ‒ Меркеля в координатах h ‒ x,y.Определение теоретического числа тарелок по методу Поншона – Меркеля производится с помощью энтальпийной диаграммы h ‒ x,y. В энтальпийной диаграмме необходимо определить теоретическое число тарелок, не используя понятия рабочей линии, т.е иным путем устанавливая связь между сопряженными концентрациями компонента А (НКК) в жидкости и паре. С этой целью необходимо определить положение двух полюсов (Sв; Sн) верхней укрепляющей и нижней отгонной частей колонны, через которые можно проводить лучи, соединяющие точки сопряженных составов газовой и жидкой фаз в любом сечении аппарата. Верхний полюс колонны определим с помощью минимального теплоотвода в конденсаторе, который определим графически (1 способ), а также удельного теплового потока в конденсаторе, рассчитанного по формуле (2 способ). Построение энтальпийной диаграммы h ‒ x,y представлено в пункте 3.1.3. Отмечаем т.1 ‒ точку пересечения линии h’ и хw =0,05; Отмечаем т.2 ‒ точку пересечения линии h’ и хf =0,4; Отмечаем т.3 ‒ точку пересечения линии h’ и хР=0,85; Отмечаем т.4 на линии h’’(уа); по хf =0,4 на диаграмме y=f(x) находим уf =0,54. Проводим изотерму через точки 2 и 4. Получаем точки 5 и 6. Отрезок 5 ‒ 6 – вспомогательный луч. Определим qконд и qисп: 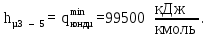 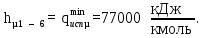  Определяем положение верхнего и нижнего полюса: Точка 7 = Sв (верхний полюс): 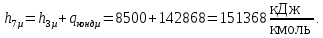 Точка 8 = Sн (нижний полюс): главный луч Sв ‒ т. 2 хw = 0,05; Точка 9. Главный луч Sв ‒ Sн h’’. Точка 10. Луч Sв ‒ 4 пересекает h’. По х10 определяем у11 (по диаграмме t,x,y). Далее аналогично пока x< хР=0,85 Главный луч SвSн пересекает h’’ в точке 9. По у9 определяем х20 (по диаграмме t,x,y). Точка 21. х20 пересекает h’. Далее аналогично пока x> хw=0,05 Таким образом число тарелок по методу Поншона ‒ Меркеля: в укрепляющей части колонны ‒ 6 тарелок, в исчерпывающей части колонны – 7 тарелок. Суммарное число тарелок ‒ 13 шт. 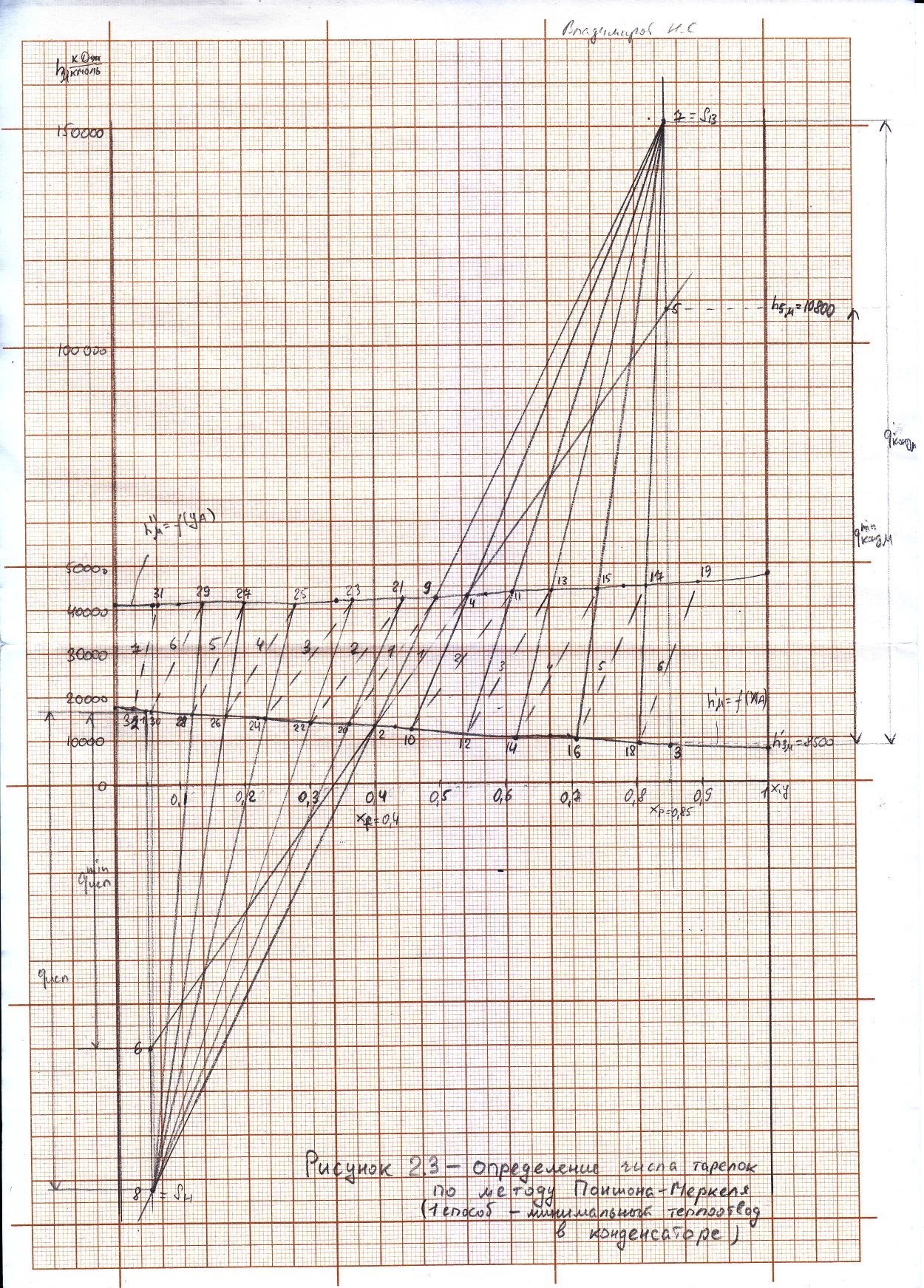 3.1.6. Метод с расчётом удельного теплового потока в конденсатореПостроение диаграммы и выполнение первых шагов построения аналогично предыдущему способу. Определяется удельный тепловой поток в конденсаторе по формуле:
где  ‒ скрытая теплота фазового перехода дистиллята. ‒ скрытая теплота фазового перехода дистиллята.
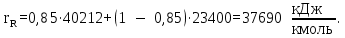 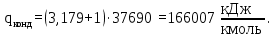 Процесс построения методом изотерм аналогичен предыдущему способу. Таким образом, число тарелок по методу Поншона ‒ Меркеля (2 способ): в укрепляющей части колонны – 6 тарелки, в исчерпывающей части колонны – 6 тарелок. В дальнейшем для расчетов принимаем число тарелок в укрепляющей части колонны ‒ 6 тарелок, в исчерпывающей части колонны – 8 тарелок. Суммарное число тарелок ‒ 14 шт. 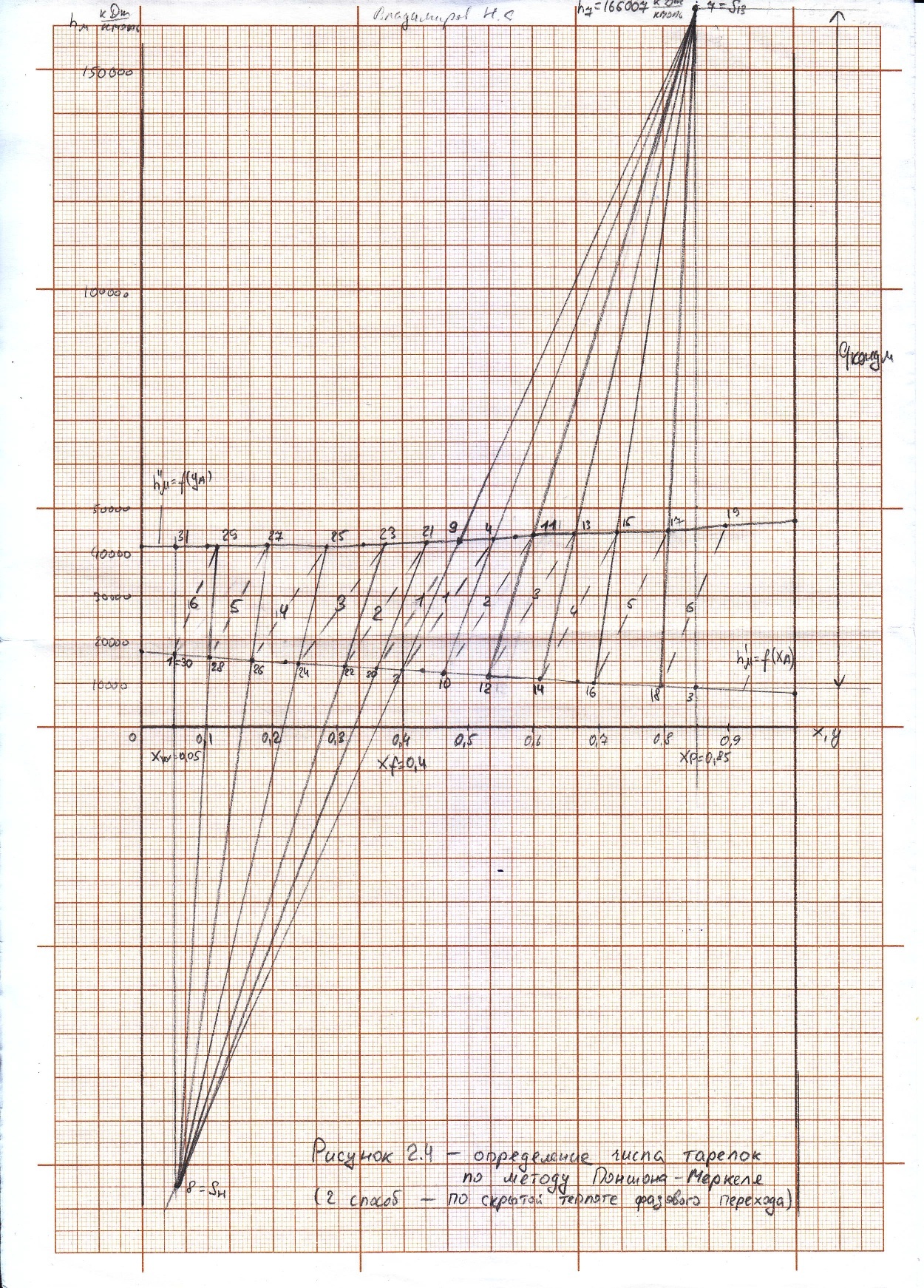 3.1.7. Определение действительного числа тарелокКоличество реальных (действительных) тарелок: 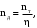 (3.20) (3.20)где  ‒ теоретическое число тарелок; ‒ теоретическое число тарелок; ‒ КПД контактного устройства, принимаем ‒ КПД контактного устройства, принимаем  = 0,8. = 0,8.Тогда действительное число тарелок в укрепляющей части колонны: 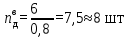 Действительное число тарелок в исчерпывающей части колонны:  Общее число тарелок в колонне – 18 штук.  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

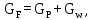

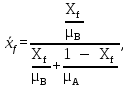
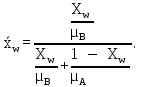
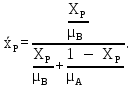
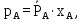
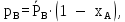
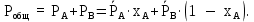

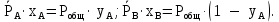
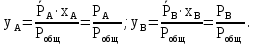
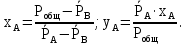
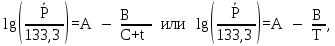
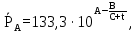
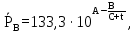

 , кДж/(кмоль·К)
, кДж/(кмоль·К) , кДж/кмоль
, кДж/кмоль , кДж/кмоль
, кДж/кмоль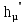 , кДж/кмоль
, кДж/кмоль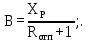
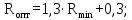

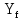 определяем подиаграмме фазового равновесия
определяем подиаграмме фазового равновесия