Расчетная работа Расчет изменения экстенсивных свойств в многокомпонентных системах
 Скачать 23.33 Kb. Скачать 23.33 Kb.
|
|
Расчетная работа «Расчет изменения экстенсивных свойств в многокомпонентных системах» Харитонов М.А Х-200001 5 вариант Условие задачи: Реакция A + 2B = C протекает в газовой фазе при температуре 298 К и давлении Р = 1,5 атм. Составьте уравнение закона химического равновесия, если начальные количества веществ равны стехиометрическим коэффициентам, продуктов реакции в начальный момент нет. Рассчитайте константу химического равновесия Кр ([p] = 1 атм) и равновесный состав смеси, если известно, что глубина химической реакции при этой температуре равна 0,65. Необходимо вычислить: значение константы равновесия реакции Кр ; 2) состав равновесной смеси в молях (nA,nB, nC); 3) состав равновесной смеси в мольных долях (NA, NB, NC). Дано: Газовая реакция A + 2B = C, Т = 298 К; Р = 1,5 атм.; ξ = 0,65. Решение:
Рассчитаем суммарное число молей реактантов в равновесной смеси согласно уравнению n 1 (2 – 2ξ) (0+) 3 - 2ξ Вычислим мольные доли компонентов в равновесной смеси по уравнению 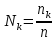 ; ;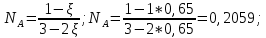 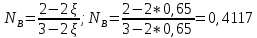 ; ; 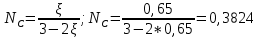 ; ;Рассчитаем парциальные давления реактантов к состоянию равновесия по уравнению Дальтона 𝑃𝑘 = 𝑃 ∙ 𝑁𝑘 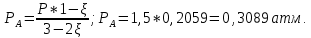 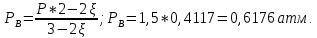 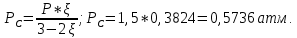 Запишем выражение для расчета константы равновесия реакции и рассчитаем ее значение, зная величину глубины химической реакции 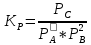 = = 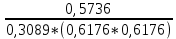 = 4,87 (ξ = 0,65 моль) = 4,87 (ξ = 0,65 моль)Рассчитаем состав равновесный состав: nА= 1-ξ = 1-0,65= 0,35 моль nB = 2-2ξ = 2– 2*0,65= 0,7 моль nC = 0,65 моль
|

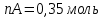
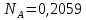 ;
;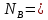
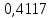 ;
;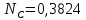 ;
;