химия теория. химия. Расчётнографическая работа по дисциплине Химия
 Скачать 52.38 Kb. Скачать 52.38 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РФ КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ Кафедра химии и инженерной экологии в строительстве Расчётно-графическая работа по дисциплине «Химия» Вариант №12 Выполнил: ст. гр. 1СЖ01 Хохлов П.С. Проверил: старший преподаватель Антонова И.И. Казань 2022 Гидролиз солей Термин «гидролиз» буквально означает разложение водой. Гидролизу подвержены соединения различных классов. Гидролиз солей – это реакция обменного взаимодействия между солями (ионами солей) и водой (ионами воды). Гидролиз солей обратим. Обратная реакция – это нейтрализации кислот и оснований. Пусть НА - кислота, МOH - основание, МА - образованная ими соль. Тогда уравнение гидролиза будет иметь вид: MA+H2O=HA+MOH; 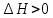 Причиной гидролиза является образование слабых электролитов. В этом случае происходит связывание одного или обоих ионов воды ионами растворённого вещества с образованием малодиссоциированного или труднорастворимого продукта. Это приводит к нарушению равновесия диссоциации воды H2O= 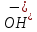 + +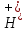 в результате может изменяться кислотность среды (рН раствора). В зависимости от силы кислоты и основания, из которых образована соль, выделяют четыре случая гидролиза. Гидролиз солей, образованных сильным основанием и слабой кислотой KCN= 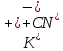 Гидролиз идёт по аниону путём связывания ионов водорода с накоплением гидроксид-ионов В результате реакция среды становится щелочной (рН 7). Полного разложения таких солей не происходит. Степень гидролиза меньше 100%, поскольку образование щелочи – КОН усиливает обратный процесс. Гидролиз солей с многозарядными ионами происходит ступенчато с образованием на промежуточных стадиях кислых или основных солей. Гидролиз солей, образованных слабым основанием и сильной кислотой Гидролиз идёт по катиону путём связывания гидроксид-ионов OH- с накоплением ионов водорода H+. В результате реакция среды становится кислой (рН < 7). Полного разложения таких солей не происходит. Степень гидролиза меньше 100%, поскольку образование сильного электролита (кислоты – НСl) усиливает обратный процесс. Гидролиз идёт по катиону путём связывания гидроксид-ионов OH- с накоплением ионов водорода H+. Гидролиз солей с многозарядными ионами происходит ступенчато с образованием на промежуточных стадиях кислых или основных солей. Гидролиз солей, образованных слабым основанием и слабой кислотой Гидролиз идёт и по катиону и по аниону путём связывания обоих ионов воды, в результате среда остаётся практически нейтральной (рН ≈ 7). Степень гидролиза → 100%. Гидролиз солей, образованных сильным основанием и сильной кислотой После сокращения одинаковых ионов в обеих частях уравнения остаётся уравнение реакции диссоциации воды: H2О = OH‾ + Н+ Таким образом, соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Реакция раствора остается нейтральной (рН=7,0). Влияние на равновесие при гидролизе солей. Гидролиз солей - процесс обратимый и протекает с поглощением тепла (эндотермически). При постоянных условиях наступает состояние равновесия, влияние на него подчиняется принципу Ле Шателье: Если на систему, находящуюся в состоянии равновесия, оказано внешнее воздействие, то равновесие сместится таким образом, чтобы уменьшить оказанное воздействие. Влияние температуры на степень гидролиза. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз - с поглощением теплоты. Выход эндотермических реакций с ростом температуры увеличивается, поэтому степень гидролиза растет с повышением температуры. Кс = ехр[-∆H°(Т)/(RT) + ∆S/R] Из данного выражения видно, что влияние температуры на равновесие определяется как абсолютным значением, так и знаком ∆H°(Т). Влияние температуры. Энергия активации процесса. Впервые количественная зависимость скорости реакции от температуры была дана в 1884 г. и известна, как правило Вант-Гоффа: При повышении температуры на каждые 10градусов, скорость реакции возрастает от двух до четырёх раз. Математически эта зависимость даётся в виде:  где 2 и 1 – скорость реакции при температурах Т2 и Т1, соответственно; - температурный коэффициент реакции (значения от 2 до 4). В чём причина зависимости? Впервые это сделал Аррениус (1889 г). Суть гипотезы Аррениуса: в эффективном столкновении принимают участие лишь активные молекулы - энергетический запас которых превышает некоторую минимальную величину, характерную для данной реакции. Эта величина – энергия активации реакции Еакт. Природа активационного барьера связана с преодолением отталкивания электронных оболочек атомов и молекул, необходимостью разрыва или ослабления старых связей, а также ориентацией частиц в момент соударения. 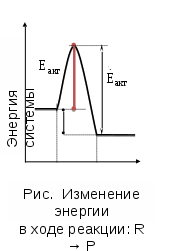 Величина Еакт зависит от природы в-в и механизма реакции (от 0 до 500 кДж/моль). Преодолеть барьер способны лишь активные молекулы с энергией E > Еакт. Чем меньше Еакт, тем больше число эффективных столкновений и тем выше скорость реакции. В большинстве случаев Еакт> Еср мол-л реагирующих в-в, иначе реакции протекали бы практически мгновенно. Дисперсная система Дисперсной называется система, состоящая из двух или более веществ, причём одно из них в виде очень маленьких частиц равномерно распределено (диспергировано) в объёме другого. Вещество, которое присутствует в меньшем количестве и распределено в объёме другого вещества, называют дисперсной фазой. Вещество, присутствующее в большем количестве, в объёме которого распределена дисперсная фаза, называют дисперсионной средой. И дисперсионную среду, и дисперсную фазу могут составлять вещества, находящиеся в различных агрегатных состояниях – твёрдом, жидком и газообразном. По размерам частиц дисперсной фазы различают: • грубодисперсные системы, размер частиц >10^-7 м; • мелкодисперсные (коллоидные растворы, золи), размер частиц 10^-7 – 10^- 9м; • истинные растворы, размер частиц менее м (менее нм). К грубодисперсным системам относятся суспензии и эмульсии. К мелкодисперсным системам относятся золи, аэрозоли, пены, твёрдые коллоидные растворы. Коллоидные растворы занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы рассеивают свет, вследствие чего при прохождении луча света через коллоидную систему образуется светящийся конус (конус Тиндаля). Коллоидные растворы могут быть получены с помощью методов диспергирования и конденсации. Дисперсные системы широко распространены в природе и участвуют во многих технологических процессах. Термодинамика В различных процессах (в том числе и химических) действуют две конкурирующие тенденции: 1) Стремление системы перейти в состояние с наименьшей энергией, т.е. понизить энтальпию (Н < 0); 2) Стремление системы перейти в состояние с максимальной степенью разупорядоченности, т.е. повысить энтропию (S > 0). Если в ходе реакции степень беспорядка не изменяется (S = 0), то направление процесса определяется изменением энтальпии и процесс проходит самопроизвольно в направлении уменьшения энтальпии (Н 0). Если одновременно изменяются и энтальпия, и энтропия, то направление самопроизвольного протекания процесса определяется суммарной движущей силой реакции. Самопроизвольно реакция протекает в том направлении, в котором общая суммарная движущая сила системы будет уменьшаться. С учетом одновременного действия этих двух противоположных факторов такой движущей силой (функцией состояния) для реакций, протекающих при постоянной температуре и давлении, является энергия Гиббса (G), называемая также изобарно-изотермическим потенциалом, или свободной энергией. В качестве критерия для определения направления самопроизвольного протекания химических процессов используется изменение энергии Гиббса G (G = G2 – G1). В зависимости от знака её изменения возможны три случая. 1. G 0, реакция термодинамически возможна. При постоянной температуре и давлении химические реакции протекают самопроизвольно только в направлении уменьшения энергии Гиббса в системе (G 0). 14 Это положение связано с принципом минимума энергии, лежащим в основе второго закона термодинамики, одна из формулировок которого гласит: “Теплота не может самостоятельно переходить от менее нагретого тела к более нагретому, самопроизвольно возможен лишь обратный процесс”. 2. G 0, реакция термодинамически невозможна; 3. G = 0, термодинамически возможны как прямая, так и обратная реакция. Отсутствие изменения энергии Гиббса является термодинамическим условием установления химического равновесия в реакционной системе. Энергия Гиббса связана с энтальпией, энтропией и температурой: G = H ТS. Изменение энергии Гиббса (G) при этом записывается в виде: G = Н – Т S. Из уравнения G = H TS следует, что возможность самопроизвольного протекания химических реакций зависит от соотношения величины Н и ТS. При этом возможны четыре основных случая: 1. Если Н < 0, а S > 0, то энергия Гиббса всегда будет величиной отрицательной (G < 0). Такие реакции термодинамически возможны при любой температуре. 2. Если Н > 0, а S < 0, то всегда G > 0. Такие реакции термодинамически невозможны при любых температурах. 3. Если Н > 0 и S 0, то реакция возможна только при высоких температурах, когда Н < TS. 4. Если Н < 0 и S < 0, то реакция возможна при низких температурах, когда Н > TS. Для проведения различных термодинамических расчетов вводят стандартные энергии Гиббса образования вещества (G o обр. 298), т.е. изменение энергии Гиббса реакции образования одного моля соединения из соответствующих простых веществ (все участвующие вещества находятся в стандартном состоянии) при стандартных условиях (измеряется обычно в кДж/моль). Стандартная энергия Гиббса образования простых веществ условно принимается равной нулю. Энергия Гиббса является функцией состояния системы, поэтому её изменение в ходе той или иной химической реакции зависит только от природы и 15 физического или агрегатного состояния исходных веществ и продуктов реакции и не зависит от промежуточных стадий реакции или от того, каким путем данная реакционная система достигла конечного состояния, т.е. G = G o 298 прод. G o 298 исх. При суммировании обязательно учитывается число молей всех участвующих веществ. |
