|
|
Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
1.3.Геном эукариот
Как уже упоминалось выше, в отличие от прокариот основная часть генома эукариот находится в специальном клеточном компартменте (органелле), получившем название ядра, а значительно меньшая часть – в митохондриях, хлоропластах и других пластидах. Так же, как и у прокариот, информационной макромолекулой генома эукариот является ДНК, которая неравномерно распределена по нескольким хромосомам в виде комплексов с многочисленными белками. Эти ДНК-белковые комплексы эукариот получили название хроматина. На протяжении клеточного цикла хроматин претерпевает высокоупорядоченные структурные преобразования в виде последовательных конденсаций–деконденсаций. В соматических клетках при максимальной конденсации в метафазе митоза эти преобразования сопровождаются формированием видимых в микроскопе метафазных хромосом. Как морфология метафазных хромосом, так и их число являются уникальными характеристиками вида. Совокупность внешних признаков хромосомного набора эукариот получила название кариотипа. Эти признаки широко используются в биологической систематике.
Геном эукариот существенно отличается от генома прокариот по ряду признаков, среди которых необходимо отметить его избыточность. Содержание ДНК у эукариот в расчете на одну клетку в среднем на два–три порядка выше, чем у прокариот, и у разных видов животных изменяется от 168 пг (амфибии) до 1 пг (некоторые виды рыб). У человека имеется 6 пг ДНК на диплоидный геном, суммарная длина которой приближается к 6·109 п.о. (см. табл. I.1).
Повышенное содержание ДНК в геноме эукариот нельзя объяснить одним лишь увеличением потребности этих организмов в дополнительной генетической информации в связи с усложнением организации, поскольку большая часть их геномной ДНК, как правило, представлена некодирующими последовательностями нуклеотидов. Размер генома организмов, находящихся на более низких ступенях эволюционного развития, зачастую превышает размеры геномов более высокоорганизованных животных и растений. В настоящее время известно, что большая часть ДНК генома эукариот не кодирует РНК и белки, и ее генетические функции не вполне понятны. Особенности первичной структуры ДНК эукариот позволяют разделить ее на многочисленные семейства и классы, основные из которых кратко рассмотрены ниже.
1.3.1.Последовательности нуклеотидов эукариотического генома
Геном эукариот составляют уникальные и повторяющиеся последовательности нуклеотидов. Содержание уникальных последовательностей в геноме, определенное на основании кинетики реассоциации фрагментированной ДНК, варьирует у разных организмов, и их доля составляет 15–98% от всей ДНК. Несмотря на то, что во фракцию уникальных последовательностей попадают многие структурные гены, большая часть уникальных последовательностей является некодирующей и обычно не заключает в себе генетической информации в общепринятом значении этого термина: не кодирует функционально значимые полипептидные цепи или РНК. Хорошо известным примером таких уникальных последовательностей являются интроны, общий размер которых, как правило, на порядок и более превышает суммарный размер экзонов содержащих их генов.
Эволюционное возникновение мозаичной (интрон–экзонной) структуры генов эукариот, так же как и консервативный характер наследования размеров и взаимного расположения интронов в генах, не находит в настоящее время исчерпывающего объяснения из-за кажущегося отсутствия фактора давления естественного отбора на последовательности нуклеотидов без четких биологических функций. Наибольшее распространение получила концепция В. Гилберта (1977 г.), согласно которой появление интронов, по-видимому, совпавшее по времени с эволюционным возникновением многоклеточных организмов, обеспечило возможность обмена экзонами между неродственными генами (exon shuffling). Такой обмен должен сопровождаться образованием новых белков мозаичного строения, составленных из готовых полипептидных функционально значимых модулей (доменов), ранее принадлежавших другим белкам. Следствием этого, по мнению сторонников данной концепции, было резкое ускорение образования белков и ферментов с новыми функциями, а также глубокие эволюционные преобразования самих организмов, реализующих такие молекулярные механизмы. Эта точка зрения получила название "гипотезы позднего возникновения интронов" (intron late). В соответствии с другой гипотезой Дж.Е. Дарнелла и В.Ф. Дулиттла (1978 г.) современные интроны представляют собой "эволюционные реликты". Когда-то интроны были частью гигантских генов.
Не менее загадочным с эволюционной точки зрения остается и феномен появления в геноме многоклеточных организмов большого количества некодирующих повторяющихся последовательностей. Такие повторы представлены в гаплоидном геноме эукариот множественными копиями. В современной классификации повторов принято различать часто повторяющиеся последовательности, число которых превышает 105 на гаплоидный геном, и умеренно повторяющиеся, представленные 10–104 копиями. Хорошо изученным представителем первых является сателлитная ДНК, которая состоит из коротких тандемных повторов длиной 1–20 п.о., организованных в длинные блоки. Одними из первых среди повторяющихся последовательностей ДНК эукариот были открыты сателлитные ДНКтимуса телят. Свое название они получили на основании того, что при анализе суммарной эукариотической ДНК центрифугированием в градиенте плотности хлористого цезия они сопровождали основной пик оптической плотности в виде плеча (спутника, сателлита). Именно гомогенный нуклеотидный состав фракции сателлитных ДНК, определяемый наличием в ней многочисленных коротких повторов, изменял ее плавучую плотность, что легко обнаруживалось при центрифугировании. В своем классическом определении сателлитных ДНК Р.Д. Бриттен и соавт. (1974 г.) отмечали, что сателлиты – это минорный компонент ДНК, отделяющийся от основной ДНК при равновесном ультрацентрифугировании в градиенте плотности CsCl. Для сателлитов характерен ряд свойств, среди которых наиболее важны: а) быстрая и точная реассоциация в процессе ренатурации ДНК; б) множество копий; в) простая первичная структура; г) гомогенный состав (протяженные кластеры одних и тех же повторяющихся блоков последовательны); д) пурин–пиримидиновая асимметрия в распределении нуклеотидов по цепям ДНК; е) концентрирование в прицентромерном гетерохроматине; ж) ограниченная репликация (недорипликация) при политенизации хромосом; з) нахождение в составе хромосом в виде тандемно (друг за другом) расположенных кластеров. Содержание сателлитной ДНК в геноме эукариот может достигать 5–50% от суммарного количества ДНК. Микро- (от 1 до 4 п.о. в основном повторяющемся блоке) и минисателлитные (с бóльшим числом п.о. в индивидуальном повторе) ДНК характеризуются высокой вариабельностью по числу копий в геномах организмов даже одного вида и в ряде случаев обладают генетической нестабильностью как в норме, так и при некоторых патологических состояниях организмов. Благодаря этому свойству мини- и микросателлиты часто называют тандемными повторами с изменяющимся числом копий VNTR (variable number of tandem repeats).
Другой тип повторов – диспергированные повторяющиеся последовательности ДНК, не организованные в крупные блоки, а рассеянные по геному. Повторы этого типа, иначе называемые умеренно повторяющимися последовательностями (medium reiterated frequency repeats – MERs), разделяют на два обширных класса: SINE (short interspersed elements) – короткие и LINE (long interspersed elements) – длинные диспергированные элементы. Длина SINE-элементов составляет 90–400 п.о., тогда как длина LINE-последовательностей может достигать 7 т.п.о. Хорошо изученными повторами класса SINE в геноме человека и некоторых приматов являются так называемые Alu-повторы, длина повторяющейся единицы которых составляет 300 п.о. Alu-повторы представлены в геноме человека
106 копиями и в среднем встречаются через каждые 4 т.п.о., составляя
5% от суммарного количества ДНК. Аналогичные в структурном отношении повторы, названные B1, обнаружены в геноме мышей и под другими названиями описаны у многих млекопитающих.
Хотя LINE-последовательности заключают в себе гены обратных транскриптаз, что является признаком ретротранспозонов (мобильных генетических элементов животных, обладающих структурным сходством с геномом ретровирусов), для них характерно отсутствие последовательностей длинных концевых повторов (long terminal repeats – LTR), типичных для ретротранспозонов (подробнее о геноме ретровирусов см. раздел 7.2.7). В качестве примера LINE-последовательности можно упомянуть LINE-1-повтор, широко распространенный в геноме животных. LINE-1-элемент мышей содержит две открытые рамки считывания ORF-1 и ORF-2, вторая из которых кодирует белок, гомологичный обратной транскриптазе. ORF фланкированы короткими нетранслируемыми последовательностями, а сами LINE-1 – короткими прямыми повторами (SDR). 5’-Концевые последовательности повтора функционируют в качестве промоторов транскрипции. Этот участок LINE-1 грызунов (но не человека) построен из коротких тандемных повторов двух типов A и F, называемых мономерами. Длина мономеров у крыс составляет 600 п.о. При этом A- (но не F) мономеры обладают активностью промоторов.
Так же как и сателлитные ДНК, SINE- и LINE-повторы характеризуются генетической нестабильностью. Их общими чертами являются транскрибируемость и способность к транспозициям. Последовательности РНК, транскрибированные с умеренных повторов, обнаруживают среди гетерогенных ядерных РНК, где их доля достигает 20–30%. Имеются экспериментальные свидетельства того, что новые копии повторяющихся элементов обоих типов возникают в геноме в результате функционирования механизма, названного ретротранспозицией, или ретропозицией. При участии подобного механизма под действием обратной транскриптазы сначала образуется кДНК на матрице РНК-транскрипта соответствующего повтора, которая далее интегрируется в новый локус генома, как это имеет место у ретровирусов. Такой механизм дает возможность локально изменять число копий определенных последовательностей нуклеотидов в эукариотическом геноме. Тем не менее, большая часть LINE-последовательностей неспособна к транспозициям, и их ORF, по-видимому, могут быть отнесены к псевдогенам – неэкспрессирующимся последовательностям, гомологичным последовательностям истинных генов. Помимо вышеупомянутых повторяющихся последовательностей геном человека содержит более 100 000 копий MaLR-повторов длиной в 2–3 т.п.о., содержащих LTR, и несколько тысяч последовательностей генома ретровирусов.
Несмотря на широкую распространенность повторяющихся и уникальных некодирующих последовательностей в геноме эукариот и их очевидную активность во время жизненного цикла организмов, биологическое значение этих и других некодирующих элементов генома остается непонятным. Вызывает сомнение правильность активно обсуждаемой в литературе гипотезы об "эгоистичности" избыточной геномной ДНК, в соответствии с которой вся избыточная ДНК является геномным паразитом и распространяется в геноме в результате транспозиций точных копий немногочисленных исходных последовательностей. Действительно, слишком велики были бы энергетические затраты на биосинтез предшественников ДНК и самой ДНК в клетках, в которых содержание "паразитической" ДНК в геноме на 2–3 порядка превышает количество функционально значимой ДНК, заключающей в себе последовательности нуклеотидов генов. Клетки с геномом, "зараженным" эгоистической ДНК, не смогли бы выдерживать конкуренции с клетками, не содержащими "паразита", из-за значительного возрастания энергетических затрат на редупликацию генома. Кроме того, концепция эгоистической ДНК, в соответствии с которой предполагается отсутствие эволюционного давления отбора на "паразитические" последовательности нуклеотидов, не объясняет высокую консервативность мест локализации и размеров интронов в гомологичных генах филогенетически близких организмов, а также не указывает на механизм, поддерживающий число копий повторов на относительно постоянном уровне в ряду поколений организмов. Такого рода концепции не могут ответить на вопрос: где же предел, до которого может самопроизвольно увеличиваться размер генома клетки-хозяина в филогенезе?
Функциональную значимость избыточной ДНК лишь частично объясняют концепции, приписывающие ей структурную роль в пространственной организации генома и участие в конъюгации гомологичных хромосом в мейозе или репликации теломерных участков хромосом. Таким образом, основные положения знаменитого парадокса C, указывающие на необъяснимое присутствие в геноме эукариотических организмов большого количества избыточной ДНК, по-прежнему остаются загадочными и парадоксальными. Попытка нового объяснения основной функциональной роли "избыточной" ДНК в геноме эукариот сделана в разделе 5.3.
1.3.2.Хроматин
Хроматином называют сложную смесь веществ, из которых построены хромосомы эукариот. Основными компонентами хроматина являются ДНК, гистоны и негистоновые белки, образующие высокоупорядоченные в пространстве структуры. Соотношение ДНК и белка в хроматине составляет
1:1, а основная масса белка хроматина представлена гистонами. Гистоны образуют семейство высококонсервативных основных белков, которые разделяются на пять больших классов, названных H1, H2A, H2B, H3 и H4. Размер полипептидных цепей гистонов лежит в пределах
220 (H1) и 102 (H4) аминокислотных остатков. Гистон H1 сильно обогащен остатками Lys, для гистонов H2A и H2B характерно умеренное содержание Lys, полипептидные цепи гистонов H3 и H4 богаты Arg. Внутри каждого класса гистонов (за исключением H4) на основании аминокислотных последовательностей различают несколько субтипов этих белков. Такая множественность особенно характерна для гистонов класса H1 млекопитающих. В этом случае различают семь субтипов, названных H1.1–H1.5, H1o и H1t.
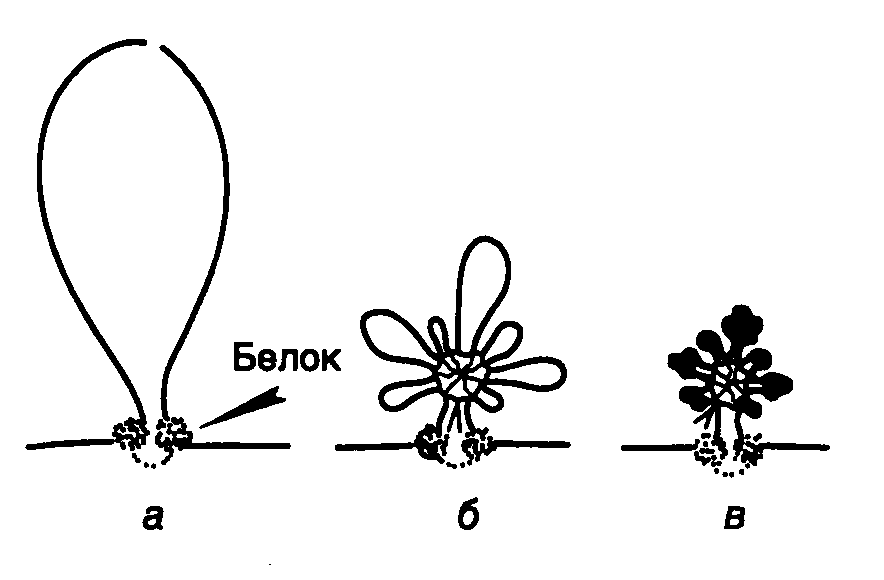
Рис. I.2. Схематическое изображение петельно-доменного уровня компактизации хроматина
а – фиксация петли хромомера на ядерном матриксе с помощью MAR/SAR-последовательностей и белков; б – "розетки", образованные из петли хромомера; в – конденсация петель "розеток" с участием нуклеосом и нуклеомеров
Важным результатом взаимодействия ДНК с белками в составе хроматина является ее компактизация. Суммарная длина ДНК, заключенной в ядре клеток человека, приближается к 1 м, тогда как средний диаметр ядра составляет 10 мкм. Длина молекулы ДНК, заключенной в одной хромосоме человека, в среднем равняется
4 см. В то же время длина метафазной хромосомы составляет
4 мкм. Следовательно, ДНК метафазных хромосом человека компактизована по длине, по крайней мере, в 104 раз. Степень компактизации ДНК в интерфазных ядрах значительно ниже и неравномерна в отдельных генетических локусах. С функциональной точки зрения различают эухроматин и гетерохроматин. Эухроматин характеризуется меньшей по сравнению с гетерохроматином компактизацией ДНК, и в нем главным образом локализуются активно экспрессирующиеся гены. В настоящее время широко распространено мнение о генетической инертности гетерохроматина. Поскольку его истинные функции сегодня нельзя считать установленными, эта точка зрения по мере накопления знаний о гетерохроматине может измениться. Уже сейчас в нем находят активно экспрессирующиеся гены.
Гетерохроматизация определенных участков хромосом часто сопровождается подавлением транскрипции имеющихся в них генов. В процесс гетерохроматизации могут быть вовлечены протяженные участки хромосом и даже целые хромосомы. В соответствии с этим считается, что регуляция транскрипции генов эукариот в основном происходит на двух уровнях. На первом из них компактизация или декомпактизация ДНК в хроматине может приводить к длительной инактивации или активации протяженных участков хромосом или даже целых хромосом в онтогенезе организма. Более тонкая регуляция транскрипции активированных участков хромосом достигается на втором уровне при участии негистоновых белков, включающих многочисленные факторы транскрипции.
Структурная организация хроматина и хромосом эукариот. Вопрос о структурной организации хроматина в интерфазных ядрах в настоящее время далек от своего разрешения. Это связано, прежде всего, со сложностью и динамичностью его структуры, которая легко меняется даже при незначительных экзогенных воздействиях. Большинство знаний о структуре хроматина было получено in vitro на препаратах фрагментированного хроматина, структура которого значительно отличается от таковой в нативных ядрах. В соответствии с распространенной точкой зрения различают три уровня структурной организации хроматина у эукариот: 1) нуклеосомная фибрилла; 2) соленоид, или нуклеомер; 3) петельно-доменная структура, включающая хромомеры.
Нуклеосомные фибриллы. В определенных условиях (при низкой ионной силе и в присутствии двухвалентных ионов металлов) в изолированном хроматине удается наблюдать регулярные структуры в виде протяженных фибрилл диаметром 10 нм, состоящих из нуклеосом. Эти фибриллярные структуры, в которых нуклеосомы расположены как бусы на нитке, рассматриваются в качестве низшего уровня упаковки ДНК эукариот в хроматине. Нуклеосомы, входящие в состав фибрилл, расположены более или менее равномерно вдоль молекулы ДНК на расстоянии 10–20 нм друг от друга. В состав нуклеосом входят четыре пары молекул гистонов: H2a, H2b, H3 и H4, а также одна молекула гистона H1. Данные по структуре нуклеосом в основном получены с использованием трех методов: рентгеноструктурного анализа низкого и высокого разрешения кристаллов нуклеосом, межмолекулярных сшивок белок–ДНК и расщепления ДНК в составе нуклеосом с помощью нуклеаз или радикалов гидроксила. На основании таких данных А. Клугом была построена модель нуклеосомы, в соответствии с которой ДНК (146 п.о.) в B-форме (правозакрученная спираль с шагом 10 п.о.) намотана на гистоновый октамер, в центральной части которого расположены гистоны Н3 и Н4, а на периферии – Н2а и Н2b. Диаметр такого нуклеосомного диска составляет 11 нм, а его толщина – 5,5 нм. Структура, состоящая из гистонового октамера и намотанной на него ДНК, получила название нуклеосомной кóровой частицы. Кóровые частицы отделены друг от друга сегментами линкерной ДНК. Общая длина участка ДНК, включенного в нуклеосому животных, составляет 200 (15) п.о.
Полипептидные цепи гистонов содержат структурные домены нескольких типов. Центральный глобулярный домен и гибкие выступающие N- и С-концевые участки, обогащенные основными аминокислотами, получили название плеч (arm). С-концевые домены полипептидных цепей, участвующие в гистон–гистоновых взаимодействиях внутри кóровой частицы, находятся преимущественно в виде -спирали с протяженным центральным спиральным участком, вдоль которого с двух сторон уложено по одной более короткой спирали. Все известные места обратимых посттрансляционных модификаций гистонов, происходящих на протяжении клеточного цикла или во время дифференцировки клеток, локализованы в гибких основных доменах их полипептидных цепей (табл. I.2). При этом N-концевые плечи гистонов H3 и H4 являются самыми консервативными участками молекул, а гистоны в целом – одними из наиболее эволюционно консервативных белков. С помощью генетических исследований дрожжей S. cerevisiaeбыло установлено, что небольшие делеции и точковые мутации в N-концевых частях генов гистонов сопровождаются глубокими и разнообразными изменениями фенотипа дрожжевых клеток. Это указывает на чрезвычайную важность целостности молекул гистонов в обеспечении правильного функционирования эукариотических генов.
В растворе гистоны Н3 и Н4 могут существовать в виде стабильных тетрамеров (Н3)2(Н4)2, а гистоны Н2А и Н2В – в виде стабильных димеров. Постепенное повышение ионной силы в растворах, содержащих нативный хроматин, приводит к освобождению сначала димеров Н2А/Н2В, а затем тетрамеров Н3/Н4.
Дальнейшее уточнение тонкой структуры нуклеосом в кристаллах было проведено недавно в работе К. Люгера с соавт. (1997 г.) с помощью рентгеноструктурного анализа высокого разрешения. Было установлено, что выпуклая поверхность каждого гистонового гетеродимера в составе октамера огибается сегментами ДНК длиной 27–28 п.о., расположенными по отношению друг к другу под углом 140о, которые разделены линкерными участками длиной в 4 п.о.
В соответствии с современными данными пространственная структура ДНК в составе кóровых частиц несколько отличается от B-формы: двойная спираль ДНК перекручена на 0,25–0,35 п.о./виток двойной спирали, что приводит к образованию шага спирали, равному 10,2 п.о./виток (у В-формы в растворе – 10,5 п.о./виток). Стабильность комплекса гистонов в составе кóровой частицы определяется взаимодействием их глобулярных частей, поэтому удаление гибких плеч в условиях мягкого протеолиза не сопровождается разрушением комплекса. N-концевые плечи гистонов, по-видимому, обеспечивают их взаимодействие со специфическими участками ДНК. Так, N-концевые домены гистона Н3 контактируют с участками ДНК на входе в кóровую частицу и выходе из нее, тогда как соответствующий домен гистона Н4 связывается с внутренней частью ДНК нуклеосомы.
Упомянутые выше исследования структуры нуклеосом высокого разрешения показывают, что центральная часть сегмента ДНК длиной в 121 п.о. в составе нуклеосомы образует дополнительные контакты с гистоном H3. При этом N-концевые части полипептидных цепей гистонов H3 и H2B проходят через каналы, образуемые малыми бороздками соседних супервитков ДНК нуклеосомы, а N-концевая часть гистона H2A контактирует с малой бороздкой внешней части супервитка ДНК. В совокупности данные высокого разрешения показывают, что ДНК в составе коровых частиц нуклеосом огибает гистоновые октамеры неравномерно. Кривизна нарушается в местах взаимодействия ДНК с поверхностью гистонов, и такие изломы наиболее заметны на расстоянии 10–15 и 40 п.о. от центра супервитка ДНК.
Таблица I.2
Свойства гистонов животных
Гистон
|
Размер полипептида
(число аминокислот)
|
Локализация и типы посттрансляционных модификаций
|
|
Вся молекула
|
N-концевое плечо
|
С-концевое плечо
|
|
Н3
|
135
|
41
|
25
|
Ac-K9, P-S10, Ac-K-14, Ac-K18, Ac-K23, Ac-K27
|
H4
|
102
|
32
|
–
|
P-S1, Ac-K5, Ac-K8, Ac-K12,
Ac-K16, Ac-K20
|
H2A
|
129
|
24
|
16
|
P-S1, Ac-K5, Ac-K9
|
H2B
|
125
|
30
|
23
|
Ac-K12, Ac-K15, Ac-K20, Ac-K24, P-S32, P-S36
|
H1
|
213
|
36
|
92
|
S-фаза: P-S145, P-S173, P-S180
Митоз: P-S16, P-T17, P-T136,
P-S145, P-S173, P-S180
|
Примечание. Ac – ацетилирование, P – фосфорилирование; K, R, T и S – остатки Lys, Arg, Thr и Ser соответственно. Цифры обозначают положение соответствующих аминокислотных остатков в полипептидных цепях.
|
Структура фибриллы хроматина типа "бусин на нитке" наблюдается in vitro при очень низкой ионной силе и в отсутствие двухвалентных катионов или же без гистона Н1 даже при физиологических концентрациях солей. При повышении ионной силы в присутствии гистона Н1, который выполняет функции конденсирующего агента, в хроматине происходит структурный переход, сопровождающийся формированием равномерной фибриллы диаметром 30 нм, в которой нуклеосомы располагаются вплотную друг к другу. Предполагается, что именно такая структура хроматина на этом уровне конденсации преобладает in vivo.
В ядрах ДНК в основном входит в состав фибрилл диаметром 2530 нм, которые образуются и в растворах с физиологическими концентрациями солей (100 мМ NaCl), содержащих изолированный хроматин. Такие фибриллы в форме соленоида неравномерны по своей длине. С помощью электронного микроскопа в них обнаруживаются гранулы диаметром 30 нм, между которыми находятся более тонкие участки. Ю.С. Ченцов, впервые обнаруживший эти гранулы, назвал их нуклеомерами, позднее они были описаны в литературе под названием "супербидов" (super-beads). Согласно модели А. Клуга, на один шаг (10 нм) соленоида приходится 6 нуклеосом, что приводит к уменьшению в 6 раз длины фибриллы диаметром в 10 нм, а исходной свободной ДНК – в 40 раз. Таким образом, в соответствии с этой упрощенной картиной цепь нуклеосом на втором уровне упаковки хроматина свернута в симметрично построенный соленоид, содержащий нуклеомеры. Симметрия соленоида нарушается при взаимодействии с ним негистоновых белков.
Энергия, необходимая для образования соленоида, частично черпается из энергии взаимодействия нуклеосом друг с другом. Однако основной вклад в этот процесс вносит гистон Н1, связывание молекул которого с линкерной ДНК за пределами кóровых частиц обеспечивает образование компактных фибрилл диаметром 30 нм. Дифференцирующиеся клетки высших эукариот обладают способностью к синтезу целого семейства гистонов Н1, например Н1А, Н1В, Н1о, которые имеют структурное сходство с гистоном Н5, обнаруженным в дифференцирующихся предшественниках эритроцитов. Полипептидные цепи гистонов семейства Н1, как и молекулы гистонов кóровых частиц, содержат центральный глобулярный домен и два гибких плеча. Глобулярный домен определяет локализацию гистона Н1 в нуклеосомах, где он взаимодействует с ДНК в месте ее входа в кóровую частицу и выхода из нее, стабилизируя два отрицательных супервитка ДНК, обернутой вокруг гистонового октамера. Расщепление хроматина нуклеазой микрококков приводит к освобождению гистона Н1, так как при этом происходит отщепление сегментов ДНК, с которыми он взаимодействует.
Следует подчеркнуть, что точная структура соленоида в настоящее время неизвестна. Данные, недавно полученные методом рассеивания нейтронов, указывают на то, что гистон Н1 локализован внутри хроматиновой фибриллы и на ее поперечном срезе помещается шесть нуклеосом, что хорошо соответствует модели Клуга. Однако при изучении хроматина с помощью сканирующей микроскопии было установлено, что при низкой ионной силе соленоид существует в виде нерегулярной спирали.
Петельно-доменный уровень компактизации хроматина. В интерфазных ядрах эукариот нити хроматина, в которых ДНК упакована в форме соленоида, содержащего нуклеомеры, организованы в виде топологически независимых петель, длина которых в среднем составляет 50–100 т.п.о. Такой способ пространственной укладки нитей хроматина рассматривается как следующий уровень конденсации хроматина (и ДНК) у эукариот, а сами петли получили название хромомеров. С помощью электронного микроскопа обнаружено, что нити хроматина в хромомерах имеют дополнительную специфическую укладку в виде розеток, собранных у основания, от которого отходят малые петли длиной 5 т.п.о. (см. рис. I.2). Образование хромомеров становится возможным благодаря наличию у их оснований определенных последовательностей нуклеотидов, которые специфически взаимодействуют с ядерным матриксом, называемым иначе ядерным скэффолдом (скелетом) – сетчатообразной структурой внутри интерфазных ядер, образованной белками и РНК. Эти участки хромосомной ДНК, взаимодействующие с ядерным матриксом, в литературе известны под сокращенными названиями MAR (Matrix Associated Region) или SAR (Scaffold Associated Region) и часто обозначаются как MAR/SAR-последовательности.
Были предприняты попытки связать локализацию MAR/SAR-последовательностей на ДНК с функциональной активностью хроматина. Исследование петельной структуры хроматина в ядрах дрозофилы показало, что эти последовательности часто располагаются в окрестностях генов, транскрибируемых РНК-полимеразой II, и фланкируют участки хроматина, содержащие одну или несколько транскрипционных единиц. Выяснилось, что активно транскрибируемые гены организованы в петли небольшого размера (10 т.п.о.), тогда как "молчащие" гены находятся преимущественно в составе более крупных петель, которые содержат несколько транскрипционных единиц и, в свою очередь, образуют дополнительные петли в виде розеток (см. рис. I.2). Как правило, MAR/SAR-последовательности фланкируют гены, однако в ряде случаев их обнаруживают и внутри генов, но в составе интронов. В настоящее время выделено и охарактеризовано несколько десятков MAR/SAR-последовательностей из генома дрозофилы и других организмов. У дрозофилы они представляют собой АТ-богатые последовательности нуклеотидов длиной в 200–350 п.о., в составе которых часто встречаются участки поли(dA)поли(dT). Обнаружены два типа блоков из АТ-богатых последовательностей: А-блок – AATAAAT/CAAA и Т-блок – TTA/TTT/ATTT/CAAA, характерные для всех MAR/SAR-последовательностей не только дрозофилы, но и других организмов. Отличающиеся от них блоки похожих последовательностей нуклеотидов – ATATTT и AATATTTT, первоначально найденные в MAR/SAR-последовательностях мышей, оказались широко представленными и в аналогичных последовательностях многих эукариот.
Можно выделить следующие обобщенные характеристики MAR/SAR-последовательностей, приведенные в недавнем обзоре М.В. Глазкова (1995 г.):
длина MAR/SAR-последовательностей составляет 300–1000 п.о.; все они содержат многочисленные сайты ДНК-белкового взаимодействия и обогащены AT-парами;
MAR/SAR-последовательности обладают способностью обратимо связываться с ядерным матриксом метафазных хромосом и локализованы исключительно в некодирующих последовательностях генома, главным образом в нетранскрибируемых участках, реже в интронах;
расстояние между двумя соседними MAR/SAR-последовательностями составляет 3–112 т.п.о., и они фланкируют один или несколько экспрессирующихся генов, для которых характерна повышенная чувствительность к нуклеазам из-за деконденсированного состояния их хроматина;
некоторые MAR/SAR-последовательности выявлены рядом с энхансероподобными регуляторными элементами. Кроме того, эти последовательности могут быть потенциальными сайтами инициации репликации и содержать в своем составе большое число сайтов для разных факторов транскрипции;
MAR/SAR-последовательности иногда соседствуют с последовательностями, способными образовывать Z- или H-формы ДНК, и в таких случаях они определяются как сайты с повышенной чувствительностью к ДНКазе I.
Все это указывает на то, что MAR/SAR-последовательности являются чрезвычайно важными в функциональном отношении последовательностями геномной ДНК эукариот. Одной из основных функций, которую им приписывают в настоящее время, может быть пространственное разграничение функциональных доменов хроматина в интерфазных ядрах эукариот, необходимое для эффективной и независимой экспрессии генов, находящихся в этих доменах. Подробнее о выполнении MAR/SAR-последовательностями функций пограничных последовательностей (инсуляторов), регулирующих экспрессию эукариотических генов, см. в разделе 3.2.4.
Являясь одними из ключевых цис-действующих генетических регуляторных элементов хромосом эукариот, MAR/SAR-последовательности осуществляют глобальный контроль изменений структуры хроматина и связанных с ними модуляций экспрессии генов на уровне транскрипции. В настоящее время считается, что эти последовательности обеспечивают поддержание функциональной структуры хромосом в интерфазных ядрах и вовлечены в процесс их конденсации при формировании метафазных хромосом во время митоза. Современная модель структуры метафазной хромосомы К.М. Харта и У.К. Лэммли (1998 г.) подчеркивает, что SAR-последовательности, пространственно примыкая друг к другу, образуют ось хроматиды, от которой в разные стороны отходят петли хроматина, формирующие тело метафазной хромосомы. Однако еще остается доказать, являются ли MAR/SAR-последовательности местами специфического прикрепления белковых комплексов, включающих, к примеру, белок конденсин, которые необходимы для конденсации хроматина.
Негистоновые белки хроматина. Большое влияние на структуру хроматина и функционирование эукариотических генов оказывают различные негистоновые белки. В ядрах в наибольшем количестве обнаруживают негистоновые белки, которые относят к так называемой группе белков с высокой подвижностью (high mobility group – HMG). Это название отражает их высокую подвижность при электрофорезе. Суммарное содержание HMG-белков в ядрах клеток в 10 раз меньше, чем гистонов. Эти белки разделяют на три основных подкласса: 14/17, 1/2 и I/Y.
HMG 14/17 представляют собой небольшие белки с молекулярной массой 10–12 кДа, полипептидные цепи которых несут большой локальный электрический заряд при физиологических значениях рН. N-Концевые части их полипептидных цепей обладают основными свойствами, тогда как С-концевые – кислыми. Кóровые частицы нуклеосом содержат на своей поверхности две молекулы HMG 14/17, которые соединяют между собой цепи ДНК двух соседних витков. HMG-Белки этой группы могут замещать гистон H1 в активно транскрибируемых генах. In vivo 10% коровых частиц нуклеосом могут содержать белки HMG 14/17.
Белки группы HMG 1/2 также являются одними из преобладающих ядерных белков с молекулярной массой 25–30 кДа. Эти белки специфически связываются с одноцепочечными участками ДНК, а также участками ДНК, образующими крестообразные структуры в местах, содержащих палиндромные последовательности. Это указывает на их возможное участие в процессах рекомбинации, репарации и(или) репликации. Было показано, что белки HMG 1/2 способствуют сборке нуклеосом in vitro, однако физиологическое значение этого факта остается непонятным, поскольку многие отрицательно заряженные молекулы в экспериментальных условиях также ускоряют образование нуклеосом.
Белки HMG I/Y преимущественно взаимодействуют с АТ-богатыми участками ДНК, что характерно и для гистона Н1. Предполагается, что эти белки конкурируют с гистоном Н1 in vivo за промоторы и области начала репликации ДНК (см. разделы 2.1 и 4.1).
Помимо HMG-белков к негистоновым белкам хроматина относятся многочисленные внутриядерные ферменты и белковые факторы, необходимые для работы генетического аппарата клетки. Многим из этих белков, обеспечивающим транскрипцию, репарацию и репликацию, посвящены целые разделы этой книги. Среди негистоновых белков особое место занимают ДНК-топоизомеразы, механизмы функционирования которых целесообразно рассмотреть отдельно.
1.3.3.Роль ДНК-топоизомераз в обеспечении структуры и функционирования хроматина
Топоизомеразы контролируют в клетках уровень суперскрученности ДНК, который может изменяться в процессе ее репликации, транскрипции, гомологичной рекомбинации, а также во время перестроек хроматина. Все эти ферменты релаксируют суперскрученные молекулы ДНК, снимая их внутреннее напряжение путем внесения одно- или двухцепочечных разрывов с последующим их восстановлением (лигированием). По механизму действия различают ДНК-топоизомеразы типа I и II. ДНК-топоизомеразы I, которые являются мономерными белками,
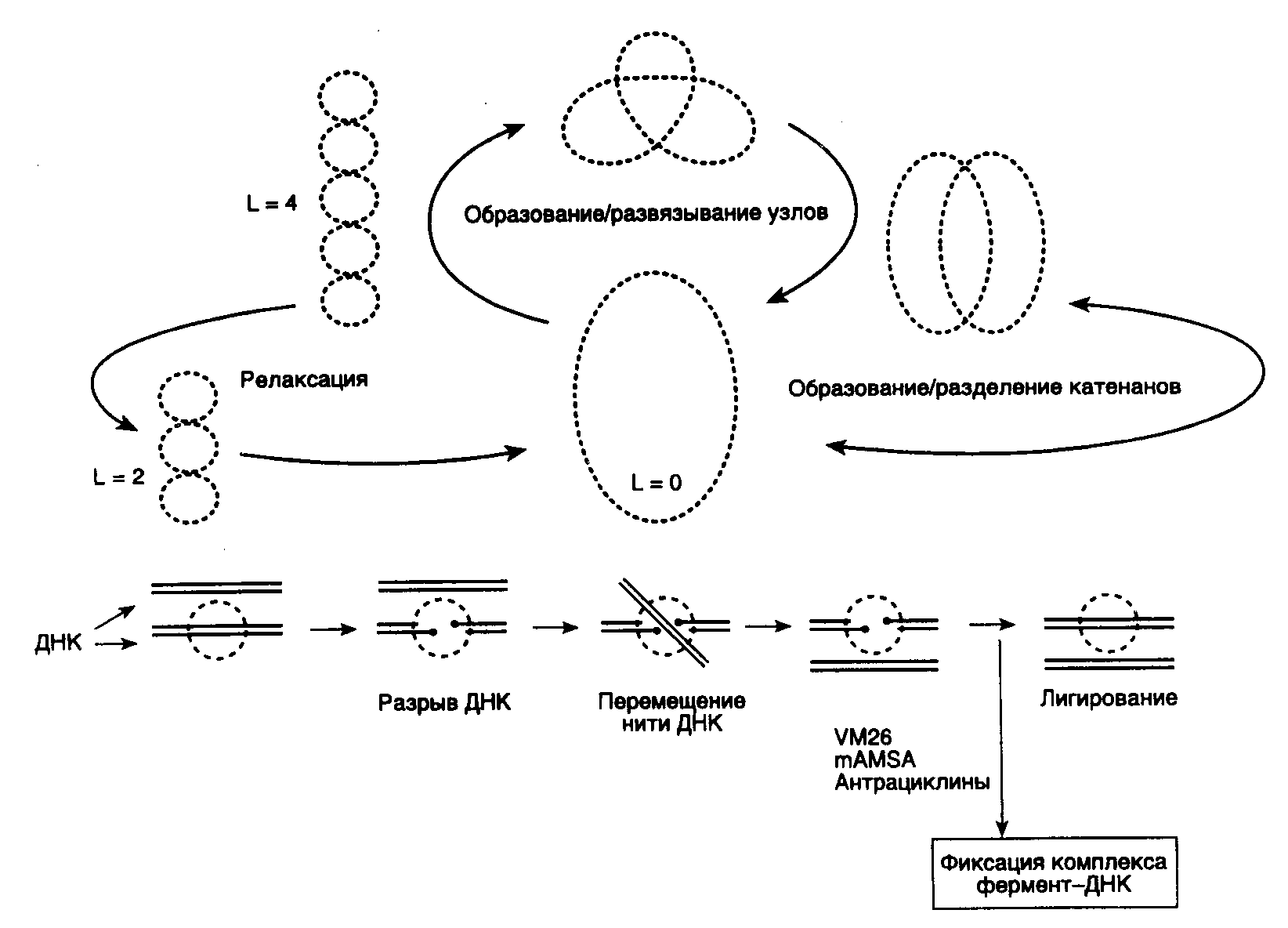
Рис. I.3. Основные этапы каталитического цикла топоизомеразы II
Внизу изображен механизм переноса нити ДНК через двухцепочечный разрыв. Точками отмечены места ковалентного присоединения фермента к 5'-концам ДНК в двухцепочечных разрывах. VM26, mAMSA, антрациклины – ингибиторы топоизомеразы II, фиксирующие ковалентный комплекс фермент-ДНК и предотвращающие лигирование двухцепочечного разрыва; L – число зацеплений ДНК в суперскрученной молекуле.
релаксируют ДНК без затраты энергии путем внесения одноцепочечных разрывов. В отличие от этого, ДНК-топоизомеразы II функционируют в виде димеров, осуществляя ATP-зависимое расщепление обеих цепей ДНК с последующим переносом цепей через разрыв и его лигированием (рис. I.3).
Для внесения одноцепочечного разрыва в ДНК все ДНК-топоизомеразы используют остаток Tyr, который осуществляет нуклеофильную атаку фосфатной группы ДНК с образованием фосфотирозина. В результате ферменты оказываются ковалентно связанными с 5'- или 3'-концами ДНК в одноцепочечном разрыве. Образование такой ковалентной связи исключает необходимость затраты энергии при восстановлении фосфодиэфирной связи в одноцепочечном разрыве на заключительных стадиях реакции. У ДНК-топоизомераз типа I имеется один каталитический остаток Tyr на молекулу мономерного белка, тогда как димеры ДНК-топоизомераз II содержат по одному каталитическому остатку на каждую субъединицу, что обеспечивает создание ступенчатого двухцепочечного разрыва в молекуле релаксируемой ДНК.
Обнаружены, по крайней мере, два подтипа ДНК-топоизомераз I – IA и IB, которые, будучи неродственными ферментами как по первичной, так и по пространственной структурам, выполняют аналогичные функции с помощью различных механизмов. До недавнего времени ДНК-топоизомеразы IA считали исключительно прокариотическими ферментами, однако они были найдены и в клетках эукариот, включая клетки человека, и названы ДНК-топоизомеразами III.
ДНК-топоизомераза IA релаксирует ДНК, содержащие только отрицательные супервитки, работает в присутствии ионов Mg2+ и ковалентно соединяется с 5'-концами ДНК в образующихся врéменных одноцепочечных разрывах. Это сближает ДНК-топоизомеразы IA и II между собой, что было подтверждено также структурными исследованиями. В отличие от этого, ДНК-топоизомеразы IB способны релаксировать ДНК как с положительными, так и отрицательными супервитками, не требуют для своего функционирования ионов металлов и взаимодействует ковалентно с 3'-концами ДНК. ДНК-топоизомеразы IB найдены исключительно в клетках эукариот (за единственным исключением вируса вакцины).
В клетках человека ДНК-топоизомераза IB/III специфически ингибируется камптотецином (camptothecin), который в настоящее время рассматривается в качестве перспективного противоопухолевого препарата. Это соединение взаимодействует преимущественно с ковалентным комплексом топоизомераза I–ДНК, что подавляет реакцию восстановления фосфодиэфирной связи и освобождение фермента из комплекса. В результате происходит быстрое накопление двухцепочечных разрывов ДНК и вступление клеток в апоптоз.
ДНК-топоизомераза II является жизненно важным ферментом любого эукариотического организма. Кроме релаксации суперскрученных молекул ДНК она может осуществлять образование или развязывание узлов, а также образование или разделение катенанов (кольцевых замкнутых ДНК, сцепленных друг с другом). Реакции развязывания узлов и разделения катенанов являются прерогативой именно ДНК-топоизомеразы II и не выполняются ДНК-топоизомеразами I.
У дрожжей ДНК-топоизомераза II требуется для разделения катенанов сестринских хроматид хромосом в анафазе митоза и абсолютно необходима для сегрегации хромосом в мейозе, а также конденсации хроматина в процессе формирования метафазных хромосом. Выяснена важная роль ДНК-топоизомеразы II и в формировании высших уровней структуры хроматина, а именно участие фермента в образовании петель хроматина во время конденсации хромосом.
ДНК-топоизомераза II локализована в ядре и в больших количествах ассоциируется с ДНК как в интерфазных, так и метафазных ядрах. С помощью специфических антител показано, что молекулы фермента располагаются преимущественно вдоль центральной продольной оси обоих плеч хромосом у многих организмов. Такое аксиальное распределение ДНК-топоизомеразы II в хромосомах наблюдали даже после удаления из них большей части гистонов в результате многократных солевых экстракций. Специфическая локализация этого фермента в хромосомах очень показательна в свете обсуждавшихся выше петельно-доменных особенностей организации хроматина в ядрах. Создается впечатление, что ДНК-топоизомераза II находится в виде гомодимера в основании петель, взаимодействуя с MAR/SAR-последовательностями ДНК хроматина. Хотя топоизомераза II не обнаруживает строгой специфичности в отношении расщепляемых последовательностей нуклеотидов, на выбор сайтов большое влияние оказывают структурные компоненты хроматина. Показано, что in vivo существуют два класса сайтов, по которым происходит расщепление ДНК этим ферментом: одни из них локализованы в активно транскрибируемых участках хроматина, гиперчувствительных к действию нуклеаз, а другие – непосредственно в MAR/SAR-последовательностях. Ассоциация ДНК-топоизомеразы II с активно транскрибируемыми участками хроматина указывает на ее возможную важную роль в регуляции экспрессии генов, что и было продемонстрировано в недавних экспериментах. Таким образом, ДНК-топоизомераза II является одним из ключевых ферментов, необходимых для разрешения сложных топологических проблем, возникающих при изменении структуры хроматина в процессах репликации ДНК, транскрипции генов и сегрегации хромосом в митозе и мейозе. Определенные изоформы ( или ) этого фермента, по-видимому, играют важную роль в поддержании динамической структуры хроматина интерфазных и митотических хромосом.
Имеющиеся в настоящее время данные свидетельствуют о высокоупорядоченной организации генома у любого, особенно эукариотического, организма. Первым уровнем такой упорядоченности является консервативное линейное распределение генов и других последовательностей нуклеотидов вдоль молекул ДНК хромосом, которое служит важным таксономическим признаком. Другим не менее жизненно важным свойством генома эукариот и, по-видимому, таксономическим признаком является его упорядоченное распределение в объеме интерфазных ядер. Высокоспецифическое пространственное распределение хроматина эукариот в интерфазных ядрах можно рассматривать в качестве второго уровня его упорядоченности. Находясь в деконденсированном состоянии после завершения митоза, интерфазные хромосомы не перемешиваются внутри интерфазных ядер, но занимают вполне определенные микрокомпартменты. Определенные участки хромосом, маркированные специфическими (в частности MAR/SAR) последовательностями, служат для прикрепления ДНК хромосом к компонентам ядерного матрикса и ядерных мембран. Такие контакты необходимы для эффективной реализации генетической информации в процессе экспрессии генов, эффективной конденсации хроматина и разделения хромосом в митозе и мейозе. Кроме того, пространственно организованное распределение генетического материала в интерфазных ядрах обеспечивает дифференциальную защиту от мутаций отдельных генетических локусов и, по-видимому, может контролировать темп и направление эволюционных изменений как отдельных локусов, так и организмов в целом (подробнее см. раздел 5.3). К сожалению, исследование пространственной организации генома в интерфазных ядрах (архитектоники ядра) сопряжено с большими методическими трудностями и сегодня еще только начинается.
|
|
|
 Скачать 5.83 Mb.
Скачать 5.83 Mb.

