Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фактор | Структура | Молекулярная масса полипептидов, кДа | Функция |
| P-TEFb | Гетеродимер | 124, 43 | Препятствует прекращению элонгации, ингибируется DRB |
| SII (TFIIS) | Мономер | 38 | Препятствует прекращению элонгации, стимулирует расщепление транскрипта |
| TFIIF | Гетеродимер | 30, 70 | Устраняет задержку элонгации РНК |
| Элонгин (SIII) | Гетеротример, включающий элонгины A, B и С | | Та же |
| Элонгин А | | 110 | Активная субъединица |
| Элонгин В | | 18 | Регуляторная субъединица |
| Элонгин С | | 15 | Та же |
| ELL | | 80 | Устраняет задержку элонгации РНК |
| | |||
| Примечание. DRB – 5,6-дихлоро-1--D-рибофуранозилбензимидазол | |||
выделенного в гомогенном состоянии из экстрактов Drosophila, подавляется нуклеотидным аналогом – DRB. Фенотипическим проявлением действия этого ингибитора является общее подавление синтеза гяРНК в ядрах вследствие резкого повышения частоты перехода элонгирующего комплекса в состояние полного прекращения транскрипции вблизи промоторов. DRB не подавляет элонгацию цепей РНК в бесклеточных системах транскрипции, реконструированных из высокоочищенных компонентов, что дало основание предполагать наличие дополнительных факторов, которые контролируют процесс перехода комплексов РНК-полимеразы II в фазу элонгации и чувствительны к действию этого ингибитора. Фактор P-TEFb оказался белком, обладающим именно такими свойствами. Механизм действия P-TEFb, благодаря которому этот фактор препятствует прекращению транскрипции РНК-полимеразой II, неизвестен. Предполагают, что он может быть связан с фосфорилированием РНК-полимеразы II или сопутствующих факторов транскрипции.
Небольшой белковый фактор SII, впервые выделенный из клеток асцитной опухоли Эрлиха, обеспечивает преодоление РНК-полимеразой II препятствий в виде нуклеопротеиновых комплексов или специфических последовательностей ДНК, вызывающих преждевременное прекращение транскрипции в кодирующих частях генов. Однако он не оказывает влияния на РНК-полимеразу, прекратившую элонгацию в DRB-чувствительной фазе. Фактор SII стимулирует эндонуклеазное отщепление 3’-концевой части транскрипта в комплексе, прекратившем элонгацию, что дает возможность РНК-полимеразе II продолжить элонгацию цепи РНК. Активный сайт РНК-полимеразы, обладающий такой эндонуклеазной активностью, ингибируется -аманитином – специфическим ингибитором РНК-полимеразы II эукариот. Клетки дрожжей, у которых фактор SII инактивирован под действием мутаций, обладают повышенной чувствительностью к 6-азаурацилу и микофеноловой кислоте, которые, как известно, ингибируют биосинтез нуклеотидов, понижая внутриклеточное содержание GTP и UTP. Это, в свою очередь, оказывает сильное влияние на эффективность элонгации РНК РНК-полимеразой II в мутантных клетках.
Другая группа основных факторов элонгации супрессирует задержку элонгации цепей РНК, тем самым уменьшая вероятность перехода элонгирующих комплексов в состояние полного прекращения элонгации. Эту группу составляют три структурно неродственных белка: факторы TFIIF, элонгин (SIII) и ELL, которые, по-видимому, взаимодействуют непосредственно с компонентами тройного элонгирующего комплекса. Ни один из этих белков не способен реактивировать комплексы, полностью прекратившие транскрипцию, или стимулировать расщепление РНК в этих комплексах. Точный механизм супрессирующего действия данных факторов на задержку элонгации неизвестен. Недавно было установлено, что и элонгин, и фактор TFIIF резко повышают способность РНК-полимеразы II осуществлять зависимое от матрицы присоединение рибонуклеозидтрифосфатов к 3’-OH-концам фрагментов ДНК, которые в этом случае выполняют функцию праймеров. Предполагают, что роль элонгина и фактора TFIIF может заключаться в обеспечении правильного расположения в активном центре элонгирующего фермента 3’-OH-концов растущих транскриптов. Фактор TFIIF занимает особое место среди других основных факторов транскрипции, поскольку только он обладает способностью контролировать активность РНК-полимеразы II как на стадии инициации транскрипции, так и в фазе элонгации. При этом способность этого фактора оказывать действие на инициацию транскрипции или элонгацию контролируется разными доменами его полипептидных цепей.
Элонгин (SIII) впервые был выделен из ядер печени крыс в виде белкового комплекса, состоящего из трех субъединиц A, B и C с молекулярными массами 150, 18 и 15 кДа соответственно. Транскрипционная активность элонгина (SIII) целиком ассоциирована с его A-субъединицей, а две другие служат регуляторными и после образования стабильного димера оказывают сильное стимулирующее действие на транскрипционную активность A-субъединицы. Собственно стимулятором активности элонгина А является элонгин C, тогда как элонгин B, гомологичный убиквитину, не взаимодействует стабильно с элонгином А в отсутствие элонгина С и выполняет шапероноподобную функцию при сборке всего комплекса элонгина (SIII). На особую роль элонгина (SIII) в регуляции экспрессии генов указывает тот факт, что у человека он известен как потенциальная мишень действия продукта антионкогена (гена-супрессора опухолей) von Hippel–Lindau (VHL), мутации в котором ассоциированы с возникновением многих видов рака у человека. Белок VHL специфически взаимодействует с комплексом элонгина BC, препятствуя его связыванию с элонгином А. При этом мутации в антионкогене, сопровождающие онкологические заболевания, уменьшают прочность взаимодействия мутантного белка с элонгином BC.
Ген фактора элонгации ELL (eleven–nineteen lysine-rich leukemia) человека, локализованный на хромосоме 19 (19p13.1), первоначально был обнаружен в связи с его частыми транслокациями в ген MLL (mixed lineage leukemia) на хромосому 11 (11q23) при острых миелоидных лейкозах. Предполагают, что продукт гена MLL участвует в регуляции транскрипции гомеозисных генов. В результате транслокации образуется "онкоген", кодирующий гибридный белок, который образован почти полным полипептидом ELL, объединенным с N-концевой частью белка MLL. Роль белка ELL в развитии лейкозов неясна, поскольку в настоящее время обнаружены шесть других генов, претерпевающих транслокацию в то же самое место на хромосоме 11, которые ассоциированы с лейкозами с различными клиническими проявлениями, характер которых зависит от природы транслоцируемого гена.
Терминация транскрипции. Прекращение синтеза РНК под действием РНК-полимеразы и освобождение РНК из транскрипционного комплекса происходят в конце транскрипционных единиц на особых участках ДНК - терминаторах транскрипции. Терминаторы транскрипции, функционирующие с разной эффективностью, могут находиться и внутри транскриптонов. Такие терминаторы являются мощными факторами, регулирующими уровень транскрипции (и других этапов экспрессии) соответствующих генов. Для осуществления терминации транскрипции на некоторых терминаторах РНК-полимеразам не требуется дополнительных белковых факторов, тогда как другие терминаторы в их отсутствие не функционируют.
Терминация транскрипции у бактерий. Типичные терминаторы, не требующие для своего распознавания РНК-полимеразой E. coli дополнительных белковых факторов, содержат GC-богатый участок, обладающий центральной симметрией, вслед за которым располагается последовательность нуклеотидов, состоящая из выстроенных подряд четырех–восьми остатков A, в матричной цепи ДНК. Транскрипция завершается на конце этой олиго(A)-последовательности или же на следующем за ней нуклеотиде. Предполагается, что после прохождения РНК-полимеразой GC-богатого участка ДНК с центральной симметрией в этом месте РНК образуется шпилька, что приводит к разрушению ДНК–РНК-гибрида в транскрибирующем комплексе.
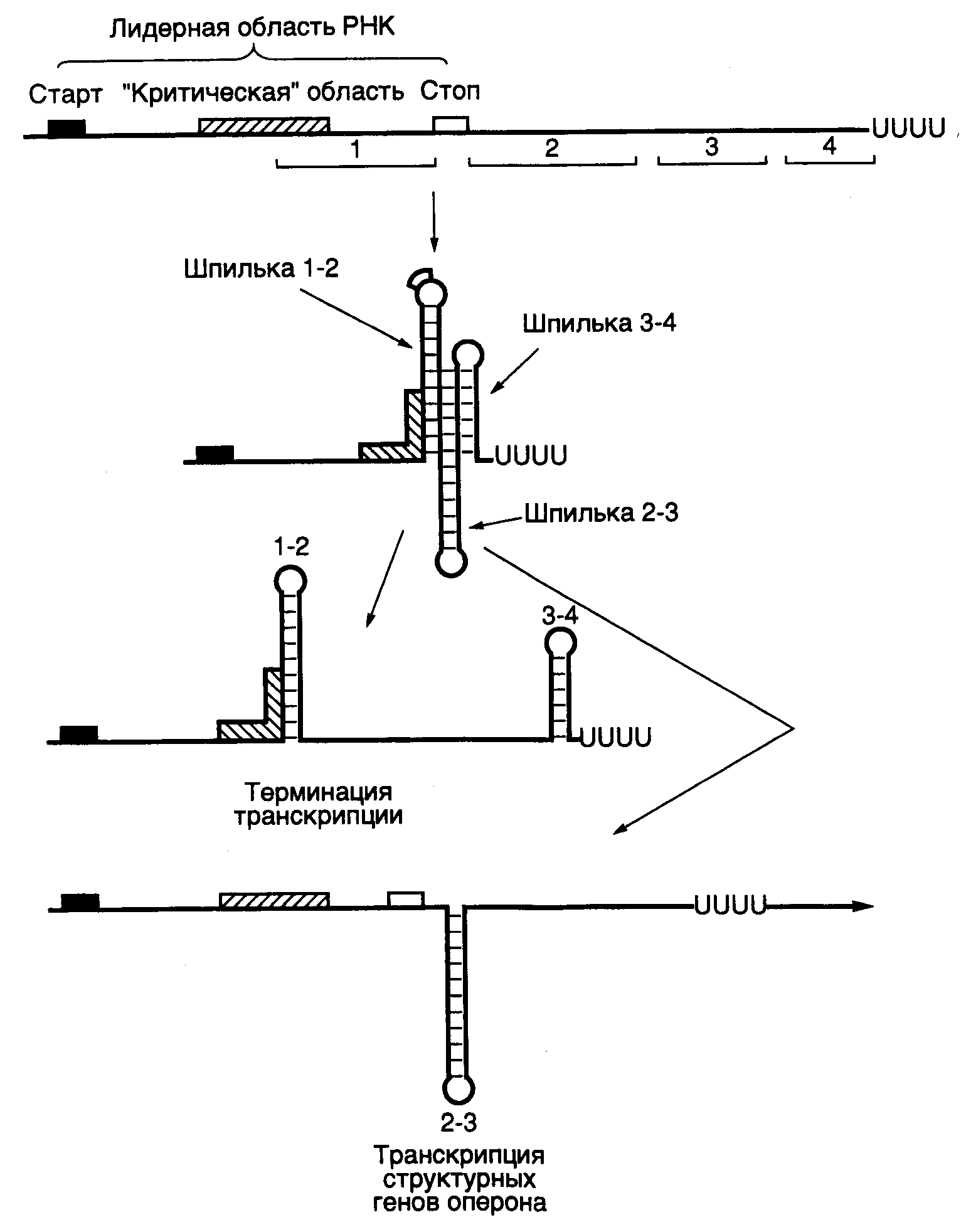
Рис. I.9. Аттенюатор триптофанового оперона E. coli и его функционирование
Изображены альтернативные вторичные структуры мРНК в районе аттенюатора, образование которых сопровождается прекращением транскрипции или распространением в область структурных генов оперона
Оставшаяся часть ДНК–РНК-гибрида нестабильна и легко плавится, поскольку образована 3’-концевой олиго(U)-последовательностью РНК и олиго(dA)-последовательностью терминатора. Первым из комплекса освобождается РНК-продукт, а затем минимальный фермент РНК-полимеразы. После объединения со свободным -фактором образовавшийся холофермент РНК-полимеразы вступает в новый цикл транскрипции. Эффективность терминации транскрипции на таком терминаторе зависит от стабильности терминаторной шпильки РНК: мутации, нарушающие комплементарное спаривание оснований в шпильке, ослабляют терминацию, а мутации, восстанавливающие комплементарность, ее усиливают.
Кроме вышеописанного, у E. coli обнаружены терминаторы транскрипции, распознаваемые РНК-полимеразой только в присутствии белкового фактора терминации , механизм действия которого хорошо изучен. Этот белок с молекулярной массой 46 кДа обладает РНК-зависимой нуклеозидтрифосфатазной активностью, которая необходима для его функционирования при терминации. Кроме того, для него характерна РНК:ДНК-хеликазная активность. Установлено, что фактор связывается с растущей цепью РНК в особых неструктурированных участках, называемых рат-сайтами (rut sites, от англ. rut – колея, выбоина), до того, как РНК-полимераза достигает терминатора. В местах -зависимой терминации транскрипции РНК-полимераза прекращает элонгацию. Считается, что роль -фактора заключается в вытеснении РНК из транскрипционного комплекса во время таких пауз.
E. coliи другие бактерии имеют еще один тип регулируемых терминаторов транскрипции, называемых аттенюаторами. Впервые обнаружен и лучше других изучен аттенюатор триптофанового оперона, контролирующего биосинтез Trp в бактериальных клетках (см. рис. I.9). В условиях избытка внутриклеточного Trp девять из десяти молекул РНК-полимеразы, начавших транскрипцию триптофанового оперона, прекращают синтез РНК на аттенюаторе, расположенном на расстоянии в 180 п.о. от точки инициации транскрипции. В результате в основном происходит синтез коротких РНК той же длины, называемых лидерными. При уменьшении содержания Trp в клетках доля молекул РНК-полимеразы, преодолевающих аттенюатор, возрастает, что, в конечном счете, сопровождается увеличением внутриклеточного содержания ферментов биосинтеза Trp. Перед аттенюатором находятся несколько участков ДНК, последовательности которых обладают центральной симметрией. Это приводит к тому, что лидерная РНК, включающая в себя последовательности, комплементарные таким участкам, способна образовывать структуры типа шпилек в разных сочетаниях, которые исключают друг друга. Например, если получена шпилька 2/3, то шпильки 1/2 и 3/4 сформироваться уже не могут. К аналогичным результатам приводит и обратное развитие событий. Шпилька 3/4 является терминаторной, присутствующей в -независимых терминаторах. За ней в лидерной РНК располагается последовательность олиго(U). Поэтому образование шпильки 3/4 сопровождается терминацией транскрипции на аттенюаторе и освобождением лидерной РНК из транскрипционного комплекса. Формирование альтернативных шпилек зависит от положения рибосом, транслирующих лидерную РНК с образованием лидерного пептида, в котором присутствуют два остатка Trp подряд. В условиях недостатка Trp рибосома в процессе синтеза лидерного пептида останавливается на соответствующих кодонах лидерной РНК, прикрывая собой последовательность 1, что препятствует формированию шпильки 1/2, так как образуется шпилька 2/3. В соответствии с этим терминаторная шпилька не может сформироваться, транскрипция не прерывается на аттенюаторе и РНК-полимераза переходит в область структурных генов оперона. Если недостаток триптофана не приводит к прекращению трансляции лидерной РНК, рибосома проходит критический участок лидерной РНК, препятствуя формированию шпильки 2/3, и образуется терминаторная шпилька 3/4, что сопровождается терминацией транскрипции на аттенюаторе.
Терминация транскрипции у эукариот. У эукариот обнаружены три фактора терминации транскрипции, необходимых для освобождения РНК-полимераз из транскрипционных комплексов на терминаторах – по одному для РНК-полимераз I, II и III. Белок N-TEF дрозофилы индуцирует освобождение транскриптов, синтезированных РНК-полимеразой II, и при его функционировании происходит расщепление ATP. У дрожжей белковый фактор Reb-1 связывается с природными терминаторами транскрипции на ДНК, обеспечивая как остановку элонгирующей РНК-полимеразы I на этих терминаторах, так и последующее освобождение РНК из транскрипционных комплексов. Удаление в результате делеции из рибосомной транскрипционной единицы Reb-1-связывающего сайта нарушает правильное образование 3’-концов рРНК in vivo. Мышиный фактор TTF-1, который также является ДНК-связывающим белком, необходим для правильной терминации транскрипции РНК-полимеразой I в клетках этих животных. У них же обнаружен LА-белок, специфически взаимодействующий с РНК, функционирование которого требуется для образования транскриптов полной длины под действием РНК-полимеразы III, что происходит в результате освобождения РНК из транскрипционных комплексов и реинициации транскрипции.
Рассмотрим подробнее механизм терминации транскрипции Pol I. У мышей терминация транскрипции рДНК происходит на 565 п.о. ниже кодирующей части гена 28S РНК. 3'-Конец терминирующего транскрипта картирован за 21 п.о. перед 18-нуклеотидным повтором, названным Sal-боксом (AGGTCGACCAGA/TT/ANTCCG), который входит в состав терминатора транскрипции. Десять таких повторов, фланкированных протяженными кластерами пиримидиновых оснований, локализованы в нетранскрибируемых спейсерах рДНК. У человека длина повтора составляет 11 п.о. (GGGTCGACCAG), и его последовательность соответствует таковой 5'-концевой части мышиного повтора. Последовательности, фланкирующие повторы, оказывают влияние на точность и эффективность терминации транскрипции, а функционирование всего терминатора зависит от его ориентации на ДНК.
С помощью мутационного анализа и футпринтинга было установлено, что фактор терминации транскрипции TTF-I взаимодействует с Sal-боксом и останавливает элонгирующую Pol I. Хотя все факторы терминации транскрипции, обсуждавшиеся выше, распознают разные последовательности нуклеотидов, для них характерно наличие в C-концевых частях двух ДНК-связывающих доменов длиной в 80 аминокислот каждый, гомологичных ДНК-связывающей последовательности онкобелка c-Myb. Хотя более половины полипептидной цепи с N-конца TTF-I могут быть удалены без потери его функций, одних лишь ДНК-связывающих доменов недостаточно для обеспечения белком терминации транскрипции, и для этого требуются прилегающие последовательности аминокислот. Факторы терминации транскрипции TTF-I мышей и Rib-1 дрожжей могут прекращать элонгацию цепей РНК на любой из этих ДНК. Это указывает на высокую эволюционную консервативность механизма терминации транскрипции Pol I.
Связываясь с последовательностями терминаторов, TTF-I изгибает молекулу ДНК и вызывает задержку элонгирующего транскрипционного комплекса на терминаторе. Предполагается, что в этот момент происходит конформационное изменение молекулы Pol I, что ослабляет взаимодействие компонентов комплекса друг с другом (как это имеет место в случае РНК-полимеразы E. coli на ρ-независимых терминаторах транскрипции). Окончательный распад комплекса и освобождение Pol I, а также синтезированной молекулы РНК происходит лишь в присутствии дополнительного фактора PTRF (polymerase and transcript release factor), который контактирует как с Pol I, так и с TTF-I.
Функциональная роль фактора TTF-I не ограничивается лишь участием в терминации транскрипции. Один из терминаторов транскрипции рДНК, так называемый To, расположен за 170 п.о. перед точкой инициации транскрипции генов рРНК. Взаимодействующий с To фактор TTF-I сильно стимулирует транскрипцию генов рРНК, вызывая перестройку структуры хроматина в окрестностях соответствующего промотора. Об изменениях структуры хроматина во время транскрипции см. следующий раздел 2.1.4.
Хотя для каждой из форм РНК-полимераз обнаружен свой специфический белковый фактор, необходимый для правильного освобождения транскриптов из элонгирующих комплексов, этим не ограничиваются механизмы, обеспечивающие терминацию транскрипции у эукариот. Действительно, одним из основных факторов терминации транскрипции у этой группы организмов является сложный белковый комплекс, обеспечивающий процессинг 3’-концевых последовательностей у предшественников мРНК, синтезируемых РНК-полимеразой II (см. ниже). В этом случае терминация транскрипции тесно сопряжена с процессингом пре-мРНК пока неизвестным молекулярным механизмом.
Терминация транскрипции митохондриальных ДНК человека, так же как и терминация синтеза рРНК, требует участия специального белкового фактора. В этом случае фактор mtTERM может ускорять терминацию транскрипции in vivo митохондриальной РНК-полимеразой, а также ферментами бактериального и фагового происхождения. В отличие от терминаторов генов рРНК, митохондриальные сигналы терминации транскрипции в комплексе с фактором mtTERM распознаются молекулами РНК-полимераз в обеих ориентациях, что делает возможной терминацию транскрипции на H- и L-цепях мтДНК. Вследствие этого один общий терминатор может обеспечивать сбалансированное образование продуктов транскрипции с обоих противоположно направленных митохондриальных промоторов.
2.1.4.Хроматин во время транскрипции
В эукариотических клетках матрицей для РНК-полимераз служит ДНК, находящаяся в составе хроматина. Из общих соображений белки нуклеосом и более высокоорганизованного хроматина должны быть препятствием для образования инициационного комплекса и перемещения транскрипционного комплекса вдоль такой матрицы. Однако in vivo эти препятствия в соответствующих условиях легко преодолеваются. Исследование транскрипции хроматина в настоящее время еще далеко от своего завершения, а основные результаты получены в опытах in vitro. Тем не менее, в последнее время, благодаря взаимно дополняющим друг друга биохимическим и генетическим данным, становятся более ясными основные механизмы, обеспечивающие этот повсеместно распространенный процесс. Результаты такого рода исследований показывают, что наличие нуклеосом предотвращает неспецифическую транскрипцию инактивированных генов и является одним из необходимых условий их правильной экспрессии. Рассмотрим ряд современных моделей, в которых делается попытка объяснения таких механизмов.
Нуклеосомы и инициация транскрипции. Результаты многочисленных биохимических и генетических экспериментов показывают, что присутствие нуклеосом в промоторных участках генов, как правило, ингибирует транскрипцию. В частности,, установлено, что пространственное расположение последовательностей нуклеотидов в двух витках ДНК, намотанной вокруг гистонового октамера нуклеосомы, несовместимо со сборкой стабильного инициационного комплекса. Следовательно, для образования функционально активного инициационного комплекса, в состав которого входят РНК-полимераза и факторы транскрипции, необходимо локальное разрушение нуклеосомной структуры хроматина в окрестностях промотора и регуляторных элементов. При этом реализуются две стратегии: непрерывное существование участка ДНК в виде свободной от нуклеосом последовательности нуклеотидов и индуцированное разрушение нуклеосом. Первый механизм функционирует на промоторах конститутивно транскрибируемых эукариотических генов и обеспечивается белковыми факторами, которые разрушают имеющуюся нуклеосомную структуру данного участка ДНК или препятствуют ее образованию. Описаны, по крайней мере, три способа осуществления этого механизма: 1) факторы транскрипции успевают взаимодействовать с реплицируемой ДНК до сборки нуклеосом; 2) факторы связываются с соответствующими участками ДНК, содержащими нуклеосомы, и их дестабилизируют; 3) специализированные белки разрушают нуклеосомную структуру в области промоторов неэкспрессирующихся генов. Все эти механизмы могут функционировать как по отдельности, так и в различных сочетаниях.
Вновь синтезируемая эукариотическая ДНК обладает повышенной чувствительностью к нуклеазам, что указывает на ее более "открытую" структуру по сравнению со структурой в сформированном хроматине интерфазных ядер. Это может отражать наличие промежуточных стадий в сборке нуклеосом или формировании структур хроматина более высокого порядка. Считается, что сборка нуклеосом в реплицирующейся ДНК происходит в два этапа. Вначале гистоны H3 и H4 доставляются к ДНК с помощью фактора сборки хроматина CAF-I (chromatin assembly factor I), состоящего из трех субъединиц с молекулярными массами 150, 60 и 50 кДа. Вновь синтезируемые гистоны H3 и H4 связываются первыми двумя субъединицами, из которых полипептид с молекулярной массой 150 кДа обладает сильно заряженным доменом, а другой содержит в своем составе WD-повтор (где W и D – аминокислоты Trp и Asn в соответствии с однобуквенным обозначением). На втором этапе к строящимся нуклеосомам добавляются гистоны H2A и H2B, что завершает формирование кóровых частиц нуклеосом. Исследования in vitro показали, что тетрамеры H3/H4 не исключают взаимодействия факторов транскрипции с соответствующими участками ДНК, как это делают зрелые нуклеосомы. С другой стороны, нуклеоплазмин, связывающий димеры H2A/H2B, стимулирует взаимодействие различных факторов с нуклеосомами (например GAL4, USF или Sp1). Кроме того, незрелый хроматин характеризуется пониженным содержанием линкерного гистона H1, присутствие которого стабилизирует нуклеосомы и структуры хроматина высшего порядка.
Конкурентные отношения между активацией транскрипции и созреванием хроматина во время клеточного цикла были продемонстрированы in vivo для дрожжевых генов, локализованных вблизи теломерных участков хромосом. У таких генов может иметь место мозаичный эффект положения (см. раздел 3.2.4). Например, транслокация гена Ura3 в область теломеры часто подавляет его транскрипцию, которая может быть возобновлена под действием белка-трансактиватора транскрипции Ppr1, но только в фазе G2/M клеточного цикла. Именно в это время происходит полное созревание вновь образуемого хроматина у большинства эукариотических организмов. Однажды установившись, активированное или репрессированное состояние гена вблизи теломерных участков хромосом поддерживается на протяжении многих клеточных делений. Эти эксперименты показывают, что во время сборки хроматина имеется возможность перепрограммирования компетентности генов в отношении транскрипции и регуляторная структура хроматина является наследуемой в ряду клеточных поколений.
Промоторы, активируемые через разрушение нуклеосомной структуры непосредственно факторами транскрипции, характерны для генов теплового шока дрозофилы. В поддержании открытой структуры ДНК в этом случае участвуют основные факторы транскрипции, а также GAGA-фактор, которые взаимодействуют с промотором в окрестностях TATA-бокса и точки инициации транскрипции. Такое взаимодействие обеспечивает открытое состояние вышерасположенного регуляторного элемента теплового шока. При индуцированном механизме разрушения нуклеосомной структуры ДНК в окрестностях промотора перед активацией гена нуклеосомы присутствуют как в вышерасположенных регуляторных последовательностях ДНК, так и в самом промоторе. Во время индукции транскрипции такого гена регуляторные факторы, связываясь с ДНК, прямо или косвенно вызывают разрушение нуклеосомной структуры соответствующих участков ДНК. Аналогичная стратегия активации промоторов реализуется также и в генах, регулируемых глюкокортикоидами. Для активации промоторов, структурированных в нуклеосомы, требуется несколько этапов. Вначале регуляторные факторы, структура которых более подробно обсуждается в разделе 3.2.2, взаимодействуют своими ДНК-связывающими доменами с соответствующей регуляторной последовательностью, расположенной выше промотора, что сопровождается вытеснением части или всех гистонов нуклеосом этой последовательности. Активирующие домены белковых факторов транскрипции далее индуцируют освобождение гистонов с основного промотора, что сопровождается образованием инициационного комплекса с участием РНК-полимеразы и основных факторов транскрипции. Сборка транскрипционного комплекса приводит к вытеснению еще одной порции гистонов с промотора.
Модификация структуры нуклеосом через ацетилирование гистонов.Рассмотренный пример показывает, что не только ДНК-связывающие домены факторов транскрипции адаптируют структуру хроматина для нужд синтеза РНК, но и их активирующие домены участвуют в разрушении структуры нуклеосом, расположенных на ДНК вблизи мест связывания факторов. Активирующие домены таких факторов взаимодействуют не только с основными факторами транскрипции, такими как TFIID, но и с коактиваторами транскрипции, которые не входят в состав основного транскрипционного комплекса, хотя и обеспечивают его функциональную связь с удаленными регуляторными последовательностями энхансеров и сайленсеров (подробнее см. раздел 3.2.2). До недавнего времени оставалось совершенно непонятным, каким образом активирующие домены факторов транскрипции могут оказывать влияние на структуру близлежащего хроматина. Этот вопрос начал проясняться после недавнего клонирования генов ядерных и цитоплазматических ацетилаз гистонов (HAT – histone acetyltransferase) и изучения свойств этих ферментов в очищенном состоянии.
Ацетилирование гистонов происходит на посттрансляционном уровне по специфическим остаткам Lys в N-концевых частях их полипептидных цепей, которые расположены на поверхности нуклеосомных частиц (см. табл. I.2). Эта посттрансляционная модификация уменьшает суммарный положительный заряд кóровых частиц нуклеосом и ослабляет взаимодействие плеч гистонов с ДНК. Хотя при этом сохраняется общая структурная целостность нуклеосом, их конформация может изменяться, что ингибирует in vitro зависимое от ионной силы образование структур хроматина более высокого порядка, связанное с подавлением транскрипции. Кроме того, ацетилирование гистонов нарушает специфические взаимодействия между их плечами и некоторыми регуляторными белками-репрессорами. В соответствии с этим, уже давно была обнаружена корреляция между повышенным уровнем ацетилирования гистонов и усилением транскрипции определенных участков генома, а пониженный уровень ацетилирования гистонов был связан с молчащими генами и гетерохроматином. Однако оставался непонятным механизм избирательного ацетилирования гистонов на промоторах активируемых генов.
Ацетилазы гистонов эукариот разделяют на две основные группы – HAT A и HAT B. Для ацетилаз HAT A характерна ядерная локализация. Эта группа ферментов участвует в посттрансляционном ацетилировании гистонов кóровых частиц нуклеосом и оказывает прямое влияние на транскрипцию. Цитоплазматические ацетилазы HAT B преимущественно модифицируют молекулы гистонов, находящиеся в свободном состоянии, и участвуют в их доставке к реплицируемой ДНК. Для этих двух систем ацетилирования характерна разная субстратная специфичность. Если ацетилазы HAT A ацетилируют все четыре гистона кóровых частиц нуклеосом, то ацетилазы HAT B модифицируют, прежде всего, гистоны H3 и H4 по другим остаткам Lys.
Дрожжевая цитоплазматическая ацетилаза гистонов типа В, кодируемая геном HAT1, по-видимому, обеспечивает направленную доставку вновь синтезированных гистонов в ядра, где характер их ацетилирования может быть изменен ядерной ацетилазой HAT A. Последовательность нуклеотидов клонированного гена ацетилазы HAT A Tetrahymenaнеожиданно оказалась высокогомологичной последовательности гена известного коактиватора транскрипции дрожжей GCN5, продукт которого (Gcn5), как выяснилось, также обладает активностью ацетилазы гистонов. Эта находка явилась первым указанием на то, что ацетилирование гистонов может быть одной из причин, а не следствием активации генов. Белок Gcn5 образует тримерный комплекс с двумя другими белками – Ada2 и Ada3, которые необходимы для активации генов кислыми факторами транскрипции Gal4–Vр16 и Gen4. При этом комплекс Gcn5–Ada2–Ada3 образует прямые контакты и с транс-действующими, и с основными факторами транскрипции в составе транскрипционного комплекса. Это позволяет объяснить механизм направленной доставки ацетилазы гистонов к активируемому промотору соответствующими специфическими белок-белковыми взаимодействиями. Интересной находкой этой серии экспериментов явилось понимание двойной роли комплекса Gcn5–Ada в активации транскрипции. Во-первых, он ацетилирует гистоны нуклеосом промотора, что повышает его доступность для основных факторов транскрипции и других регуляторных белков. Во-вторых, он непосредственно контактирует с этими факторами, облегчая образование прединициационного комплекса и стабилизируя его.
Таким образом, индивидуальные факторы транскрипции могут выполнять несколько разных функций в регуляции синтеза РНК, определяемых их выраженной доменной структурой. Как уже упоминалось, для полипептидных цепей большинства факторов транскрипции характерно наличие, по крайней мере, ДНК-связывающего и активирующего доменов. Из вышеизложенного следует, что ДНК-связывающие домены этих белков могут непосредственно изменять структуру нуклеосом в окрестностях промоторов, а активирующие домены не только контактируют с основными факторами транскрипции и стабилизируют их связь с промоторами, но и ассоциированы с активностями, модифицирующими структуру хроматина, что необходимо для эффективной инициации транскрипции и освобождения промотора элонгирующим транскрипционным комплексом. И все эти активности у дрожжей присущи одному сравнительно небольшому белковому комплексу Gcn5–Ada.
Деацетилазы гистонов. Стационарный уровень ацетилирования гистонов хроматина поддерживается в результате координированного действия HAT и деацетилаз гистонов (histone deacetylase – Hd), наиболее изученными из которых являются деацетилазы гистонов дрожжей, дрозофилы и человека. Быстрая очистка деацетилаз достигается с помощью аффинной хроматографии, в которой используется в качестве лиганда иммобилизованный высокоаффинный ингибитор трапоксин. При этом деацетилазы гистонов дрожжей выделяются в виде двух высокомолекулярных комплексов - HdA (350 кДа) и HdB (600 кДа). HdA может деацетилировать все четыре гистона и сильно ингибируется трихостатином А, тогда как HdB в 10 раз менее чувствительна к действию этого ингибитора. Очищенная HdA содержит в своем составе четыре полипептида, два из которых с молекулярными массами 75 и 71 кДа кодируются генами HDA1 и HDA3 соответственно. Деацетилаза HdB содержит в своем составе белок Rpd3, функционирование которого, как это было показано генетическими методами, необходимо для достижения не только полного подавления, но и полной активации экспрессии большого числа генов. В состав деацетилазы HdA входит Rpd3-подобный белок; такие белки представлены у дрожжей целым семейством, насчитывающим, по крайней мере, четыре члена. Инактивация деацетилаз HdA и HdB с помощью делеций в соответствующих генах приводит к гиперацетилированию гистонов H3 и H4 in vivo.
Как уже упоминалось, гиперацетилирование гистонов, как правило, коррелирует с активацией транскрипции определенных генетических локусов. Однако повышенный уровень ацетилирования гистонов может сопровождаться подавлением экспрессии генов, локализованных в теломерных участках хромосом дрожжей. Аналогичную ситуацию наблюдали у дрозофилы: инактивация гомологичного гена деацетилазы приводила к усилению эффекта положения гена white, транслоцированного в область центромерного гетерохроматина. Эти странные эффекты могут быть связаны с нарушением специфичности ацетилирования гистонов в условиях их гиперацетилирования при инактивации генов деацетилаз. Действительно, для подавления транскрипции у дрожжей необходимо ацетилирование единственного аминокислотного остатка (Lys-12 в гистоне H4). Кроме того, те же гистоны, ацетилированные по тому же самому положению, были обнаружены в транскрипционно неактивном -гетерохроматине политенных хромосом дрозофилы.
Как и в случае ацетилаз гистонов, специфический характер действия деацетилаз обеспечивается путем образования комплексов с белками-репрессорами и корепрессорами, которые распознают конкретные последовательности ДНК и друг друга. Ядерные рецепторы тиреоидных гормонов особенно хорошо иллюстрируют функционирование такого механизма. В отсутствие лиганда они взаимодействуют с комплексом репрессор–деацетилаза, что приводит к подавлению транскрипции соответствующих генов, тогда как под действием гормона рецепторы приобретают способность образовывать комплекс с коактиватором транскрипции и ацетилазой и стимулировать синтез РНК.
Другие специализированные белки, изменяющие структуру хроматина. В дополнение к вышеупомянутым белкам в настоящее время выделены и охарактеризованы два других специфических белковых комплекса, обеспечивающих изменение структуры нуклеосом во время транскрипции. Комплекс Swi/Snf был впервые обнаружен в клетках дрожжей генетическими методами как позитивный регулятор транскрипции большого числа генов, экспрессия которых контролируется разными механизмами. Похожий по механизму действия комплекс NURF (nucleosome remodeling
Таблица I.6
Субъединичный состав и свойства белковых комплексов Swi/Snf и NURF
-
Фактор
Субъединицы
Общая
молекулярная масса,
кДа
Активность
Swi/Snf
Swi1
Swi2 (Snf2)
Swi3
Snf3
Snf5
Snf6
p78
p68
p50
p47
p25
2000
ДНК-зависимая АТРаза
NURF
215 кДа
140 кДа
55 кДа
38 кДа
500
АТРаза, зависимая от нуклеосом
factor) был выделен из эмбрионов дрозофилы (табл. I.6).
Оба комплекса состоят из нескольких субъединиц, обладают ATPазной активностью и оказывают влияние на контакты между гистонами и ДНК. Однако для этих комплексов характерно отсутствие общих компонентов, и они различаются по механизмам стимуляции ATPаз. Такие различия между комплексами позволяют предполагать, что они действуют на разные субстраты и могут функционировать независимо друг от друга.
Первые указания на то, что факторы Swi/Snf участвуют в изменении структуры хроматина, были получены генетическими методами. Индивидуальные мутации swi или SNF, ингибирующие экспрессию ряда генов, супрессировались мутациями, повышающими внутриклеточный уровень гистонов. Комплексы Swi/Snf, выделенные из клеток дрожжей и человека, содержали, по крайней мере, десять различных белков. Первые шесть компонентов, перечисленные в табл. I.6, были идентифицированы как продукты конкретных генов, тогда как другие (p78–p25) – только как полипептиды указанной молекулярной массы. Комплекс Swi/Snf стимулирует in vitro ATP-зависимое связывание нуклеосомами транс-действующих факторов транскрипции. Мутационные изменения консервативных участков гистонов H3 и H4, необходимых для формирования у них правильной пространственной структуры, делают транскрипцию независимой от фактора Swi/Snf in vivo.
Недавно комплекс Swi/Snf удалось выделить в составе холофермента РНК-полимеразы II, так что этот комплекс может оказаться неотъемлемой частью транскрибирующего фермента и присутствовать в инициационных комплексах всех промоторов. Однако в таком случае остается не совсем понятным, почему мутации в генах SWI/SNF оказывают влияние на экспрессию лишь некоторых генов. Поскольку белки Swi/Snf ассоциированы с медиаторным комплексом, который, в свою очередь, связан с CTD-доменом РНК-полимеразы II и обеспечивает ответ РНК-полимеразы на действие регуляторных факторов, последние могут по-разному реагировать на присутствие в комплексе мутантных белков Swi/Snf, что и может быть причиной дифференциального ответа конкретных промоторов на мутации.
Белковый комплекс NURF впервые был описан как кофактор уже упоминавшегося выше фактора транскрипции GAGA, который необходим для активации промотора гена теплового шока дрозофилы hsp70. In vivo в этом промоторе была обнаружена последовательность длиной в 200–300 нуклеотидов с повышенной чувствительностью к ДНКазе, в состав которой входят TATA-бокс и сайты связывания факторов GAGA и HSF (heat shock factor – фактор теплового шока). Гиперчувствительность промотора к действию ДНКазы можно было моделировать в бесклеточных экстрактах как до, так и после сборки хроматина путем добавления GAGA-фактора и ATP. Поскольку фактор GAGA сам по себе не обладает ATPазной активностью, в результате очистки белков с этой активностью и был идентифицирован комплекс NURF. Этот комплекс может разрушать нуклеосомы или изменять их положение в промоторе гена HSP70 и в отсутствие фактора GAGA. Однако присутствие NURF стимулирует связывание этого фактора со своим сайтом на промоторе, что, в свою очередь, ускоряет перестройку нуклеосом в этом участке гена. ATPазная активность NURF не стимулируется свободной ДНК или гистонами, однако усиливается в присутствии интактных нуклеосом, что отличает этот фермент от ATPазы Swi2. При микросеквенировании пептида с молекулярной массой 140 кДа в нем был обнаружен ATPазный домен, гомологичный таковому Swi2, однако это оказалось единственной гомологией между двумя комплексами. Следует еще раз подчеркнуть, что отсутствие у них общих субъединиц и существенной гомологии указывает на возможность независимого функционирования этих комплексов и действия на разные субстраты.
Специфичность функционирования ATP-зависимых белковых комплексов, изменяющих структуру нуклеосом, предполагает их точную доставку в нужные места хроматина. Как и в уже рассмотренном случае ацетилаз и деацетилаз гистонов, специфический характер взаимодействия комплексов с ДНК обеспечивается дополнительными белками. Выше упоминалось о том , что комплекс Swi/Snf входит в состав холофермента РНК-полимеразы II, что обеспечивает его доставку к соответствующим промоторным последовательностям. Кроме того, было показано, что этот комплекс может взаимодействовать с рецептором глюкокортикоидов и в таком виде оказывать влияние на структуру нуклеосом. Формирование таких комплексов, по-видимому, является одним из существенных моментов активации рецепторов глюкокортикоидов. Учитывая обсуждавшееся выше взаимодействие рецепторов стероидных гормонов с ацетилазами/деацетилазами гистонов, можно полагать, что специфическое изменение структуры хроматина является общим механизмом, посредством которого рецепторы оказывают влияние на экспрессию соответствующих генов.
Нуклеосомы при элонгации синтезируемой РНК.Механизмы, обеспечивающие элонгацию транскрипции на нативном хроматине, не совсем понятны. Поскольку РНК-полимеразы прокариот, в частности фагов SP6 и T7, обладают способностью транскрибировать хроматин in vitro, создавалось впечатление, что для прохождения РНК-полимеразами нуклеосом хроматина во время элонгации РНК не требуются дополнительные факторы. Тем не менее, нуклеосомы ингибируют транскрипцию хроматина in vitro на стадии элонгации эукариотическими РНК-полимеразами II и III, что не наблюдается in vivo. Одной из гипотез, объясняющих процесс элонгации транскрипции на хроматине, является модель двойных суперскрученных доменов. В соответствии с этой моделью предполагается, что транскрибирующая РНК-полимераза индуцирует в ДНК образование локальных суперскрученных доменов. Положительные супервитки образуются впереди элонгирующей РНК-полимеразы, а отрицательные – позади фермента. Закручивание ДНК вокруг гистонового октамера в нуклеосоме приводит к незначительным изменениям в параметрах двойной спирали ДНК и к образованию одного отрицательного супервитка в молекуле ДНК. Его формирование должно приводить к компенсаторной положительной сверхспирализации участков ДНК, прилегающих к нуклеосоме. Образование нуклеосом осуществляется предпочтительно на отрицательно сверхспирализованной ДНК, а ее положительная сверхспирализация сопровождается ослаблением структуры нуклеосом или их разрушением в присутствии дополнительных белковых факторов. Эти факты и лежат в основе обсуждаемой модели.
Таким образом, в соответствии с этой моделью, элонгирующая РНК-полимераза индуцирует впереди себя локальную положительную сверхспирализацию молекулы ДНК, что облегчает разрушение нуклеосом, находящихся в этой зоне. Повторное образование нуклеосом происходит в зоне отрицательно сверхспирализованной ДНК позади транскрибирующей РНК-полимеразы.
Конвергентный характер исследований функциональной структуры хроматина и транскрипции лишь иллюстрирует общую тенденцию развития современной молекулярной биологии и генетики. Чем глубже становится понимание механизмов функционирования отдельных генетических систем клетки, тем яснее видится их взаимозависимость и полифункциональность. Высокоупорядоченные перестройки нуклеосом и хроматина сопровождают не только транскрипцию, но и репликацию, рекомбинацию и репарацию повреждений ДНК. В связи с этим проблема структуры хроматина и динамики ее изменений в клеточном цикле является одной из центральных в современной молекулярной генетике.
Концепция транскриптосомы. Как было показано выше, транскрипционный комплекс, в состав которого входит эукариотическая РНК-полимераза II, устроен весьма сложно. Появляется все больше данных в пользу того, что транскрипционный комплекс взаимодействует с другими крупными белковыми комплексами, участвующими, в частности, в разрушении нуклеосом и репарации ДНК. Полный размер образующегося при этом стабильного транскрипционного комплекса, содержащего более 70 полипептидов, приближается к размеру рибосомы. Такой колоссальный размер транскрипционного комплекса эукариот, вероятно, должен замедлять поиск путем линейной диффузии регуляторных последовательностей нуклеотидов транскрибируемой ДНК, на которых происходит инициация транскрипции. Обсуждается возможность того, что инициация транскрипции у эукариот осуществляется в специализированных надмолекулярных комплексах, специфически ассоциированных с ядерным матриксом, которые получили название транскриптосом. По крайней мере, один из белковых компонентов, входящих в состав холофермента POL II животных, YY1, оказался идентичным фактору NMP-1, ассоциированному с ядерным матриксом. Возможно, именно с участием этого белка происходит прикрепление транскриптосом к ядерным мембранам.
Подводя итог рассмотрению основных этапов транскрипции, необходимо отметить, что инициация синтеза РНК, элонгация транскриптов и терминация транскрипции являются очень сложно организованными процессами. Структуры матричной ДНК и растущих цепей РНК оказывают влияние на процесс освобождения промотора РНК-полимеразами, а также на свойства самих элонгирующих и терминирующих ферментов. При этом на инициацию, задержку и прекращение транскрипции, расщепление РНК и ее реитеративный синтез, а также на саму терминацию оказывают действие многочисленные белковые факторы. Все это находит свое выражение в сложности регуляторных процессов, обеспечивающих координированную экспрессию генов на уровне транскрипции. Основные биохимические механизмы, контролирующие эти процессы, будут рассмотрены в соответствующих разделах книги.
