Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
2.2.3.Другие модификации эукариотических мРНКПосттранскрипционные модификации предшественников эукариотических мРНК по сравнению с теми же изменениями первичных транскриптов прокариот более разнообразны и играют большую роль в регуляции экспрессии их генов. Почти все эти реакции происходят в ядре эукариотических клеток в процессе синтеза РНК или сразу же после его завершения. Прежде всего, к 5’-концевому нуклеотиду большинства пре-мРНК присоединяются кэп-группы, что сопровождается метилированием одного или нескольких концевых нуклеотидов, в большинстве случаев необходимым для стабилизации и экспорта соответствующих мРНК из ядра в цитоплазму, а также их эффективной трансляции рибосомами. В основном те же функции, по-видимому, выполняет и полиаденилирование 3’-концевых последовательностей мРНК, которые подготавливаются к этому этапу путем специфического отщепления избыточных 3’-концевых нуклеотидов предшественника. Кроме того, интроны, содержащиеся в гигантских первичных предшественниках мРНК, с высокой точностью удаляются в результате сплайсинга. Ниже будут рассмотрены механизмы перечисленных посттранскрипционных модификаций пре-мРНК эукариот. Об использовании этих реакций в регуляции экспрессии генов на посттранскрипционном уровне речь пойдет в разделе 3.3. Кэпирование. Сразу же после инициации транскрипции чаще всего происходит котранскрипционная модификация 5’-конца мРНК, сопровождаемая присоединением так называемой кэп-группы и дальнейшими ее изменениями. Кэпирование является одной из самых ранних модификаций растущих цепей РНК и происходит после полимеризации ее первых 20–30 нуклеотидов. Такая котранскрипционная модификация мРНК не только стабилизирует мРНК в 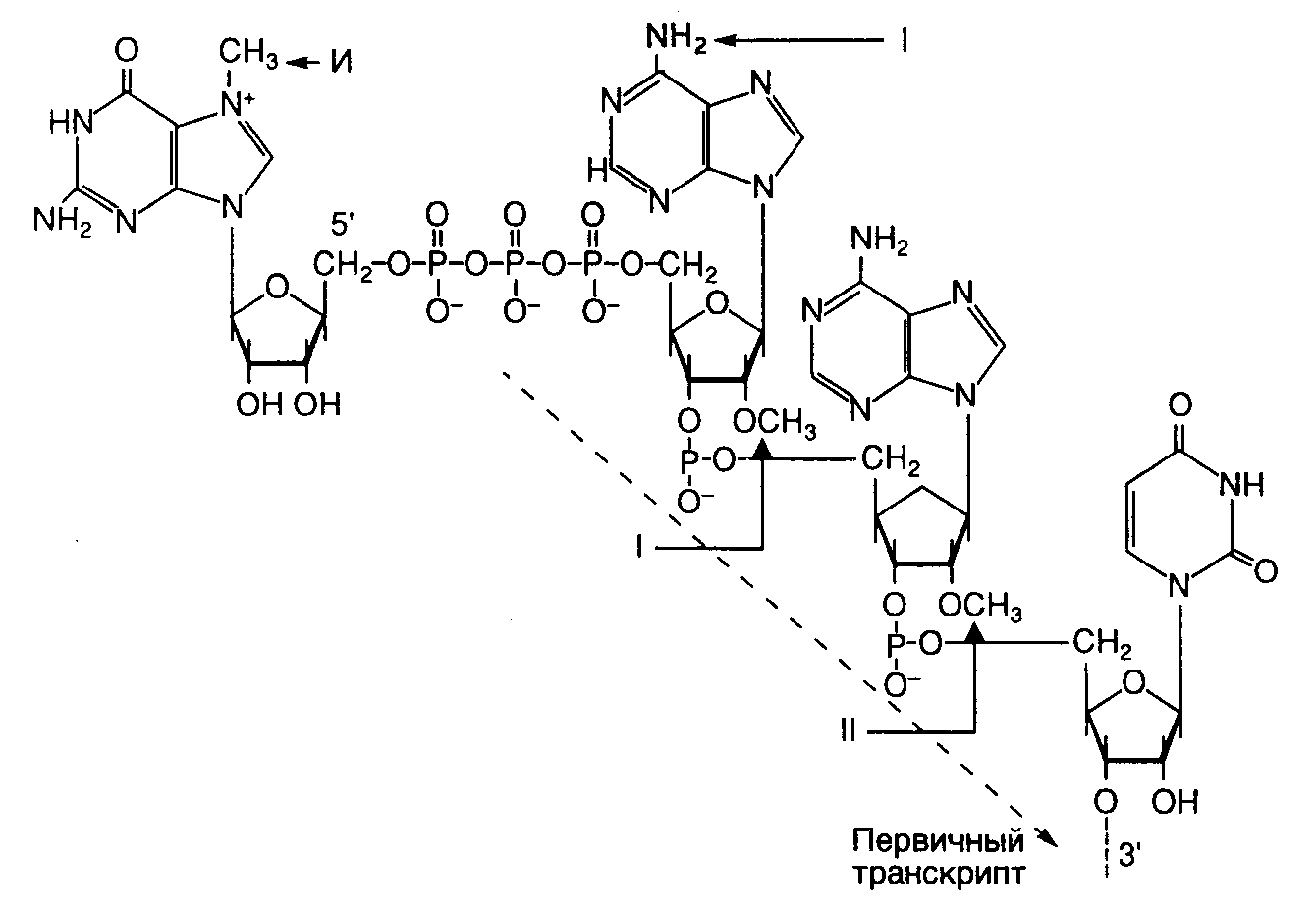 Рис. I.12. Обобщенная структура кэп-группы эукариотических мРНК Указаны сайты метилирования, характерные для кэп-групп разных типов. И – инвариантный сайт, метилируемый у кэп-групп всех типов, I, II – сайты, метилируемые у кэп-групп типов 1 и 2 соответственно цитоплазме, но и необходима в большинстве случаев для ее эффективной трансляции. Так, один из факторов инициации трансляции eIF-4E выполняет функции кэп-связывающего белка и требуется для осуществления кэп-зависимой трансляции мРНК. Кроме того, установлено, что кэпирование мРНК необходимо для эффективного сплайсинга пре-мРНК, ее полиаденилирования и экспорта из ядра в цитоплазму. Кэпированию подвергаются только транскрипты РНК-полимеразы II. На исключительную значимость реакций кэпирования указывает и тот факт, что контролирующие их гены являются жизненно важными. Как уже упоминалось выше, транскрипция у эукариот и прокариот начинается, как правило, с пуринового рибонуклеозидтрифосфата – ATP, или GTP, причем трифосфатная группа сохраняется в составе мРНК. Таким образом, 5’-концевая последовательность мРНК в ядре на ранних этапах транскрипции представлена в следующем виде: ppp(A/G)pNpNpN... Гуанилилтрансфераза катализирует присоединение к растущей цепи мРНК молекулы GMP, которая оказывается связанной с 5’-концевым пурином 5’–5’-трифосфатной группой. Суммарная реакция первого этапа процесса кэпирования выглядит следующим образом: G(5’)ppp + ppp(5’)(A/G)pNpNpN... Гуанилилтрансфераза G(5’)ppp(5’)(A/G)pNpNpN... + pp + p Реакция, по-видимому, протекает в две стадии. Вначале фермент связывает молекулу GTP (входящую затем в состав кэп-группы), что сопровождается отщеплением пирофосфата и образованием ковалентной связи фермент–GMP. Далее GMP присоединяется к 5’-концу мРНК, которая в результате теряет -фосфатную группу. В результате нуклеотид кэп-группы оказывается в обратной ориентации по отношению к остальным нуклеотидам мРНК. Процесс создания кэп-группы этой последовательностью реакций не заканчивается. На заключительных этапах кэпирования происходит метилирование по N7 ранее присоединенной молекулы гуанозина. Такие посттранскрипционные модификации происходят в несколько стадий в цитоплазме клеток после транспорта процессированной мРНК из ядра с участием цитоплазматических ферментов. Первая стадия метилирования осуществляется ферментом РНК(гуанил-7)-метилтрансферазой, которая переносит метильную группу S-аденозилметионина в положение 7 концевого гуанина кэп-группы (рис. I.12). Кэп-группа, метилированная лишь по этому положению, характерна для одноклеточных эукариот и получила название кэпа 0-го типа. Вслед за этим у большинства многоклеточных эукариот происходит метилирование 2’-ОН рибозы 5’-концевого инициаторного нуклеотида (A или G), который является первым нуклеотидом, включаемым в мРНК при инициации ее синтеза РНК-полимеразой. Метилирование катализирует другой цитоплазматический фермент – 2’-О-метилтрансфераза. Такая основная форма кэпа большинства эукариот получила название кэпа 1-го типа. Очень редко и только у тех мРНК, инициация синтеза которых происходит с ATP, под действием 2’-О-метиладенозин-N6-трансферазы метилируются NH2-группы этого остатка А. Фермент распознает данную концевую группу в качестве субстрата лишь в том случае, если она была предварительно метилирована в положении 2’-OH в результате вышеописанной реакции. 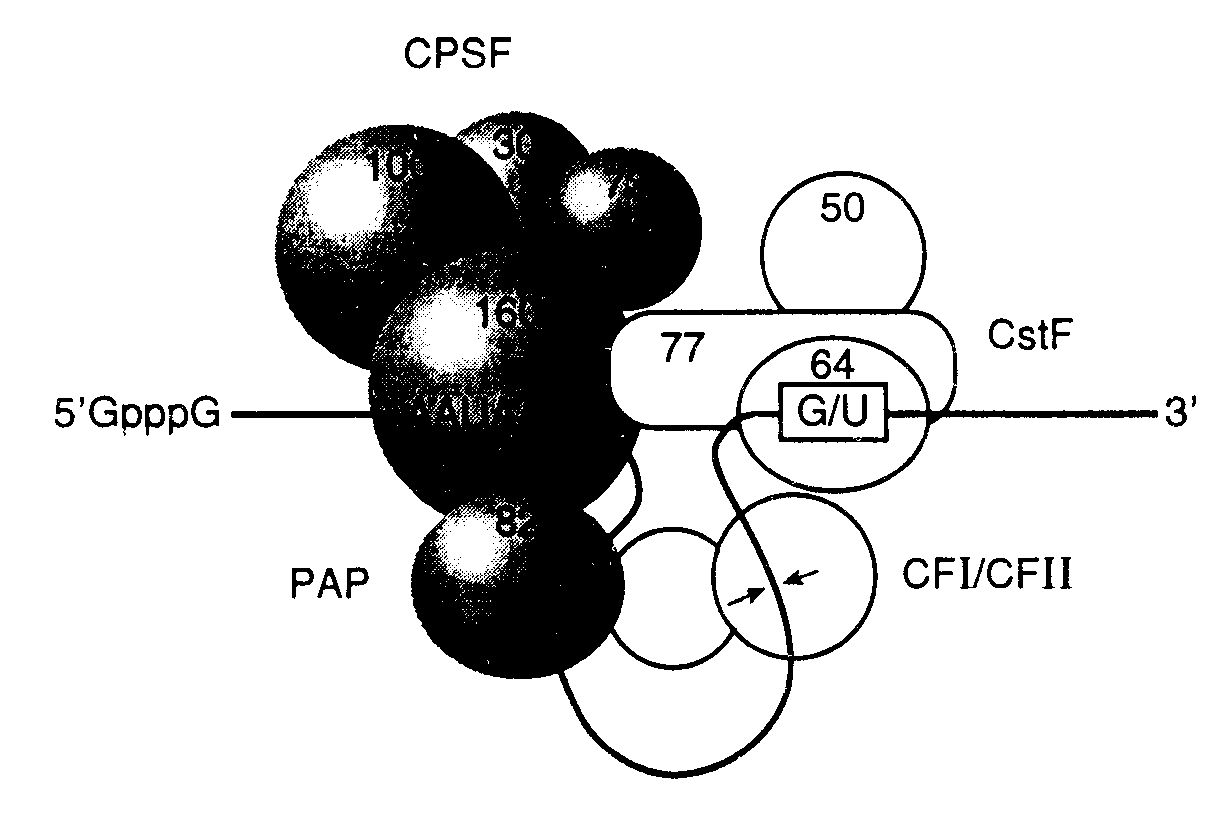 Рис. I.13. Модель процессинга 3-концевых последовательностей эукариотических пре-мРНК Цифрами указаны молекулярные массы белков, входящих в состав процессирующего комплекса. Обозначены кэп-группа, последовательность поли(А)-сайта и регуляторная последовательность, с которой взаимодействует гетеродимерный фактор, стимулирующий расщепление (CstF). Стрелки указывают место расщепления РНК PAP – поли(А)-полимераза, CPSF – фактор специфичности и расщепления РНК, CF I и CF II – факторы расщепления I и II У некоторых видов эукариот метильная группа может дополнительно присоединяться ко второму от кэп-нуклеотида нуклеозиду мРНК (см. рис. I.12). Субстратом для этого фермента служит мРНК с кэпом 1-го типа, уже содержащим две метильные группы. В результате происходит метилирование остатка рибозы по 2’-ОН-группе с образованием структуры, получившей название кэпа 2-го типа. Если эта реакция имеет место, то мРНК, содержащие кэп 2-го типа, составляют 10–15% от общей популяции молекул кэпированных мРНК. Иная структура кэп-группы характерна для некоторых зрелых некодирующих РНК, в частности малых ядерных РНК, обогащенных урацилом (U-мяРНК). В этом случае остаток гуанозина кэп-группы дважды метилирован в положении 2 в дополнение к обычной метильной группе в положении 7: m2,2,7G(5')ppp(5')N. Такое гиперметилирование U-мяРНК требуется для импорта собранных U-мяРНП-частиц в ядро и, возможно, предотвращает вовлечение U-мяРНК в трансляцию. Полиаденилирование. Одним из обязательных этапов созревания предшественников эукариотических мРНК, синтезированных в ядре, является процессинг их 3’-концевых последовательностей, тесно сопряженный с присоединением кэп-группы. Созревание 3'-конца мРНК является двухэтапным процессом. Вначале предшественник теряет 3’-концевую некодирующую последовательность, после чего, как правило, к 3’-концу присоединяется поли(А)-последовательность путем ферментативной полимеризации остатков AMP: 5’ GpppG__________AAUAAA__________UUUUU___ 3’ Расщепление 5’ GpppG__________AAUAAA__OH P____UUUUU___ 3’ Полиаденилирование 5’ GpppG__________AAUAAA__AAAAAAAAAAAAAAA 3’ В настоящее время известно несколько исключений из этого правила: гистоновые мРНК животных и мРНК некоторых вирусов, предшественники которых расщепляются с помощью высокоспецифических эндонуклеаз и не полиаденилируются. Остаются неполиаденилированными и U-мяРНК, которые также являются транскриптами РНК-полимеразы II. В этом случае кэпированный первичный транскрипт мяРНК U1, содержащий на своем 3'-конце несколько избыточных нуклеотидов, экспортируется из ядра в цитоплазму, где и происходит удаление избыточной последовательности, которое в ядре блокировано специфическим белковым ингибитором TPI (3'-terminal processing inhibitor). 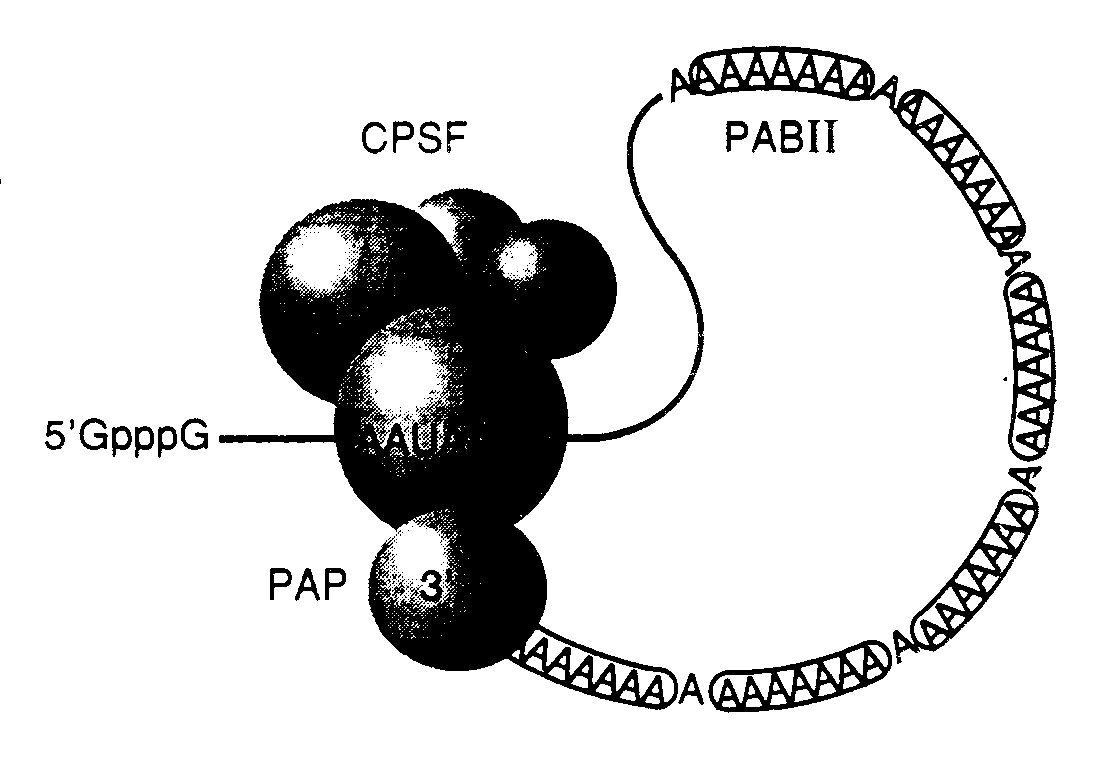 Рис. I.14. Модель белкового комплекса, элонгирующего поли(А) PAP – поли(А)-полимераза, PAB II – поли(А)-связывающий белок II Места отщепления 3’-концевых некодирующих последовательностей в мРНК животных обычно маркированы специальными последовательностями нуклеотидов (рис. I.13). Имеются, по крайней мере, две такие последовательности, образующие сайты полиаденилирования, или поли(А)-сайты. Одна из них – AAUAAA расположена за 15 нуклеотидов перед расщепляемой фосфодиэфирной связью и практически одинакова у всех исследованных организмов. Другая, менее изученная последовательность располагается сразу же за первой и часто состоит из нескольких остатков U или обогащена GU. Сайт расщепления РНК определяется расстоянием между этими двумя элементами с предпочтительным расщеплением фосфодиэфирной связи на 3’-конце остатка A, находящегося на участке, в котором расщепление разрешено. Имеются данные о том, что последовательности, расположенные выше AAUAAA, могут оказывать стимулирующее влияние на процессинг, но их присутствие необязательно для его правильного осуществления. С последовательностью AAUAAA взаимодействует фактор CPSF (cleavage and polyadenylation specificity factor), определяющий специфичность расщепления и полиаденилирования РНК. CPSF состоит из четырех субъединиц с молекулярными массами 160, 100, 70 и 30 кДа. Последняя из них, по-видимому, не является необходимой для его функционирования. Самая большая субъединица находится в непосредственном контакте с последовательностью AAUAAA. С GU-богатой и ниже расположенной последовательностью связывается гетеродимерный белковый фактор CstF (cleavage stimulating factor), стимулирующий расщепление и состоящий из трех субъединиц (77, 64 и 50 кДа). Вторая субъединица контактирует с GU-богатым регуляторным элементом и обладает типичным РНК-связывающим доменом. По отдельности факторы CPSF и CstF лишь слабо взаимодействуют с РНК. Однако их одновременное присутствие приводит к образованию прочного комплекса. Такой кооперативный эффект и взаимодействие двух факторов между собой определяются их большими субъединицами. В расщеплении РНК непосредственно участвуют еще два фактора: CFI и CFII (cleavage factors). Как и в предыдущем случае, лишь вместе они образуют прочный комплекс с РНК. Для полного реконструирования бесклеточной системы, осуществляющей процессинг 3’-концов in vitro, в ней помимо вышеупомянутых факторов необходимо наличие поли(А)-полимеразы – фермента, непосредственно осуществляющего полиаденилирование. Присутствие этого фермента требуется не для самого акта расщепления РНК, а, по-видимому, для стабилизации процессирующего белкового комплекса, схематически изображенного на рис. I.13. Сборка такого сложного комплекса зависит от ATP, однако в процессе сборки не происходит расщепления ее –-связей. В настоящее время неизвестно, какой именно компонент этого комплекса непосредственно расщепляет фосфодиэфирные связи РНК. Процесс полиаденилирования начинается сразу же за расщеплением РНК и происходит настолько быстро, что неполиаденилированных промежуточных продуктов не обнаруживается. Такое сопряжение двух реакций необходимо для защиты 3’-концевых последовательностей РНК от деградации нуклеазами. При этом сам акт полиаденилирования требует наличия только фактора CPSF, но не трех других: CstF, CFI и CFII. Поли(A)-полимераза животных состоит из двух субъединиц с молекулярными массами 80 и 43 кДа, которые образуются в результате альтернативного сплайсинга их общей пре-мРНК. Короткий полипептид не обладает ферментативной активностью, и его функции неизвестны. Большая полипептидная цепь содержит С-концевой домен, обогащенный Ser и Thr и не определяющий ни одну из функций фермента, обнаруживаемых in vitro. Предполагают, что регуляторную роль играет множественное фосфорилирование этого домена. С-Концевой домен также содержит один из двух сигнальных последовательностей, необходимых для транспорта фермента в ядро. Вторая сигнальная аминокислотная последовательность локализована на границе С-концевого домена и основного полипептида поли(A)-полимеразы. Сравнительное исследование первичной структуры поли(А)-полимеразы показало наличие в ее полипептидной цепи каталитического домена, характерного для полимераз так называемого семейства X, к которому относятся ДНК-полимераза , терминальная трансфераза, а также некоторые другие нуклеотидилтрансферазы. Используя 3’-конец расщепленной РНК в качестве затравки, поли(А)-полимераза последовательно присоединяет к нему остатки AMP из ATP по тому же самому механизму, что и другие ДНК- и РНК-полимеразы. Для эффективного функционирования поли(A)-полимераза требует наличия фактора CPSF, а также поли(A)-связывающего белка PAB II (poly(A)-binding protein II), который связывает полиаденилирующий комплекс с РНК после присоединения к ней, по крайней мере, десяти остатков А. В присутствии этих двух факторов поли(А)-полимераза сразу синтезирует поли(А)-последовательность полной длины по процессивному механизму. Гипотетическая структура элонгирующего комплекса представлена на рис. I.14. Процессивное (непрерывное) полиаденилирование 3’-концов РНК происходит со скоростью 25 нуклеотидов/с до тех пор, пока длина поли(А)-последовательности не достигнет 250 нуклеотидов. После этого процессивная реакция прекращается, и происходит медленное дистрибутивное присоединение остатков AMP разными молекулами поли(А)-полимеразы. Предполагают, что элонгирующий белковый комплекс узнает длину синтезированной поли(А)-последовательности при участии фактора PAB II (см. рис. I.14). По этому механизму связывание определенного числа молекул PAB II с поли(А) прекращает элонгацию поли(А)-последовательности. Такой строгий контроль за длиной поли(А) на 3’-концах процессированных мРНК имеет большое значение для действия механизма, контролирующего время полужизни мРНК в цитоплазме. Без тщательного контроля над этим процессом с помощью селективного деаденилирования невозможно регулировать внутриклеточную деградацию мРНК, а вместе с тем и уровень экспрессии соответствующих генов с участием данного механизма. Полиаденилирование является универсальным феноменом, играющим важную роль в процессинге и функционировании мРНК как прокариотических, так и эукариотических организмов. Однако сравнение механизмов полиаденилирования у этих групп организмов выявляет существенные различия, суммированные в табл. I.9. Н. Саркаром (1997 г.) было высказано предположение о возникновении механизма полиаденилирования РНК. Он полагает, что поскольку у бактериальных и эукариотических ферментов, выполняющих аналогичные функции, не обнаружено гомологии в аминокислотных последовательностях, оба фермента возникли недавно из уже значительно дивергировавших функционально родственных предшественников. Такими предшественниками могли быть прокариотические и эукариотические тРНК-нуклеотидилтрансферазы, осуществляющие посттранскрипционный синтез последовательности CCA на 3’-концах тРНК, что по своему механизму близко к полиаденилированию. Подтверждением этого является обнаруженная значительная гомология между тРНК-нуклеотидилтрансферазой и основной поли(А)-полимеразой E. coli, а также между тРНК-нуклеотидилтрансферазой бактерии Sulfolobus shibatae, обитающей вгорячих серных источниках, и поли(А)-полимеразами эукариот. Следы такой эволюционной связи обнаруживаются и в современных митохондриях, где в результате полиаденилирования мРНК могут создаваться терминирующие кодоны. По мнению Саркара, различия между системами полиаденилирования прокариот и эукариот, представленные в табл. I.9, можно рассматривать в качестве продукта эволюционной дивергенции сходных биосинтетических функций в процессе независимого возникновения нового регуляторного механизма, обеспечивающего физиологические нужды уже глубоко различающихся групп организмов. Таблица I.9 Сравнение полиаденилирования мРНК у эукариот и прокариот
Сплайсинг. Мозаичная интрон-экзонная структура генов эукариот предполагает функционирование механизма, который бы распознавал интроны в предшественниках РНК и с высокой точностью удалял их. Действительно, в 1977 г. такой процесс был обнаружен, он получил название сплайсинга (от англ. splice – соединять концами) и с тех пор интенсивно исследуется. Удаление последовательностей интронов с помощью сплайсинга происходит в ядрах эукариот сразу после завершения синтеза пре-РНК. В сплайсинге, как правило, участвуют особые рибонуклеопротеиновые (РНП)-частицы – малые ядерные РНП (мяРНП), в состав которых входят мяРНК U1–U6 и многочисленные белки. Эти РНП-частицы на стыках интронов и экзонов образуют функциональный комплекс, получивший название сплайсомы. Однако не все интроны для своего удаления требуют функционирования такого сложного аппарата. В частности, интроны предшественников тРНК у эукариот удаляются с участием более простого набора ферментов, а для вырезания некоторых интронов не требуется никаких дополнительных компонентов, кроме самих предшественников РНК. Последний процесс получил название аутосплайсинга (self-splicing). Поскольку механизмы химических реакций, происходящих в ходе аутосплайсинга, реализуются и при функционировании сплайсомы, они будут рассмотрены более подробно в следующем разделе. В заключение этого краткого введения определим с помощью приведенной ниже схемы термины, которые будут использоваться при обсуждении механизмов сплайсинга. 5’-Концевой сайт Точка 3’-Концевой сайт сплайсинга разветвления сплайсинга 5’–экзон 1GUAUGU__...__UACUAAC__...__(Py)nAGэкзон 2–3’ -----------------------Интрон--------------------- На схеме изображен интрон, соединяющий два соседних экзона в предшественнике мРНК дрожжей. В общих чертах та же структура характерна и для пре-мРНК высших организмов. Места соединения интронов и экзонов, в которых происходит разрыв фосфодиэфирных связей пре-мРНК во время сплайсинга, в зависимости от их положения в интроне называют 5’- или 3’-концевыми сайтами сплайсинга. Полипиримидиновая последовательность (Py)n перед 3'-концевым сайтом сплайсинга существенна для правильного вырезания интронов. Остаток аденозина в консервативной последовательности нуклеотидов интрона, расположенный ближе к его 3’-концу, получил название точки разветвления (branch point). Именно с этим аденозином ковалентно соединяется 5’-конец интрона, освобождающийся на первом этапе сплайсинга с образованием структуры типа "лассо" (lariat) (см. ниже). Первичная структура указанных сайтов мало консервативна в генах, кодирующих ядерные пре-мРНК, и может значительно варьировать даже у интронов одного и того же организма. В зависимости от механизма вырезания интронов и особенностей их пространственной структуры различают интроны групп I, II и III, интроны ядерных РНК, а также твинтроны – интроны, расположенные внутри интронов. А  утосплайсинг интронов групп I, II и III. Открытие интронов, удаляющихся из пре-РНК в результате аутокаталитического процесса – аутосплайсинга, имело далеко идущие последствия для развития фундаментальных и прикладных исследований в молекулярной генетике и породило целое направление с использованием рибозимов (подробнее см. раздел 9.2). Такие интроны впервые были обнаружены в органеллах высших организмов, но вскоре было продемонстрировано их широкое распространение в природе. Исследование молекулярных механизмов аутосплайсинга показало, что хотя все вышеупомянутые интроны в сплайсинге используют одни и те же реакции трансэтерификации: утосплайсинг интронов групп I, II и III. Открытие интронов, удаляющихся из пре-РНК в результате аутокаталитического процесса – аутосплайсинга, имело далеко идущие последствия для развития фундаментальных и прикладных исследований в молекулярной генетике и породило целое направление с использованием рибозимов (подробнее см. раздел 9.2). Такие интроны впервые были обнаружены в органеллах высших организмов, но вскоре было продемонстрировано их широкое распространение в природе. Исследование молекулярных механизмов аутосплайсинга показало, что хотя все вышеупомянутые интроны в сплайсинге используют одни и те же реакции трансэтерификации:О О R–OH + R’–O–P–OR’’ R–O–P–OR’’ + R’–OH, ║ ║ О О детали механизмов для интронов групп I, II и III различны. На рис. I.15,а,б изображены структурные особенности интронов I–III групп. Интроны группы I образуют наиболее сложные вторичные и третичные структуры. Они обнаружены в предшественниках РНК простейшего Tetrahymena thermophila и удаляются из них с использованием приведенного в табл. I.10 механизма. Таблица I.10 Механизм прямой и обратной реакций аутосплайсинга интронов группы I
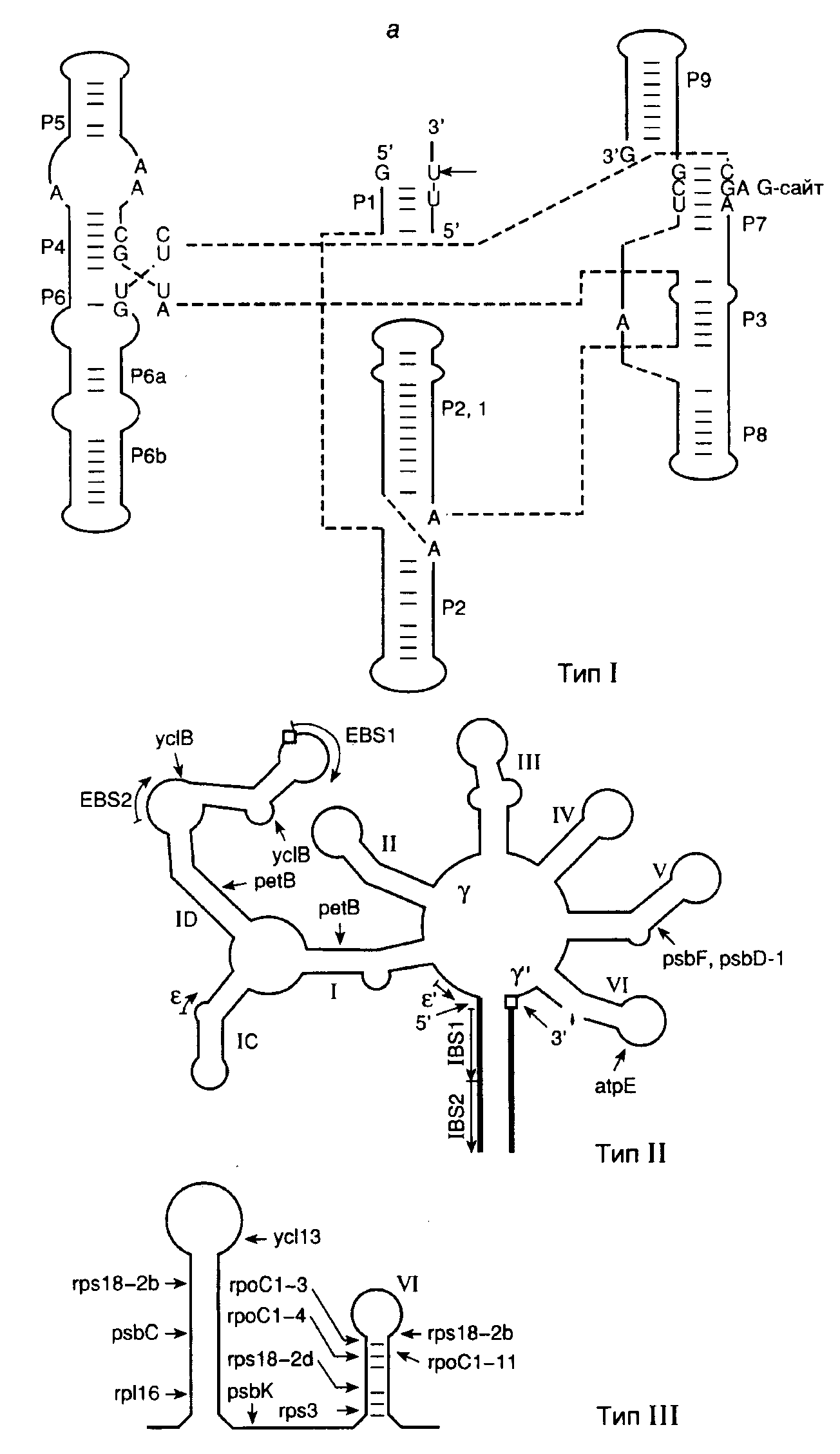 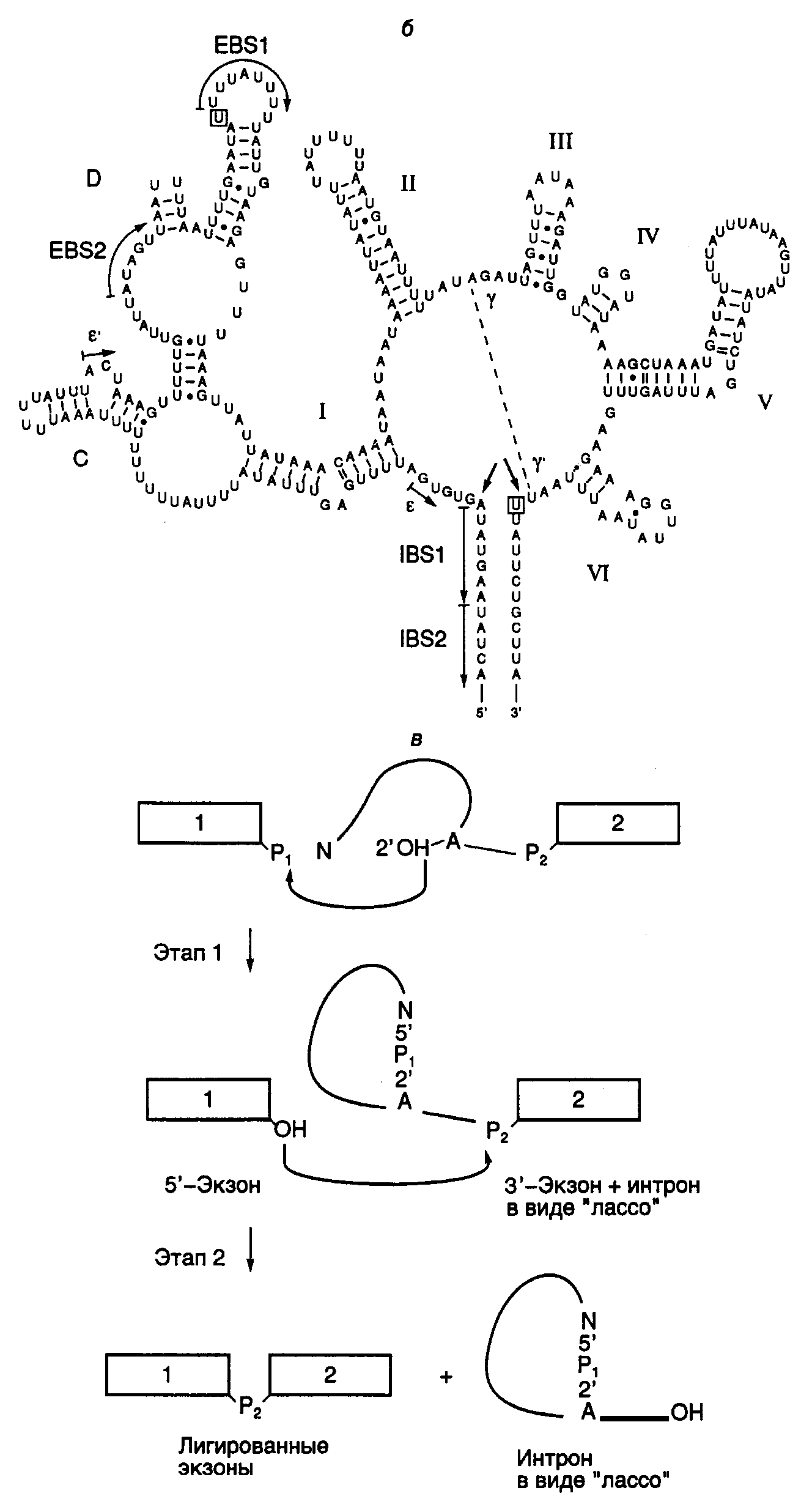 Рис. I.15. Структура интронов I-III групп и механизм аутосплайсинга а – вторичные структуры типичных интронов типа I (Tetrahymena thermophila), II и III групп (Euglena gracilis). Стрелками обозначены 3- и 5-сайты сплайсинга, а также места интеграции твинтронов, пунктирными линиями – сайты интронов, сближенные в пространстве, EBS и IBS – соответственно сайты связывания экзонов и интронов; б – предполагаемая вторичная структура интрона группы II; в – двухэтапный механизм аутосплайсинга. Римскими цифрами обозначены предполагаемые двухцепочечные участки РНК, 1, 2 – экзоны Строчными буквами в таблице изображены нуклеотиды, принадлежащие экзонам, а прописными – интронам. Прямая и обратная реакции не требуют белковых катализаторов. Однако в ряде случаев интроны I и II групп могут кодировать полипептид, названный матуразой (maturase, от англ. mature – созревать), который необходим для эффективного аутосплайсинга и транспозиции интронов in vivo. Аутосплайсинг интронов группы I начинается с нуклеофильной атаки 2’-OH-группы GTP по фосфодиэфирной связи в 5’-концевом сайте сплайсинга (см. табл. I.10) (присутствие GTP в качестве кофактора необходимо для протекания данной реакции). При этом происходит освобождение 5’-концевого экзона 1. Образовавшиеся половинки молекулы удерживаются рядом друг с другом водородными связями. Освободившаяся 3’-OH-группа экзона 1 далее атакует фосфодиэфирную связь в 3’-концевом сайте сплайсинга, что сопровождается расщеплением этой связи и полным освобождением интрона. Одновременно происходит лигирование двух экзонов. Все этапы этой реакции обратимы. В обратной реакции после связывания соответствующего участка лигированных экзонов "активным центром" вырезанного интрона последний атакует своей концевой 3’-OH-группой фосфодиэфирную связь в месте стыковки экзонов, что сопровождается объединением интрона и экзона 2. На втором этапе 3’-OH-группа экзона 1 атакует фосфатную группу по первой фосфодиэфирной связи интрона, освобождая остаток G, с последующим объединением экзона 1 с остальной частью молекулы. Аутосплайсинг интронов II и III групп протекает по другому механизму (см. рис. I.15,в). Реакция также осуществляется в два этапа. На первом этапе 2’-OH-группа аденозина, находящегося в точке разветвления интрона, вырезаемого из предшественника РНК, атакует фосфодиэфирную связь 5’-концевого сайта сплайсинга, что сопровождается освобождением экзона 1 и образованием промежуточной структуры в виде лассо. В таком промежуточном соединении 5’-концевой нуклеотид интрона соединен 2’–5’-фосфодиэфирной связью с этим остатком аденозина, образуя петлю на конце интрона. На втором этапе 3’-концевая OH-группа экзона 1 атакует 3’-концевой сайт сплайсинга. В результате происходит объединение экзонов и освобождается интрон с петлей на 5’-конце. В заключение следует отметить одно замечательное свойство этой группы реакций. Поскольку число фосфодиэфирных связей на протяжении всех преобразований остается неизменным, они не требуют затраты дополнительной энергии и протекают самопроизвольно. Сплайсинг у ядерных пре-мРНК. Исследование механизмов сплайсинга у ядерных пре-мРНК показало, что они существенно не отличаются от только что рассмотренных механизмов, используемых для удаления интронов II и III групп, однако ряд различий имеется. Структура интронов, удаляемых из предшественников РНК аутосплайсингом, высококонсервативна. У интронов ядерных РНК консервативны лишь короткие последовательности в окрестностях сайтов сплайсинга и точки разветвления. Вторая отличительная особенность сплайсинга у ядерных пре-мРНК – потребность в ATP и мяРНП, формирующих сплайсому. Тем не менее, одинаковые черты этих двух систем сплайсинга более существенны. Малые ядерные РНК, входящие в состав мяРНП и сплайсомы, участвуют в распознавании сайтов сплайсинга и точки разветвления, а также в правильном ориентировании экзонов по отношению друг к другу. Их OH-группы осуществляют атаку фосфодиэфирной связи 5’-концевого сайта сплайсинга на первом этапе реакции. Так же как и в случае интронов II и III групп, для вырезаемого интрона характерна структура типа лассо. Распознавание канонических сайтов при сплайсинге ядерных пре-мРНК.Для полного прохождения всех реакций сплайсинга его аппарат (сплайсома) должен распознавать на пре-мРНК три критические последовательности нуклеотидов: 3’- и 5’-концевые сайты сплайсинга и точку разветвления. В соответствии с наиболее распространенной моделью поиска экзонов в пре-мРНК с большими интронами, аппарат сплайсинга, прежде всего, отыскивает два близкорасположенных сайта сплайсинга в нужной ориентации. Распознавание конкретной пары сайтов сплайсинга в пре-мРНК дрожжей начинается с взаимодействия по принципу комплементарности между последовательностями этих сайтов и 5’-концевыми участками мяРНК U1, входящих в состав U1-мяРНП-частиц в случае 5’-концевых сайтов сплайсинга, а также белка U2AF65, находящегося в комплексе с U2AF35, с последовательностью 3’-концевого сайта сплайсинга. Эффективность функционирования сайтов сплайсинга зависит от степени соответствия их первичной структуры консенсусным последовательностям. Сближение двух сайтов сплайсинга, сопровождаемое выпетливанием последовательности интрона, осуществляется с участием SR-белков, обогащенных Ser и Arg, которые взаимодействуют с 70К-белком (70 кДа), входящим в состав U1-мяРНП-частицы, а также U2AF35 на другом конце интрона. Такие комплексы, образованные с участием SR-белков, получили название "коммитированных комплексов". В то время как 5’-концевые сайты сплайсинга довольно консервативны, 3’-концевые сайты обнаруживают большую вариабельность. U1-мяРНП, находящиеся в комплексе с 5’-концевым сайтом сплайсинга, стимулируют присоединение белков U2AF к 3’-концевому сайту и способствуют правильному распознаванию соответствующего экзона в процессе, получившем название "определение экзона". Эффективное распознавание сайтов сплайсинга соответствующими белками является критическим этапом в правильном и упорядоченном удалении экзонов из пре-мРНК в процессе конститутивного сплайсинга. Механизмы определения экзонов. Гены позвоночных, как правило, содержат большое число мелких экзонов (средняя длина 137 п.о.), разделенных протяженными последовательностями интронов, длина которых может превышать 100 т.п.о. При этом ферментные системы, осуществляющие сплайсинг, должны распознавать небольшие экзоны, затерянные среди гигантских некодирующих последовательностей, и осуществлять их правильное объединение друг с другом. Как уже упоминалось выше, канонические (консенсусные) последовательности, необходимые для распознавания экзонов, располагаются на концах интронов. Однако в отличие от соответствующих последовательностей интронов дрожжей регуляторные последовательности в окрестностях сайтов сплайсинга животных менее консервативны, и это, на первый взгляд, значительно усложняет задачу распознавания экзонов системами сплайсинга. В действительности распознавание индивидуальных сайтов сплайсинга у животных, по-видимому, не связано с независимым распознаванием канонических последовательностей в окрестностях каждого экзона. В соответствии с наиболее популярной в настоящее время моделью 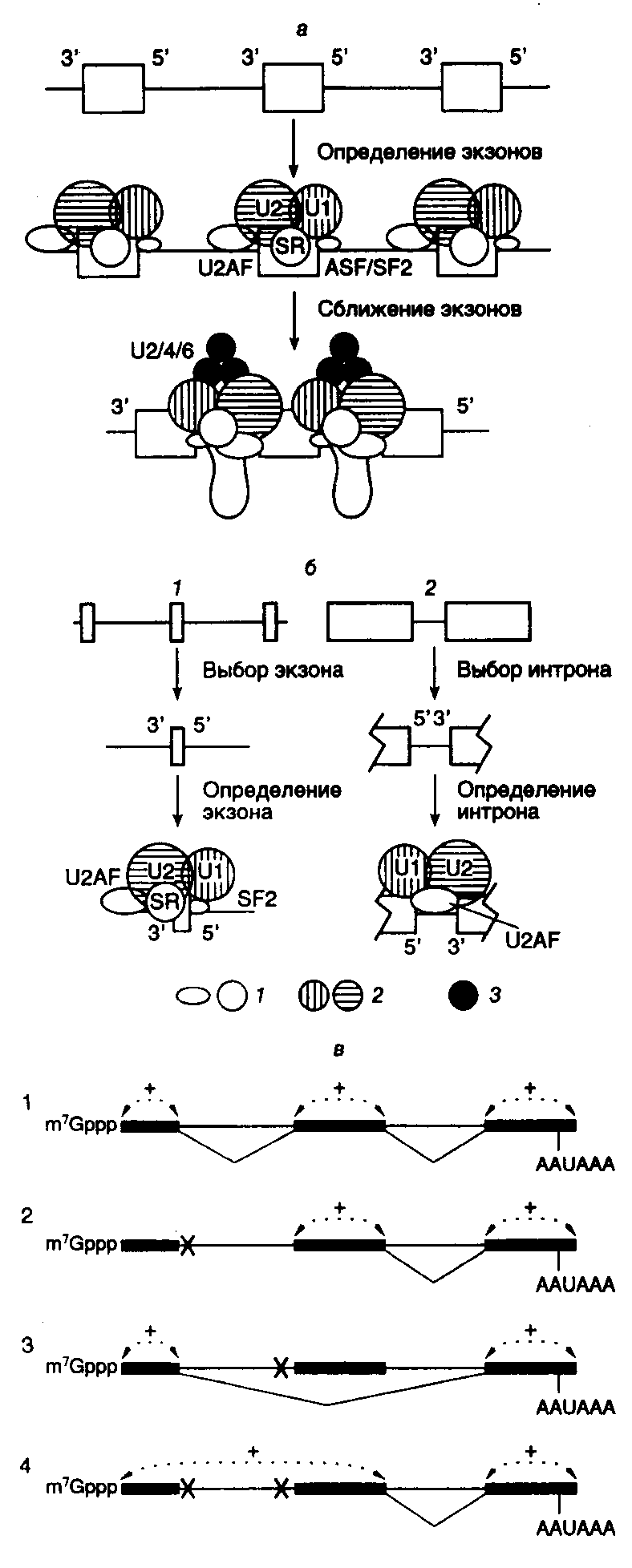 Рис. I.16. Механизм определения экзонов и интронов при сплайсинге ядерных пре-мРНК а – определение экзонов; б – определение интронов у позвоночных (1) и низших эукариот (2), в – роль кэп-связывающего комплекса (CBC) в определении экзонов. Отмечены белки и РНК, участвующие в этом процессе в составе сплайсом: 1 – белки, 2 и 3 – мяРНП, X – мутации, инактивирующие сайты сплайсинга; + – взаимодействия, обеспечивающие распознавание экзонов; AAUAAA – поли(А)-сайт определения экзонов у животных, взаимодействие между соседними сайтами сплайсинга в генах с короткими экзонами и длинными интронами происходит не через интроны, а через последовательности экзонов. Предполагается, что у пре-мРНК с длинными интронами система сплайсинга, прежде всего, отыскивает пару близкорасположенных сайтов сплайсинга, фланкирующих короткие последовательности экзонов (рис. I.16,а). После распознавания такой пары с ними взаимодействуют U1- и U2-мяРНП и ассоциированные факторы сплайсинга, включая факторы, распознающие 3’-концевые сайты сплайсинга – U2AF и SC35, а также фактор, узнающий 5’-концевой сайт сплайсинга – ASF/SF2. После завершения процесса определения экзона соседние экзоны входят в контакт друг с другом в результате взаимодействия между факторами, распознающими индивидуальные экзоны. Таким образом, в соответствии с этой моделью процесс сборки активной сплайсомы у позвоночных проходит в два этапа, включающие определение экзонов и их сближение между собой. В генах с небольшими интронами, например у низших эукариот, по-видимому, реализуется альтернативный механизм (см. рис. I.16,б). В этом случае первым этапом сборки сплайсомы является определение интрона. В результате мутаций, связанных с нарушением сплайсинга, возникает, по крайней мере, четыре фенотипа: игнорирование экзона, который вырезается вместе с интронами; активация новых (криптических) сайтов сплайсинга; возникновение внутри интронов псевдоэкзонов, последовательности которых не вырезаются из пре-мРНК, и игнорирование интронов. Частоты этих мутаций составляют соответственно 51, 32, 11 и 6%. Все фенотипы, за исключением последнего, могут быть объяснены на основе обсуждаемой модели определения экзонов. Эта же модель позволяет предсказывать максимальные и минимальные размеры экзонов в генах эукариот. Действительно, анализ длин 1600 внутренних экзонов показал, что только 3,5% из них содержат более 300 нуклеотидов и менее 1% – 400 нуклеотидов. Кроме того, доля экзонов, длина которых меньше 50 нуклеотидов, в этой выборке также незначительна. Известно, что в опытах in vitro сплайсинг резко ингибируется, если длина внутренних экзонов превышает 400 нуклеотидов или становится меньше 50 нуклеотидов. Все эти факты делают модель определения экзонов весьма правдоподобной. Более короткие экзоны, длина которых составляет 6 или 7 п.о., часто обнаруживаемые в генах белков мышц, распознаются системой сплайсинга через энхансерные регуляторные последовательности, расположенные в интронах рядом с экзонами. Механизм распознавания очень длинных экзонов остается неизвестным. 2.2.4.Кэп-связывающий комплекс в роли фактора, сопрягающего основные реакции метаболизма транскриптов РНК-полимеразы IIРНК не может находиться in vivo в свободном виде. На протяжении всего внутриклеточного существования – от инициации биосинтеза до полной деградации – РНК пребывает в составе рибонуклеопротеиновых комплексов (РНП). Интенсивные исследования РНП-частиц выявили множество белков, образующих такие комплексы. Поскольку почти все мРНК эукариот претерпевают одни и те же внутриклеточные превращения, основными из которых являются кэпирование, полиаденилирование и сплайсинг, в составе РНП обнаруживают ограниченный набор белков, обеспечивающих протекание этих процессов. Помимо белков, необходимых для специфической трансляции мРНК определенных видов, а следовательно, и ассоциированных только с этими видами мРНК, два белка представлены почти во всех цитоплазматических мРНП животных в больших количествах – уже обсуждавшийся выше поли(А)-связывающий белок PABP и белок р50. Роль последнего как универсального регулятора трансляции обсуждается в разделе 3.4. Здесь же будут рассмотрены другие, не менее универсальные белки мРНП, которые взаимодействуют с кэп-группами и обеспечивают сопряжение основных реакций посттранскрипционных модификаций мРНК эукариот и экспорта мРНП из ядра в цитоплазму. Ядерный кэп-связывающий комплекс (CBC). Присоединение кэп-группы к любой строящейся цепи мРНК эукариот, что является ее первой (котранскрипционной) модификацией, оказывает глобальное влияние на все последующие реакции внутриклеточного метаболизма мРНК, включая ее трансляцию. Наличие кэп-группы дает возможность мРНК специфически взаимодействовать с белковым ядерным кэп-связывающим комплексом CBC (cap-binding complex). Очищенный до гомогенности CBC представляет собой гетеродимер белков CBP80 (молекулярная масса 80 кДа) и CBP20 (20 кДа). N-Концевая часть большой субъединицы CBC содержит сигнал ядерной локализации NLS (nuclear localization signal), обеспечивающий челночные функции CBC во время экспорта мРНП из ядра в цитоплазму (см. ниже). Для взаимодействия CBC с кэп-группой мРНК требуются обе его субъединицы, которые по отдельности не обладают кэп-связывающими свойствами. Обсуждаемые функции CBC сохраняются у всех исследованных видов эукариот – от дрожжей до человека. Роль CBC в сплайсинге пре-мРНК. Уже более 15 лет известно, что кэп-структура m7G необходима для эффективного сплайсинга пре-мРНК в бесклеточных экстрактах клеток животных. Было установлено, что сплайсинг пре-мРНК с одним интроном подавляется в присутствии экзогенных аналогов кэпа или кэп-содержащих РНК. Резкое ингибирование сплайсинга наблюдали в экстрактах, истощенных с помощью специфических антител по большой субъединице CBC – CBP80. Дальнейшее всестороннее изучение этого явления показало, что гетеродимерный CBC требуется для эффективного сплайсинга кэпированных пре-мРНК. Оказалось, что во время сплайсинга больших пре-мРНК кэп-группа оказывает влияние лишь на вырезание ближайшего к ней интрона. На рис. I.16в схематически представлены результаты опытов, особенно четко демонстрирующих данное явление. В этих экспериментах использовали искусственные кэпированные пре-мРНК с двумя интронами, которые содержали один или несколько мутантных канонических сайтов сплайсинга в разных комбинациях. Инактивация 5'-концевого сайта сплайсинга первого интрона не оказывала влияния на вырезание второго интрона и блокировала вырезание первого (см. рис. I.16,в,2). Мутация в ближайшем к кэп-группе 3'-концевом сайте сплайсинга сопровождалась вырезанием большой последовательности, включающей оба интрона и второй экзон, расположенный между ними (см. рис. I.16,в,3). Такая конструкция процессировалась как пре-мРНК, содержащая только один интрон, вырезание которого зависело от наличия комплекса CBC. В том случае, если были инактивированы как 3'-, так и 5'-концевой сайты сплайсинга первого интрона, вырезание второго интрона происходило независимо от CBC (в истощенных по комплексу экстрактах) (не отражено на рисунке). Лишь одновременное разрушение 5'-концевого сайта сплайсинга и полипиримидиновой последовательности первого экзона сопровождалось появлением CBC-зависимости вырезания второго интрона (см. рис. I.16,в,4). (Полипиримидиновая последовательность обсуждалась выше, в начале подраздела, посвященного сплайсингу.) Полученные данные показывают, что именно полипиримидиновая последовательность, а не 5'-концевой сайт сплайсинга первого экзона, обеспечивает кэп-независимое вырезание второго интрона. Принимая во внимание, что CBC необходим для эффективного взаимодействия U1-мяРНП с 5'-концевым сайтом сплайсинга ближайшего к нему интрона, высказывают предположение, что полипиримидиновая последовательность, расположенная перед центральным экзоном, выполняет аналогичные функции при определении этого экзона системой сплайсинга. Сопряжение сплайсинга с формированием 3'-концевых последовательностей пре-мРНК. Для предшественников мРНК, не содержащих кэп-групп, характерна малая эффективность процессинга их 3'-концевых последовательностей в экстрактах ядер. Кроме того, в таких бесклеточных системах расщепление кэпированной пре-мРНК вблизи поли(А)-сайта подавляется аналогом кэп-группы m7GpppG и не происходит в экстрактах, истощенных по CBC с помощью антител. На основании такого рода данных делается вывод, что во время процессинга пре-мРНК CBC пространственно сближен с комплексом белков системы, формирующей 3'-концевые последовательности, и стабилизирует этот комплекс через белок–белковые взаимодействия, что необходимо для его эффективного функционирования. Пространственное сближение 5'- и 3'-концевых последовательностей было прямо продемонстрировано для РНП гигантских (35–40 т.о.) транскриптов колец Бальбиани. В соответствии с современной моделью, поли(А)-сайт пре-мРНК участвует в определении ее последнего интрона вместо обычно используемого для этой цели 5'-концевого сайта сплайсинга. Недавно было установлено, что, в свою очередь, и 3'-концевой сайт сплайсинга последнего интрона стимулирует полиаденилирование пре-мРНК, а следовательно, и процесс удаления последнего интрона сопряжен с полиаденилированием предшественника. Участие CBC в экспорте транскриптов РНК-полимеразы II из ядер в цитоплазму. Транскрипты РНК-полимеразы II разделяют, по крайней мере, на два больших класса: мРНК и U-мяРНК. Для РНК обоих классов характерно наличие кэп-групп, но малые ядерные РНК не полиаденилированы. Наличие кэп-группы резко стимулирует экспорт этих РНК из ядер в цитоплазму. С помощью иммуноэлектронной микроскопии удалось осуществить наблюдения in situза динамикой ассоциации, экспорта, а также диссоциации субъединиц CBC и транскриптов колец Бальбиани, которые представляют собой гигантские пуффы на политенных хромосомах слюнных желез комара Chironomus tentans. Проведение прямых наблюдений стало возможным благодаря большому размеру транскриптов колец Бальбиани (35–40 т.п.о.) и, как следствие, их пре-мРНП, в состав каждого из которых входит до 200 молекул белков. Было установлено, что белки CBC выходят из ядер в составе мРНП и повторно импортируются в ядра. При этом, в соответствии с современной моделью, происходит следующая последовательность реакций. Как уже упоминалось, большая субъединица CBC CBP80 содержит специфическую аминокислотную последовательность – сигнал ядерной локализации (NLS). Гетеродимерный цитоплазматический рецептор этого сигнала животных состоит из двух субъединиц – импортина α (молекулярная масса 60 кДа) и импортина β (90 кДа). В цитоплазме импортин α взаимодействует непосредственно с NLS белков, импортируемых в ядро, и импортином β, который в, свою очередь, содержит сайт взаимодействия с ядерным поровым комплексом NPC (nuclear pore complex). Через NPC происходит обмен макромолекулами ядра и цитоплазмы. Белки, содержащие NLS, в комплексе с рецептором переносятся в ядро, где рецептор диссоциирует на субъединицы. Диссоциация рецептора на две субъединицы импортина в нуклеоплазме запускается особым ферментом, GTPазой Ran, связанной с GTP, сродство к которой импортина β выше, чем к импортину α. В результате импортин β удаляется из комплекса. В настоящее время не исключается возможность того, что диссоциировавшая субъединица импортина β остается связанной с цитоплазматической частью NPC. Механизм дальнейшей диссоциации импортина α и NLS не ясен. Полагают, что выход импортина β из комплекса ослабляет связь импортина α и NLS большинства ядерных белков, но не большой субъединицы CBC, с которой импортин α взаимодействует особенно прочно. В ядре синтезированные РНК через кэп-группу взаимодействуют с CBC, находящимся в комплексе с импортином α, и через NPC перемещаются из ядра в цитоплазму. На цитоплазматической части NPC или в цитоплазме к комплексу CBC–РНК–импортин α присоединяется импортин β через импортин β-связывающий домен импортина α. Это облегчается тем, что в цитоплазме GTPаза Ran находится в комплексе с GDP из-за присутствия так называемого белка 1, активирующего GTPазу Ran(Ran GAP1), которая в его присутствии гидролизует связанный с ней GTP. Благодаря особым свойствам NLS кэп-связывающего комплекса CBC, присоединение импортина β в данном случае сопровождается диссоциацией РНК и белкового комплекса CBC-рецептор. В таком виде белковый комплекс переносится в нуклеоплазму, и цикл экспорта синтезированной РНК начинается сначала. В случае U–гяРНП такая цитоплазматическая диссоциация комплекса приводит к гиперметилированию кэп-группы гяРНК, сборке нового комплекса и реимпорту его вместе с гяРНК в ядро. Освобождение кэп-группы мРНК после ее выхода из ядра в цитоплазму делает возможным взаимодействие с ней фактора инициации трансляции eIF-4E с последующим вовлечением мРНК в синтез белка (см. раздел 2.5.1). Участие CBC в сборке РНП-частиц и формировании правильной пространственной структуры мРНК. Большинство информации о сборке РНП-частиц и механизмах формирования пространственной структуры мРНК в цитоплазме получено с использованием транскриптов колец Бальбиани. Поэтому остается под сомнением возможность распространения выявленных закономерностей на другие транскрипты. Сборка РНП-частиц осуществляется котранскрипционно (т.е. одновременно с транскрипцией) и начинается с 5'-конца растущей цепи РНК. Поскольку присоединение CBC к кэп-группе происходит одним из первых, полагают, что это инициирует упорядоченное взаимодействие с РНК других белков, входящих в состав гяРНП, с образованием РНП-фибриллы. Наличие кэп-группы дает возможность соответствующим механизмам функционально различать транскрипты РНК-полимераз I, II и III. Действительно, РНК, синтезируемые РНК-полимеразами I и III, не содержат на своих 5'-концах m7G-групп, включаются в РНП в составе других белков и не подвергаются сплайсингу и полиаденилированию. Для этих транскриптов характерны и другие механизмы транспорта из ядра в цитоплазму. Полагают, что набор белков, ассоциированных с РНК разных классов, определяется, прежде всего, особенностями их первичной структуры. В то же время белки РНП обеспечивают РНК пространственную структуру, оптимальную для ее дальнейшего внутриклеточного метаболизма и функционирования. |

 асщепление
асщепление нтеграция
нтеграция