Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
2.2.Котранскрипционные и посттранскрипционные модификации РНКТранскрипция у любого организма является первым этапом реализации генетической информации – экспрессии генов. Однако первичные транскрипты, как правило, представляют собой лишь предшественники зрелых мРНК – пре-мРНК, которые перед выполнением своих функций должны претерпеть многочисленные изменения, называемые посттранскрипционными модификациями. Кроме того, у эукариот зрелые мРНК должны быть доставлены от места их биосинтеза (ядра) к месту трансляции (цитоплазматическим рибосомам), т.е. экспортироваться из ядра в цитоплазму. Одной из наиболее удивительных посттранскрипционных модификаций пре-мРНК является редактирование их первичной структуры. В результате посттранскрипционно изменяется смысл генетической информации, заключенной в соответствующем гене. Посттранскрипционные модификации РНК особенно характерны для эукариотических организмов, у которых в силу мозаичной интрон-экзонной структуры их генов первичные транскрипты представлены гигантскими предшественниками, включающими в себя последовательности как экзонов, так и интронов. 5’-Конец предшественника мРНК чаще всего подвергается котранскрипционным модификациям, в результате которых к его 5’-концевому нуклеотиду особым образом присоединяется остаток гуанозина с образованием "шапочки" – кэпа. Эта котранскрипционная модификация создает условия для прохождения следующего этапа процессинга мРНК – сплайсинга, сопровождающегося вырезанием последовательностей интронов и объединением экзонов с образованием непрерывной кодирующей последовательности мРНК. Одновременно от 3’-конца путем эндонуклеазного расщепления отделяется избыточный фрагмент РНК, и к оставшейся части присоединяется поли(А)-последовательность. Эта совокупность реакций получила название полиаденилирования мРНК. После таких котранскрипционных и посттранскрипционных модификаций пре-мРНК образовавшаяся зрелая, стабилизированная мРНК переносится из ядра в цитоплазму, часто к специфическому месту своей внутриклеточной локализации, где может быть депонирована или эффективно транслироваться рибосомами. Каждый из этапов посттранскрипционных модификаций может использоваться для регуляции уровня экспрессии соответствующих генов. 2.2.1.Процессинг РНК у бактериймРНК прокариот обычно являются полицистронными, т.е. включают в себя последовательности нуклеотидов нескольких генов одного оперона (рис. I.10,а). Полицистронные мРНК бактерий при выполнении своих функций матричных РНК в трансляции не требуют разбиения на последовательности отдельных генов и могут транслироваться непосредственно рибосомами с образованием функционально активных белков. Исключением из правила являются полицистронные ранние мРНК нечетных T-бактериофагов Т3 и Т7, которые после транскрипции in vivo расщепляются до моноцистронных под действием РНКазы III, специфически гидролизующей двухцепочечные РНК. Участие этого фермента в процессинге указывает на наличие характерной вторичной структуры РНК на границах транскриптов отдельных генов вышеупомянутых бактериофагов, что и было обнаружено после определения их первичной структуры. РНКаза III участвует также в процессинге предшественников рРНК у E. coli, поскольку 5S, 16S и 23S рРНК исходно синтезируются в составе общего первичного транскрипта. При этом в спейсерных участках 30S предшественников между последовательностями 16S и 23S рРНК расположены тРНК. Кроме того, у бактерий обнаружены транскрипты генов тРНК, содержащие до шести тРНК в составе одного предшественника. В процессинге предшественников тРНК у бактерий ключевую роль играет РНКаза P. Для проявления нуклеазной активности у этого необычного фермента требуется присутствие небольшой РНК, прочно ассоциированной с его полипептидной цепью. Именно ей присуща собственная эндонуклеазная активность, что характерно и для других рибозимов (подробнее см. главу 9). Таким образом, зрелые молекулы рРНК и тРНК образуются в клетках как прокариот, так и эукариот в результате серии эндо- и экзонуклеазных воздействий на их предшественники. Основной же посттранскрипционной модификацией является полиаденилирование их 3’-концевых последовательностей. Полиаденилирование РНК у бактерий. Хотя поли(А)-полимераза E. coli, осуществляющая безматричный синтез поли(А) при наличии РНК-затравок, была очищена в 1962 г., поли(А)-РНК у бактерий не была обнаружена до 1975 г. 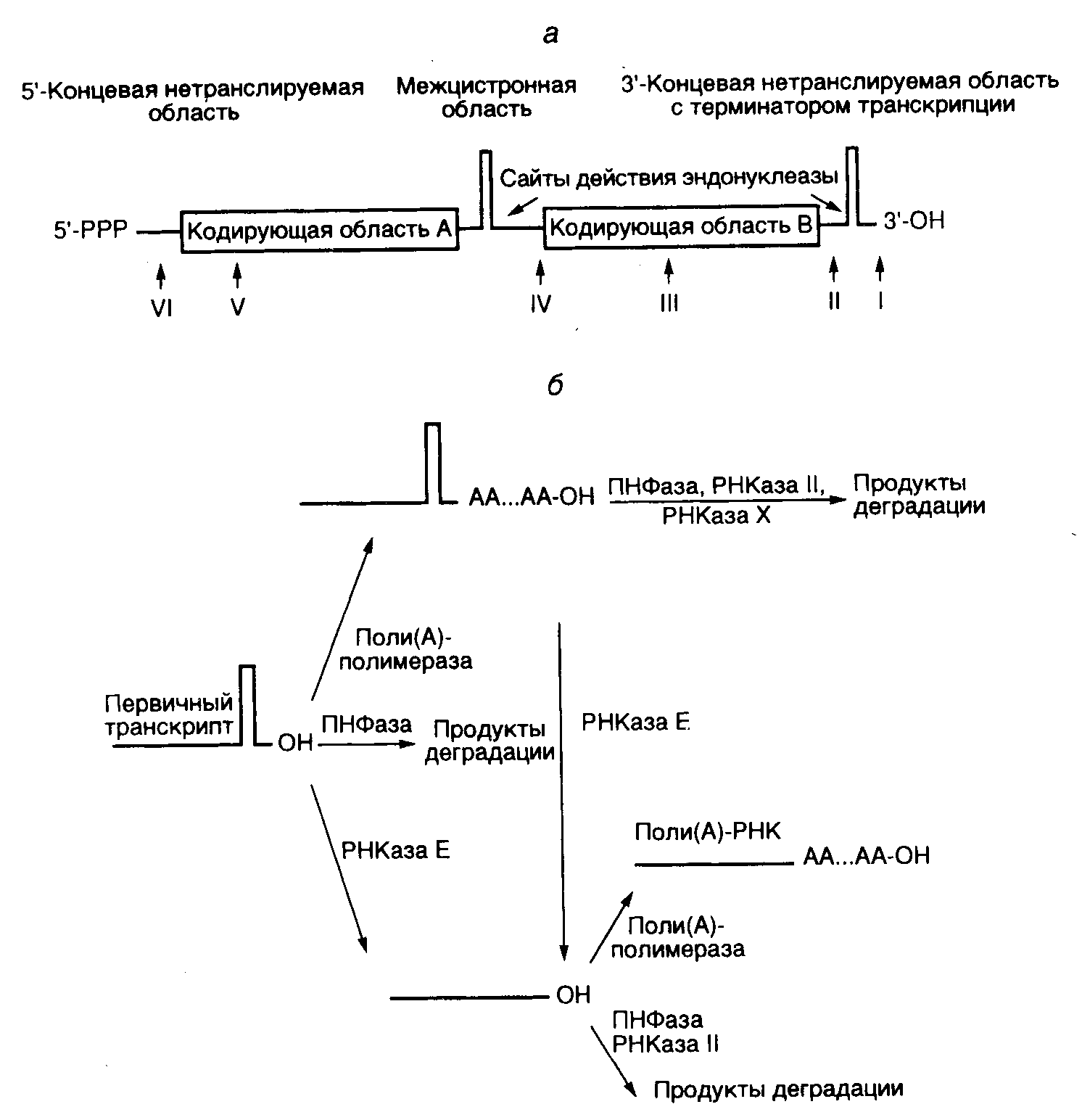 Рис. I.10. Локализация сайтов полиаденилирования и пути катаболизма бактериальных РНК а – обобщенная структура бактериальной полицистронной мРНК и положение сайтов полиаденилирования в РНК классов I-VI; б – альтернативные пути катаболизма бактериальных мРНК с участием поли(А)-полимеразы, полинуклеотидфосфорилазы (ПНФазы) и различных РНКаз; РНКаза Х – гипотетическая рибонуклеаза и долгое время после этого рассматривалась как исключение из общего правила и биологический курьез. В настоящее время стало ясно, что полиаденилирование РНК у бактерий столь же обычно, как и у эукариот, и выполняет важные биологические функции. Поли(А)-последовательности бактериальных мРНК значительно короче соответствующих эукариотических. Их длина, в среднем, составляет всего 14–16 нуклеотидов (80–200 – у эукариот), а полиаденилированы лишь от 1 до 40% молекул мРНК каждого определенного вида в клетке (100% в случае эукариот). Более подробное сравнение свойств поли(А)-последовательностей прокариот и эукариот проведено в разделе 2.2.3. Классы поли(А)-содержащих РНК бактерий.В зависимости от расположения сайта присоединения поли(А)-последовательности все бактериальные РНК разделяют на шесть классов (см. рис. I.10,а). В РНК первого класса происходит полиаденилирование 3’-концевого нуклеотида, следующего сразу за терминаторной шпилькой -независимого терминатора последней кодирующей области. У РНК второго класса терминаторная шпилька отщепляется посттранскрипционно РНКазой Е, и к образующемуся 3’-концу присоединяется поли(А). Терминаторная шпилька отсутствует и у полиаденилированных мРНК третьего класса, образующихся с участием -зависимых терминаторов транскрипции, благодаря особенностям структуры таких терминаторов. В укороченных мРНК четвертого класса отсутствует 3’-концевая кодирующая область, а поли(А) начинается непосредственно за межцистронной терминаторной шпилькой. В РНК пятого класса поли(А)-последовательности локализуются на концах укороченных цистронов, а у РНК шестого класса – на концах 5’-концевых некодирующих последовательностей. На основании структуры поли(А)+-мРНК делается вывод, что полиаденилирование у бактерий не зависит от присутствия в РНК специфических регуляторных сигналов, как это имеет место у эукариот, а определяется наличием у них свободных 3’-OH-групп. Такие промежуточные мРНК разной длины, по-видимому, появляются в результате деградации или преждевременной терминации синтеза полноразмерных транскриптов. Поли(А)-полимеразы.Полиаденилирование бактериальных мРНК катализирует поли(А)-полимераза (ATP:полирибонуклеотид-аденилилтрансфераза), которая осуществляет независимое от матрицы последовательное присоединение остатков аденилата к 3’-OH-концам молекул РНК в соответствии со следующей реакцией: РНК + nATP РНК(А)n + nPPi У E. coli описаны две поли(А)-полимеразы. Поли(А)-полимераза I кодируется локусом pcnB, первоначально идентифицированным в качестве контролирующего число копий плазмид в бактериальных клетках. Процессированная молекула представляет собой полипептид с молекулярной массой 52 кДа, не обладающий гомологией с соответствующими эукариотическими ферментами, однако содержащий сегмент, гомологичный части полипептидной цепи тРНК-нуклеотидилтрансферазы, которая осуществляет посттранскрипционное присоединение акцепторного CCA-тринуклеотида к молекулам тРНК. Даже умеренная сверхэкспрессия рекомбинантного гена pcnB летальна для E. coli. Полная инактивация гена pcnB с помощью делеций не сопровождается прекращением полиаденилирования мРНК, что указывает на присутствие в геноме E. coliвторого аналогичного гена. Такой ген был обнаружен в виде открытой рамки считывания f310, кодирующей полипептид с молекулярной массой 36,3 кДа, обогащенный гидрофобными аминокислотами. Полипептид не обладает гомологией ни с одной из известных бактериальных, вирусных или эукариотических поли(А)-полимераз. Возможная функциональная роль полиаденилирования РНК у бактерий. Несмотря на то что полиаденилирование РНК интенсивно исследуется более 25 лет, его функциональная роль даже у эукариот полностью не выяснена. Еще меньше известно о роли полиаденилирования РНК у бактерий. Однако из имеющихся данных становится ясно, что влияние полиаденилирования РНК на молекулярные процессы бактериальной клетки весьма разнообразно и распространяется, по крайней мере, на контроль числа копий бактериальных плазмид, стабильность мРНК и ее трансляцию. Регуляция репликации плазмид через полиаденилирование антисмысловых РНК. Более подробно механизмы регуляции репликации бактериальных плазмид будут рассмотрены в разделе 4.2.2 на примере плазмиды ColE1. Здесь же лишь кратко отметим, что у некоторых групп плазмид, например ColE1 или pBR322, которая является ее производной, регуляция числа копий осуществляется с помощью антисмысловой РНК (РНК I), образующей гибрид с РНК-праймером (РНК II), необходимым для инициации их репликации, и блокирует его функционирование. В соответствии с этим внутриклеточная концентрация РНК I является критическим параметром в регуляции репликации плазмид. Деградация РНК I инициируется отщеплением 5’-концевого пентануклеотида под действием РНКазы Е (РНК I–5) и далее контролируется поли(А)-полимеразой – продуктом гена pcnB. Полиаденилированная РНК I–5 обладает коротким временем полужизни, типичным для бактериальных мРНК (1–2 мин), тогда как немодифицированная РНК I–5 значительно более стабильна (время полужизни – >10 мин). Ускоренная деградация поли(А)-РНК I–5 инициируется полинуклеотидфосфорилазой. У поли(А)--РНК I–5 3’-концевой нуклеотид находится в составе шпильки, что препятствует эффективному действию полинуклеотидфосфорилазы. Однако при наличии короткого поли(А)-хвоста, выступающего за пределы шпильки, РНК I–5 эффективно расщепляется ферментом по 3’-экзонуклеазному механизму. В разрушение поли(А)+-РНК I–5 вносят свой вклад и другие нуклеазы, включая РНКазу Е и РНКазу III. Имеются данные и том, что полиаденилирование само по себе инактивирует РНК I–5, так как оно приводит к характерному изменению ее вторичной структуры. Влияние полиаденилирования на время полужизни бактериальных мРНК. Описанное выше дестабилизирующее действие полиаденилирования на антисмысловые РНК распространяется и на некоторые бактериальные мРНК. Например, инактивация гена pcnB, кодирующего поли(А)-полимеразу, с помощью делеций сопровождается значительным увеличением времени полужизни мРНК генов lpp, trxA, ompA, а также rpsO на фоне мутаций pnp, rnb и rne, инактивирующих гены полинуклеотидфосфорилазы и соответствующих рибонуклеаз. Поскольку эти результаты были получены в отсутствие РНКазы Е, 3’-концы большинства бактериальных мРНК содержали шпильку, характерную для -независимых терминаторов транскрипции (см. рис. I.10). Экзонуклеазное расщепление РНК под действием полинуклеотидфосфорилазы и РНКазы II затруднено при наличии такой шпильки и облегчается в присутствии выступающей поли(А)-последовательности (см. рис. I.10,б). Как показано на рисунке, первичный транскрипт в бактериальных клетках может или полиаденилироваться, или подвергнуться экзонуклеазному расщеплению, неэффективному без поли(А)-последовательности, при наличии которой в процесс деградации активно включаются полинуклеотидфосфорилаза и РНКаза II. РНКаза Е может отщеплять как полиаденилированную, так и неполиаденилированную шпильку. Такой незащищенный с 3’-конца транскрипт подвергается атаке 3’-экзонуклеаз, с которой конкурирует полиаденилирование, препятствующее деградации мРНК по этому механизму. Следовательно, полиаденилирование мРНК в бактериальных клетках может выполнять альтернативные функции: дестабилизировать транскрипты при наличии у них 3’-концевых шпилек и стабилизировать "линейные" формы мРНК. Предполагается участие в деградации поли(А)+-мРНК и неизвестной РНКазы Х, поскольку этот процесс может происходить на фоне неактивных полинуклеотидфосфорилазы, РНКазы II и РНКазы Е. Изображенная на рис. I.10 схема катаболизма первичных бактериальных транскриптов является упрощением, так как предполагает независимое действие нуклеаз. В последнее время, в соответствии с общей тенденцией, накапливаются данные о координированной работе большинства компонентов системы деградации бактериальных РНК в составе сложных мультиферментных комплексов, получивших название деградосом. Полное расщепление РНК с 3’-концевой шпилькой деградосомами требует расхода ATP ATP-зависимой РНК-хеликазой, а также участия белка DnaK, белков теплового шока, энолазы и гликолитического фермента с неизвестной функцией в метаболизме РНК. Возможная роль полиаденилирования бактериальных мРНК в трансляции. Как будет видно из дальнейшего изложения (см. раздел 2.2.3), поли(А)-последовательности эукариотических РНК постоянно ассоциированы с жизненно важным поли(А)-связывающим белком PAB, который участвует как в регуляции стабильности мРНК, так и их трансляции. Поиск белка с аналогичными функциями у бактерий привел к очистке рибосомного белка S1, который кооперативно связывается с поли(А)-последовательностями мРНК с константой ассоциации 3·106 М–1. Функциональная роль этого взаимодействия в настоящее время не ясна, однако предполагают, что оно может оказывать влияние на трансляцию. Возможно, белок S1 облегчает доставку мРНК к 30S субчастицам рибосом, что должно стимулировать инициацию трансляции. Полиаденилирование мРНК в митохондриях и хлоропластах. Концепция эндосимбиотического происхождения митохондрий и хлоропластов эукариот из бактерий-эндосимбионтов подкреплена многочисленными экспериментальными данными и является в настоящее время весьма популярной. В этой связи целесообразно рассмотреть особенности полиаденилирования РНК у этих органелл в данном разделе. Полиаденилированные мРНК митохондрий по своей структуре аналогичны мРНК E. coli класса IV (см. рис. I.10,а). Как и у бактерий, полиаденилирование митохондриальных РНК происходит вне зависимости от специфических регуляторных последовательностей, характерных для мРНК эукариот. Средний размер поли(А)-последовательностей мРНК митохондрий в клетках HeLa человека составляет 55 нт, а в клетках асцитных опухолей мышей – 35–55 нт, что соответствует длине поли(А)-последовательностей у бактерий. Поли(А)-полимераза митохондрий клеток гепатомы Морриса обладает молекулярной массой 60 кДа. Она способна добавлять к РНК in vitro поли(А)-последовательности длиной до 600 нт, однако в изолированных митохондриях их размер составляет 20–23 нт. Фермент кодируется ядерным геном. Длина 3’-концевых поли(А)-последовательностей РНК хлоропластов значительно превышает таковую РНК бактерий и достигает нескольких сотен нуклеотидов, что характерно для эукариотических поли(А)+-РНК. Эти последовательности не обязательно являются гомополимерами остатков аденозина, но могут состоять из кластеров А (75%), перемежающихся последовательностями G (24%), а также C и U (суммарное содержание – 5%), что напоминает свойства некодирующих, обогащенных поли(А) участков мРНК бактериофага Т7. Поли(А)-полимераза хлоропластов гороха (Pisum sativum) состоит из трех субъединиц, среди которых полипептид с молекулярной массой 43 кДа обладает антигенными детерминантами, общими с поли(А)-полимеразой дрожжей, а из двух других гликозилированных субъединиц лишь РНК-связывающий полипептид с молекулярной массой 105 кДа абсолютно необходим для функционирования фермента. |
