Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
2.2.2.Редактирование пре-мРНКНедавно появились сообщения о новых механизмах изменения кодирующего потенциала мРНК на посттранскрипционном уровне, названных редактированием РНК (editing). Оказалось, что в клетках многих организмов имеются ферментные системы, способные с высокой специфичностью изменять первичную структуру мРНК, что, в свою очередь, меняет их кодирующий потенциал и приводит к образованию новых функционально значимых белков. Одним из первых был описан механизм редактирования РНК для митохондрий внутриклеточных паразитов – жгутиковых трипаносомид: Crithidia fasciculata, Leishmania tarentolae и Tripanosoma brucei. Митохондриальная (мт) ДНК этих одноклеточных представлена 20–50 идентичными копиями катенанов кольцевых молекул (зацепленные друг за друга кольца в виде гирлянды), называемых максикольцами, которые являются функциональными аналогами мтДНК других эукариот. Кроме того, их митохондрии содержат несколько тысяч копий небольших молекул ДНК (миникольца), функциональное значение которых до недавнего времени оставалось неизвестным. В результате функционирования механизма редактирования мРНК в специфические участки митохондриальной мРНК встраиваются многочисленные остатки уридина (U), не кодируемые максикольцами митохондриального генома, тогда как другие остатки U, включенные в мРНК в результате транскрипции мтДНК, удаляются из транскриптов. При таком "редактировании" кодирующего потенциала мРНК могут быть изменены до нескольких сотен остатков U (табл. I.7), что приводит к образованию протяженных открытых рамок считывания (ОРС), кодирующих у жгутиковых высокогомологичные белки, а также новых кодонов инициации трансляции (AUG), которые отсутствуют у мРНК, не подвергнутых редактированию. Такие модификации мРНК могут создавать новые терминирующие кодоны (UAG и UAA), а также затрагивать 3’-концевые нетранслируемые последовательности мРНК и poly(A)-хвосты. Функциональное значение редактирования этих нетранслируемых последовательностей мРНК неизвестно. Они, как полагают, могут оказывать влияние на стабильность соответствующих мРНК и их содержание внутри клеток. Выбор последовательностей нуклеотидов в мРНК, которые подвергаются редактированию у трипаносомид, по-видимому, осуществляется с участием небольших РНК-проводников (guide RNAs, gRNA), частично комплементарных редактируемым участкам мРНК и кодируемых миникольцами мтДНК. gРНК являются первичными транскриптами, так как содержат на 5’-концах нуклеозиддифосфаты или нуклеозидтрифосфаты. На их 3’-концах обнаруживают 15 некодируемых остатков U, которые добавляются посттранскрипционно 3’-концевой уридилилтрансферазой. Таблица I.7 Различные способы редактирования мРНК
Шесть или более 5’-концевых нуклеотидов gРНК комплементарны последовательности редактируемой мРНК, непосредственно предшествующей блоку нуклеотидов, подвергаемых редактированию. Уже сейчас ясно, что gРНК не служат матрицей для встраивания модифицируемых нуклеотидов в процессе посттранскрипционного редактирования РНК. Обсуждается гипотетический механизм этого процесса, который, к сожалению, не объясняет полностью имеющиеся факты. В соответствии с гипотезой образующиеся ошибочно спаренные (некомплементарные) нуклеотиды в гибридах gРНК и редактируемой мРНК служат сигналами для расщепления мРНК с последующим добавлением по местам разрывов остатков U. При этом места комплементарного спаривания нуклеотидов в РНК–РНК-гибридах защищены от редактирования. Кроме того, предполагают, что редактирование мРНК происходит с участием сложных нуклеопротеидных комплексов – эдитосом, по аналогии со сплайсингом, где участие аналогичных комплексов – сплайсом в настоящее время доказано. Другой тип редактирования РНК характерен для митохондрий слизневиков P. polycephalum (см. табл. I.7). В этом случае отдельные остатки С встраиваются во множественные участки митохондриальных мРНК, что приводит к сдвигам рамок считывания. Механизм данного процесса неизвестен. Своеобразно решают задачу изменения кодирующего потенциала своих мРНК парамиксовирусы, в частности вирусы кори и свинки. Во время транскрипции гена P, кодирующего белок, ассоциированный с полимеразой, РНК-полимераза совершает ошибки, что сопровождается вставками лишних остатков гуанозина (G) в мРНК и, как следствие, сдвигом рамок считывания при их трансляции. В транскриптах митохондрий позвоночных животных в процессе полиаденилирования мРНК происходит создание бессмысленных кодонов UAA и UGA, приводящих к преждевременной терминации трансляции, что в конечном счете сопровождается появлением новых полипептидных цепей. Тот же самый механизм реализуется в ядрах позвоночных. Другая группа механизмов редактирования мРНК основана на ферментативном взаимопревращении остатков нуклеотидов. Например, в большинстве митохондрий высших растений в результате дезаминирования происходит превращение остатков С в U. В меньшей степени для них характерен обратный процесс: UC. При этом изменяется смысл кодонов в мРНК и, как следствие, происходит замена соответствующих аминокислот в белках. В настоящее время еще не охарактеризованы ферментные системы, осуществляющие такие посттранкрипционные превращения нуклеотидов на уровне мРНК. Отдельно следует упомянуть редактирование мРНК, происходящее в хлоропластах высших растений, в частности у кукурузы и табака. Оказалось, что предсказание последовательностей аминокислот в белках хлоропластов, сделанное на основании последовательностей нуклеотидов их генов, часто не соответствует действительности. Так, в гене rpl2 хлоропластов кукурузы и гене psbL хлоропластов табака находится кодон AСG в том месте, где ожидается расположение наиболее распространенного кодона инициации трансляции ATG. При созревании транскриптов этих генов происходит их посттранскрипционная модификация, сопровождаемая превращением СU. Своеобразный механизм посттранскрипционного редактирования РНК описан для транскриптов генов, кодирующих ионные каналы мозга млекопитающих, которые участвуют в передаче сигналов в синапсах центральной нервной системы. Известно, что субъединицы двух близкородственных классов глутаматных рецепторов содержат в определенных сегментах своих полипептидных цепей, формирующих каналы, остатки глутамина или аргинина, что оказывает существенное влияние на функционирование этих каналов. Оказалось, что субъединицы обоих классов кодируются генами, у которых в соответствующем месте имеется только кодон для глутамина (СAG), хотя в кДНК, полученной с использованием мРНК указанных субъединиц в качестве матрицы, в этом месте обнаружен также и аргининовый кодон СGG. Интересно, что мРНК одной из субъединиц рецептора, принадлежащей на основании аминокислотных последовательностей к одному определенному классу (называемому здесь класс 1), подвергаются редактированию на 100%, тогда как транскрипты трех других субъединиц того же класса вообще не изменяются, несмотря на 90–95%-ную гомологию 30-звенных последовательностей, окружающих редактируемый сайт. Транскрипты двух субъединиц, принадлежащих к другому классу, редактируются с эффективностью соответственно 40 и 80%. Таким образом, во всех этих случаях имеет место количественная регуляция эффективности редактирования мРНК рецепторов мозга, что необходимо для пропорционального внутриклеточного синтеза соответствующих субъединиц. Механизм такой своеобразной регуляции экспрессии генов в настоящее время, к сожалению, не известен. Предполагают, что эдитосомы могут узнавать характерные элементы вторичной структуры мРНК, по-разному подвергающиеся редактированию. Широкая, может быть, даже более широкая, чем мы сейчас представляем себе, распространенность посттранскрипционного редактирования мРНК у живых организмов указывает на этот механизм как на один из обычных способов реализации генетической информации. Использование таких модификаций пре-мРНК функционирующими генетическими системами при экспрессии генов расширяет кодирующий потенциал генома и добавляет еще одну возможность регуляции их функционирования на посттранскрипционном уровне. В табл. I.8 суммированы данные об использовании редактирования мРНК у животных и некоторых их вирусов, которые наглядно демонстрируют распространенность этого явления у данной группы организмов. В заключение рассмотрим еще один наиболее хорошо изученный пример редактирования мРНК аполипопротеина B (ApoB) млекопитающих, участвующего в транспорте холестерина и триглицеридов в крови. Уже давно у млекопитающих обнаружили две формы ApoB, кодируемые одним и тем же геном и образующиеся в результате редактирования ApoB-мРНК (рис. I.11,а). Уникальный ген АpoB человека содержит 29 экзонов, и его общая длина составляет 43 т.п.о. Длина мРНК этого гена, кодирующей ApoB100 с молекулярной массой 512 кДа, составляет 14 тысяч оснований (т.о.). В середине самого большого экзона 26 имеется глутаминовый кодон СAA, который в результате редактирования мРНК превращается в терминирующий кодон UAA. Некоторые из мРНК, подвергшихся редактированию, расщепляются по криптическому (не функционирующему до расщепления) сайту полиаденилирования, что приводит к образованию более короткой Таблица I.8 Редактирование РНК у животных и их вирусов
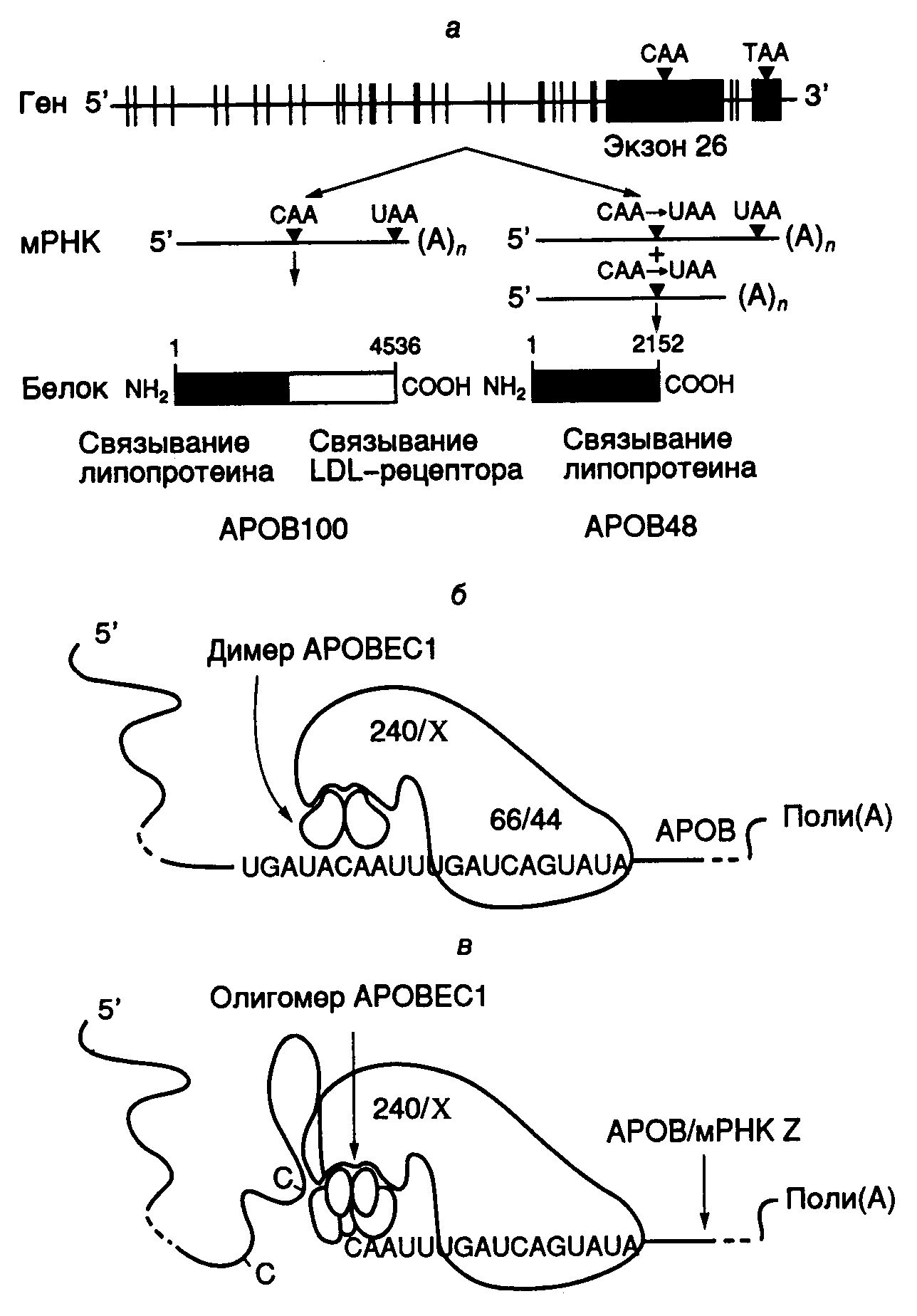 Рис. I.11. Экспрессия гена APOB человека и механизм редактирования его мРНК а – схема экспрессии гена; б – механизм дезаминирования остатка C в APOB-мРНК в результате редактирования с участием эдитосомы; в – нарушение специфичности редактирования APOB-мРНК при олигомеризации каталитической субъединицы APOBEC1. В этих условиях субстратом для эдитосомы могут быть другие мРНК (мРНК Z) мРНК длиной в семь т.о. В результате трансляции редактированных мРНК образуется укороченный ApoB48 (241 кДа), который содержит 2152 N-концевых аминокислотных остатка ApoB100. В функциональном отношении этот белок остается полностью активным, однако у него отсутствует С-концевой домен ApoB100, который отвечает за связывание с рецептором липопротеинов низкой плотности. Молекулярным механизмом редактирования ApoB-мРНК является сайт-специфическое дезаминирование цитозина с помощью цитидиндезаминазы. Недавно клонировали ген, кодирующий этот фермент у человека, и полностью определили его первичную структуру. Показано, что цитидиндезаминаза человека, осуществляющая редактирование ApoB-мРНК, представляет собой димер, построенный из двух идентичных субъединиц (АРОВЕС1) с молекулярной массой 28 кДа. Ген фермента, расположенный на хромосоме 12, экспрессируется исключительно в тонком кишечнике. Специфичность дезаминирования остатка цитозина определяется, по крайней мере, двумя факторами: последовательностью нуклеотидов мРНК в окрестностях этого сайта и белковыми кофакторами, взаимодействующими с каталитической субъединицей цитидиндезаминазы. Перенос методами генной инженерии последовательности нуклеотидов, фланкирующей сайт редактирования, в новые мРНК приводил к тому, что новые рекомбинантные РНК также подвергались специфическому редактированию in vivo и in vitro. В экспериментах такого рода, а также путем замен отдельных нуклеотидов методами направленного мутагенеза определили последовательность нуклеотидов мРНК, отвечающую за специфичность редактирования. Оказалось, что для оптимального осуществления этого процесса необходима последовательность длиной в 55 нуклеотидов, однако и 25 нуклеотидов в окрестностях сайта было достаточно, чтобы редактирование осуществлялось in vitro с 25%-ной эффективностью. Ниже представлены последовательности нуклеотидов в окрестностях сайтов редактирования, которые оказались высокогомологичными у разных видов млекопитающих. С→U * * ** * * * * * Человек Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG Сайт 2 aAaA С AAUссaUGAUСuaсAUuUguuua Бабуин Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG Свинья Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG Кролик Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG Крыса Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAgAG Мышь Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG Звездочками обозначены нуклеотиды, замены которых с помощью направленного мутагенеза наиболее резко снижали эффективность редактирования, а строчными буквами отмечены негомологичные нуклеотиды. Подчеркнута последовательность нуклеотидов, получившая название якорной последовательности (mooring sequence). Эта последовательность является единственным цис-действующим регуляторным элементом, присутствие которого необходимо и достаточно для специфического редактирования вышерасположенного остатка С в экспериментах in vitro. Редактирование ApoB-мРНК здесь происходит после удаления из нее интронов в результате сплайсинга. Эффективность редактирования в таких системах зависит от нуклеотидных последовательностей в окрестностях этого сайта. В частности, АТ-богатые последовательности без выраженной вторичной структуры, фланкирующие якорную последовательность, стимулируют редактирование APOB-мРНК. В связи с тем, что простая 11-звенная якорная последовательность определяет нуклеотид, который редактируется в этой системе, возникает вопрос о дополнительных факторах, которые требуются для обеспечения специфичности функционирования системы редактирования, зависимой от присутствия якорной последовательности. Действительно, перемещение якорной последовательности in vitro к любому остатку C на расстояние трех–четырех нуклеотидов от него в направлении 3’-конца РНК обеспечивает его редактирование in vivo. Предполагается, что в эдитосомах, осуществляющих редактирование ApoB-мРНК, соблюдается определенное соотношение между содержанием APOBEC1-субъединиц и дополнительных факторов-помощников (см. рис. I.11,б). В этой части рисунка показана гипотетическая структура нормальной эдитосомы, осуществляющей редактирование АРОВ-мРНК. Такая эдитосома включает собственно каталитический димер, два полипептида с молекулярными массами 66 и 44 кДа, необходимыми для специфического взаимодействия эдитосомы с якорной последовательностью, а также сопутствующие факторы Х, ассоциированные с белком AUX240 (240 кДа), который регулирует эффективность редактирования мРНК, обеспечивая сборку эдитосомы из белковых компонентов. Сверхэкспрессия APOBEC1-субъединицы в клетках, достигаемая генно-инженерными методами, приводит к изменению специфичности редактирования. Это было объяснено нарушением стехиометрических соотношений между молекулами субъединиц и дополнительными факторами, обеспечивающими специфичность редактирования (см. рис. I.11,в). На рисунке показано, что избыток субъединицы АРОВЕС1 в эдитосоме стимулирует ее к редактированию вышерасположенных остатков С в АpoВ-мРНК, поскольку изменяется характер фолдинга 5’-концевой части редактируемой мРНК. В результате другие остатки С становятся доступными для каталитических субъединиц. В соответствии с вышеизложенным, все известные в настоящее время формы редактирования пре-мРНК можно подразделить на два класса: инсерционное редактирование и редактирование с замещением. В первом случае редактирование мРНК сопровождается вставкой и/или удалением специфических нуклеотидов. Предполагается, что при такой форме редактирования последовательность нуклеотидов мРНК образует гибрид с gРНК, что сопровождается появлением неспаренных и ошибочно спаренных оснований, которые и маркируют сайты редактирования. Далее происходит расщепление углевод-фосфатного остова мРНК по этим сайтам в результате реакции трансэтерификации между фосфатными группами мРНК и встраиваемых нуклеотидов с последующим повторным лигированием образовавшихся фрагментов мРНК, сопровождаемым вставкой или удалением нуклеотидов. Такой механизм реализуется, по крайней мере, в митохондриях некоторых жгутиковых, а также слизневиков. У последних в результате редактирования митохондриальных мРНК имеют место вставки остатков С. Инсерционное редактирование мРНК парамиксовирусов, сопровождающееся вставками остатков G, по-видимому, происходит вследствие ошибок РНК-полимеразы при транскрипции соответствующих генов. В результате редактирования с замещением, как это имеет место в случае редактирования ApoB-мРНК, а также, возможно, мРНК митохондрий и хлоропластов высших растений и ионных каналов, не происходит расщепления фосфодиэфирных связей в редактируемой РНК, а новое азотистое основание синтезируется in situ (т.е. модифицируется непосредственно в ее полинуклеотидной цепи). При этом не используется gРНК. Формально такой механизм напоминает реакции посттранскрипционной модификации азотистых оснований в тРНК, рРНК, малых ядерных РНК, а также двухцепочечных РНК. Каково же биологическое значение механизма редактирования генетической информации на уровне мРНК? Какие силы заставили этот механизм эволюционно закрепиться у большого числа далеко отстоящих друг от друга биологических видов? Почему для организмов выгоднее изменять информацию посттранскрипционно, а не заключать ее непосредственно в генах? Очевидно, что для этого должны быть веские, не вполне понятные сегодня причины, которые не допускают перехода к обычному кодированию такой информации. На мой взгляд, редактирование мРНК может иметь непосредственное отношение к дополнительной стабилизации генетической информации в наиболее уязвимых для мутагенеза генетических локусах. Действительно, редактирование РНК получило наибольшее распространение в хлоропластах и митохондриях высших организмов, а также у одноклеточных эукариот. В разделе 5.3.1 приводится обоснование того, что дополнительная защита генетической информации от разрушительного действия химических мутагенов особенно нужна именно многоклеточным организмам для предотвращения накопления генетического груза в делящихся соматических клетках при онтогенезе. Вероятно, одним из путей достижения этого было эволюционное включение в геном эукариот избыточных последовательностей нуклеотидов. У свободноживущих одноклеточных организмов на популяционном уровне такой проблемы не существует, поскольку гибель отдельной свободноживущей клетки не грозит существованию популяции этих клеток, как это имеет место у Metazoa. Однако у митохондрий и хлоропластов, часто рассматриваемых в качестве внутриклеточных микроорганизмов-эндосимбионтов, наблюдаются совершенно особые условия существования. Несмотря на то что их геном содержит мало избыточных последовательностей и, следовательно, слабо защищен ими от химических мутагенов, мутации в определенных генах митохондрий и хлоропластов могут быть летальными для соматической клетки-хозяина и всего многоклеточного организма. В этих условиях мутационное изменение нуклеотидов, подвергающихся редактированию на уровне РНК, фактически заменяет само редактирование, и такие мутации нейтральны в функциональном отношении. В отсутствие мутаций редактирование корректирует первичную структуру РНК, а при наличии их необходимость в редактировании отпадает. Иными словами, во всех этих локусах редактирование как бы упреждает мутационные замены редактируемых нуклеотидов в генах, которые геном по каким-то причинам не может эффективно предотвратить в силу особенностей структуры и функционирования соответствующих генетических локусов. По аналогии с неоднозначностью генетического кода наличие механизма редактирования допускает сосуществование в конкретных генетических локусах "вырожденных сайтов", различающихся по первичной структуре, но не своему генетическому смыслу. |
