золото. Золото. Реферат по дисциплине Цветные металлы и их сплавы Золото Студент Лосихина О. В. группа озчм191
 Скачать 393.19 Kb. Скачать 393.19 Kb.
|
|
Липецкий государственный технический университет Кафедра металлургических технологий Реферат по дисциплине Цветные металлы и их сплавы «Золото» Студент Лосихина О.В. группа ОЗ-ЧМ-19-1 Руководитель Скаков С.В. Ст.преподаватель Липецк 2021 г. Содержание ВведениеЗолото является элементом побочной подгруппы первой группы, шестого периода периодической таблицы химических элементов Д.И. Менделеева, с атомным номером 79, и обозначено символом Au (лат. Aurum). Простое вещество золото – драгоценный металл желтого цвета. Праславянское золото (рус. золото, ст.-слав. золото, польск. злото) относится к лит. гельтонам "желтый", лат. зельц "золото, золото"; с другим вокалом: гоцк. гюльц, нэм. золото, англ. золото; затем Sanskr. hiraṇyam, Avesta. zaranya, oset. zærījnæ "gold", также Sanskr. hari "yellow, golden, greenish", от пра-индоевропейского корня *ǵʰel- "yellow, green, light". Отсюда и названия цветов: желтый, зеленый. 1 Основные физические и химические свойстваЧистое золото – это мягкий желтый металл. Некоторые золотые изделия, например, монеты, имеют красноватый оттенок примесей из других металлов, особенно меди. Тонкими слоями золото переливается зеленым. Золото обладает чрезвычайно высокой теплопроводностью и низким электрическим сопротивлением. Золото – очень тяжелый металл: плотность чистого золота составляет 19621 кг/м³ (шар из чистого золота диаметром 46 мм имеет массу 1 кг). Среди металлов он занимает шестое место по плотности: после осмия, иридия, рения, платины и плутония. Высокая плотность золота облегчает добычу. Самые простые технологические процессы, такие как промывка замков, могут обеспечить очень высокую степень извлечения золота из промытой породы. Золото – очень мягкий металл: твердость по шкале Мооса около 2,5 (сравнимо с твердостью ногтей), Бринелля 220-250 МПа. Золото также очень пластично: его можно проколоть в листьях толщиной до около 0,1 микрона (сусальное золото); при этой толщине золото является полупрозрачным и имеет желтый цвет в отраженном от прохода свете – помимо желтого окрашивается в синевато-зеленоватый цвет. Золото можно растягивать, образуя проволоку с линейной плотностью до 500 м/г. Золото – самый инертный металл, стоит в серии напряжений с правой стороны всех остальных металлов, при нормальных условиях оно не реагирует с большинством кислот и не образует оксидов, поэтому на драгоценных металлах оно, в отличие от металлов обычных, легко разрушается под воздействием окружающей среды. Затем была обнаружена способность царской водки растворять золото, что потрясло уверенность в ее инерции. Наиболее стабильное состояние окисления золота в соединениях +3, в этом состоянии окисления оно легко образует стабильные плоские квадратные комплексы [AuX4] с однозаряженными анионами (F−, Cl−. CN−). Относительно стабильны также соединения с состоянием окисления +1, образующие линейные комплексы [AuX4]−. Долгое время предполагалось, что +3 это максимально возможное состояние окисления золота, но с помощью дифторида криптона удалось получить соединения Au+5 (фторид AuF5, соли комплекса [AuF6]−). Соединения золота (V) стабильны только с фтором и являются сильнейшими окислителями. Степень окисления +2 для золота нехарактерна: в веществах, где она формально равна 2, половина золота обычно окисляется до +1, а половина до +3, например, правильная ионная формула для сульфата золота (II) AuSO4 не является Au2+(SO4)2- и Au1+Au3+(SO4)2-. Недавно открытые комплексы, в которых золото все еще имеет степень окисления +2. Существуют соединения золота с состоянием окисления -1, например, CsAu (ауред цезия) Na3Au (ауред натрия). Эти соединения называются ауридами. Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте: 2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O Золото относительно легко вступает в реакцию с кислородом и другими окислителями посредством комплексообразующих веществ. В водных растворах цианидов золото растворяется в присутствии кислорода, образуя цианараты: 4Au + 8CN− + 2H2O + O2 → 4[Au(CN)2]− + 4OH− Цианоаураты легко извлекаются в чистое золото: 2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au В случае реакции с хлором, реакция также значительно облегчается возможностью сложного образования: при реакции золота с сухим хлором при температуре около 200 °С с образованием хлористого золота (III) золото растворяется в концентрированном водном растворе соляной и азотной кислоты (царская водка) при комнатной температуре с образованием ионов хлор-уровневой кислоты: 2Au + 3Cl2 + 2Cl− → 2[AuCl4]− Золото легко вступает в реакцию с жидким бромом и его растворами в воде и органических растворителях, образуя трибромид AuBr3 [4]. Золото вступает в реакцию с фтором в температурном диапазоне 300-400 °C, при более низких температурах реакции не происходят, при более высоких фторидах золото разлагается. Золото также растворяется в ртути, образуя легкоплавкий сплав (амальгаму), содержащий интерметаллические соединения. Существуют хлорорганические соединения золота (например, диэтилсолит бромид). Некоторые золотые соединения токсичны и накапливаются в почках, печени, селезенке и гипоталамусе, что может привести к органическим заболеваниям и дерматиту, стоматиту, тромбоцитопению. Соединения органического золота (кризанол и препараты ауранофина) используются в медицине для лечения аутоиммунных заболеваний, особенно ревматоидного артрита. 2 Применение в быту и промышленностиТысячелетиями золото использовалось для производства ювелирных украшений и монет, а применение золота для зубопротезирования известно еще древним египтянам. Применение золота в стекольной промышленности известно с конца XVII в. Золотую фольгу, а позднее гальванопокрытия золотом широко применяли для золочения куполов церковных храмов. Лишь последние 40–45 лет можно отнести к периоду чисто технического применения золота. Золото очень технологично, из него легко изготавливают сверхтонкую фольгу и микронную проволоку. Покрытия золотом легко наносят на металлы и керамику. Золото хорошо паяется и сваривается под давлением. Такая совокупность полезных свойств послужила причиной широкого использования золота в важнейших современных отраслях техники: электронике, технике связи, космической и авиационной технике, химии. В микроэлектронике широко применяют пасты на основе золота с различным электросопротивлением. Широкое использование золота и его сплавов для контактов слаботочной аппаратуры обусловлено его высокими электрическими и коррозионными свойствами. Серебро, платина и их сплавы при использовании в качестве контактов, коммутирующих микротоки при микронапряжениях, дают гораздо худшие результаты. Серебро быстро тускнеет в атмосфере, загрязненной сероводородом, а платина полимеризует органические соединения. Золото свободно от этих недостатков, и контакты из его сплавов обеспечивают высокую надежность и длительный срок службы. Золотые сплавы применяют в производстве часовых корпусов и перьев для авторучек. В медицине используют не только зубопротезные золотые сплавы, но и медицинские препараты, содержащие соли золота, для различных целей, например при лечении туберкулеза. Радиоактивное золото используют при лечении злокачественных опухолей. В научных исследованиях золото используют для захвата медленных нейтронов. С помощью радиоактивных изотопов золота изучают диффузионные процессы в металлах и сплавах. Золото применяют для металлизации оконных стекол зданий. В жаркие летние месяцы через оконные стекла зданий проходит значительное количество инфракрасного излучения. В этих обстоятельствах тонкая пленка (0.13 мкм) отражает инфракрасное излучение и в помещении становится значительно прохладнее. Если через такое стекло пропустить ток, то оно обретет противотуманные свойства. Покрытые золотом смотровые стекла судов, электровозов и т.д. эффективны в любое время года. Золотой припой очень хорошо подходит для смачивания различных металлических поверхностей и используется при пайке металлов. Тонкие уплотнения из сплавов мягкого золота используются в технологии сверхвысокого вакуума. В качестве метода защиты от коррозии широко используется металлическое золочение (в древности - исключительно амальгамный метод, сегодня - преимущественно гальванический). Хотя такое покрытие цветных металлов имеет существенные недостатки (мягкое покрытие, высокий потенциал точечной коррозии), оно также распространено, так как конечный продукт имеет форму очень дорогого "золота". Золото зарегистрировано как пищевая добавка Е175.  Рисунок 1 – Применение золота 3 Распространенность в природеСодержание золота в земной коре очень низкое 0,5-5 мкг/кг, но имеются многочисленные месторождения и участки, сильно обогащенные металлом. Золото также содержится в воде. 1 л морской и речной воды несет около 4×10-9 г золота, что эквивалентно 4 кг золота на 1 куб. км воды. Залежи золота встречаются в основном в районах разработки гранитоидов, небольшое количество которых связано с породами подстилающих и ультраосновных пород. Золото образует промышленные концентрации в постмагматических, в основном гидротермальных, месторождениях. В экзогенных условиях видимое золото является очень стабильным элементом и легко накапливается в россыпях. Субмикроскопическое золото, в составе сульфидов, мигрирует во время окисления сульфидов в зоне окисления. В результате золото накапливается во вторичной зоне обогащения сульфидами, но его максимальные концентрации связаны с накоплением в зоне окисления, где оно связано с гидроксидами железа и марганца. Миграция золота в зоне окисления сульфидных месторождений происходит в виде бромистых и йодидных соединений в ионной форме. Некоторые ученые допускают растворение и перенос золота сульфатом окиси железа или в виде суспензионной суспензии. В природе известны 15 золотоносных минералов: нативное золото с примесями серебра, меди и т.д., электротрума Au и 25-45% Ag; порезит AuPd; медное золото, висмутоаурит (Au, Bi); березовое золото, иридиевое золото, платиновое золото. Другие минералы - теллуридное золото: кальворит AuTe2, краннерит AuTe2, сильванит Ag3AuTe2, петцит Ag3AuTe2, мутманит (Ag, Au)Te, ширина мантии Au2Te3, нагиагит Pb5AuSbTe3S6. Золото характеризуется своей оригинальной формой. Среди других форм стоит отметить электротрум - сплав золота и серебра, который имеет зеленоватый оттенок и относительно легко ломается при ношении с водой. В горных породах золото обычно разбрасывается на атомном уровне. В месторождениях он часто инкапсулируется в сульфиды и арсениды. Различают первичные месторождения золота, россыпи, в которые оно попадает в результате разрушения рудных месторождений, и месторождения сложных руд, в которых золото добывается как побочный компонент. Наиболее крупными запасами драгметалла обладают несколько стран, в их числе: ЮАР, США, Канада, Австралия, Индонезия и Россия. В Российской Федерации запасы желтого металла учитываются по 372 коренным и 5000 россыпным месторождениям. К самым большим месторождениям золота в мире относятся: Pebble Deposit — США, Аляска, добыча не ведется; Наталка – Россия, Колыма, добыча не ведется; Grasberg – Индонезия, добыча ведется. Все запасы золота все России оцениваются примерно в 12,5 тысяч тонн драгметалла, из них более 60% составляют запасы промышленного значения, относящиеся к категориям A, В и С1 – детально разведанные, предварительно разведанные и запасы разведанных месторождений сложного геологического строения. Большая часть золота в России добывается на золоторудных месторождениях (70%), а остальное – на россыпях (20%) и комплексных месторождениях с другими металлами (10%). Производство золота ведется в 26 регионах России, но основные запасы и добыча сконцентрированы на территории Восточной Сибири и Дальнего Востока. На Красноярский и Хабаровский края, Иркутскую, Магаданскую и Амурскую области, Якутию и Чукотку приходится 85% производства. В этих регионах расположены крупнейшие месторождения золота в стране – Олимпиада, Благодатное, Павлик, Албазинское. В Красноярском крае кроме добычи на золоторудных месторождениях значительную роль играет попутное золото, добываемое на медно-никелевых залежах. 4 Схема добычи и производстваЗолото производится с использованием его основных физико-химических свойств: Наличие в природе в родном состоянии, способность реагировать лишь с несколькими веществами (ртуть, цианиды). С развитием современных технологий все большую популярность приобретают химические методы. Промывка. Метод промывки основан на высокой плотности золота, которое вымывает в потоке воды минералы, менее плотные, чем золото (а это почти все минералы в земной коре), а металл концентрируется в тяжелой фракции, песке, который состоит из минералов высокой плотности, называемых шлихом. Этот процесс называется промывкой слизи или похудением. В небольших количествах это можно сделать вручную с помощью промывочной чаши. Этот метод используется с древних времен и до сих пор используется шахтерами для извлечения небольших месторождений мыла, но его основное применение - поиск месторождений золота, алмазов и других драгоценных металлов. Промывка используется для разработки крупных месторождений мыльной воды, но используется специальное техническое оборудование: экскаваторы и моечное оборудование. За исключением золота, полученные шламы содержат ряд других плотных минералов, из которых извлекается металл, например, путем плавления. Все месторождения россыпного золота разрабатываются методом промывки, и их использование ограничено коренными месторождениями. Для этого камень измельчают, а затем промывают. Этот метод не может применяться в залежах с рассеянным золотом, где оно распределяется в породе таким образом, что после дробления не разделяется на отдельные зерна и во время промывки промывается вместе с другими минералами. К сожалению, во время стирки теряется не только мелкое золото, которое легко смывается с моечной палубы, но и большие самородки, которые из-за своей гидравлической крупности не могут спокойно уместиться в ячейках ковра. Поэтому необходимо следить за тем, чтобы на экскаваторах и промышленном оборудовании не оставалось крупного катящегося мусора - это могут быть самородки. Слияние. Метод амальгамации основан на способности ртути образовывать сплавы - амальгамы с различными металлами, в том числе с золотом. В этом методе увлажненную, измельченную породу смешивали с ртутью и дополнительно измельчали в мельницах - бегущих чашах. Золотую амальгаму извлекали из образовавшегося шлама путем промывки, после чего из собранной амальгамы дистиллировали ртуть и повторно использовали. Известно, что наибольшее количество ртути было приобретено в американских колониях Испании начиная с XVI века до нашей эры: Это стало возможным благодаря наличию в Испании огромного месторождения ртути - Альмадена. В более поздние времена использовался метод внешнего слияния, при котором измельченная золотоносная порода проходила при промывке через обогатительные шлюзы, облицованные медными листами, покрытыми тонким слоем ртути. Способ слияния применим только к месторождениям с высоким содержанием золота или уже в момент его обогащения. В настоящее время он используется очень редко, в основном шахтерами в Африке и Южной Америке. Цианирование. Золото растворяется в растворах синильной кислоты и ее солей, и это свойство привело к ряду методов добычи путем цианирования руд. Способ цианирования основан на реакции золота с цианидами в присутствии атмосферного кислорода: измельченную золотоносную породу обрабатывают разбавленным (0.3-0.03 %) раствором цианида натрия, золото из полученного раствора цианида натрия Na[Au(CN)2] осаждают либо цинковой пылью, либо специальными ионообменными смолами. Метод цианирования первоначально применялся на крупных предприятиях, где горная порода дробилась, а цианирование осуществлялось в специальных чанах. Однако развитие технологии привело к методу кучного выщелачивания, который заключается в подготовке водонепроницаемого участка, выливании на него руды и орошении ее цианидными растворами, которые, просачиваясь сквозь толщу породы, растворяют золото. Затем они идут в специальные сорбционные колонны, где кладут золото, а восстановленный раствор отправляют обратно в кучу. Способ цианирования ограничивается минеральным составом руд, он неприменим, если руда содержит большое количество сульфидов или арсенидов, так как цианиды вступают в реакцию с этими минералами. Поэтому цианирование подразумевает переработку низкосернистых руд или руд из зоны окисления, в которой сульфиды и арсениды окисляются атмосферным кислородом. Для извлечения золота из сульфидных руд используются сложные многоступенчатые технологии. Добываемое из месторождений золото содержит различные примеси, поэтому оно подвергается специальным процессам высокой степени очистки, которые проводятся на аффинажных заводах. Золото является важнейшим элементом мировой финансовой системы, поскольку оно не подвержено коррозии, имеет множество технических применений, а его запасы низки. Золото практически никогда не теряется в исторических катастрофах, а только накапливается и плавится. В настоящее время золотые запасы Всемирного банка оцениваются в 32 тысячи тонн золота (если расплавить все это золото вместе, то получится куб со стороной всего 12 метров). Золото долгое время использовалось как деньги многими народами. Золотые монеты являются наиболее хорошо сохранившимся памятником древнего мира. Однако золотые монеты закрепились в качестве монопольных денег лишь в XIX веке. До Первой мировой войны все мировые валюты основывались на золотом стандарте (период 1870-1914 гг. называется "Золотой Век"). Бумажные купюры в это время служили золотыми сертификатами. Их свободно обменяли на золото. 5 ЗадачиЗадание 1. По данным элементного анализа (% масс.) рассчитать рациональный минералогический состав медного халькопирит-пиритного концентрата Расчет здесь и в дальнейшем ведется на 100 кг шихты. Химический состав концентрата: 15,2% Сu, 44% Fe, 36,5% S, 2,4% Zn, 1,9% прочие элементы. Основные минералы: сфалерит, борнит, пирит, пирротин. Определение количества серы в сфалерите. Формула минерала: ZnS. Атомная масса: цинк – 65,39 г/моль; сера – 32,06 г/моль. По данным химического анализа, в концентрате 2,4 % цинка или 2,4 кг по расчету на 100 кг концентрата. Цинк содержится в единственном минерале – сфалерите. Тогда, масса серы в сфалерите составит: 65,39 г/моль цинка 32,06 г/моль серы 2,4 кг цинка Х1 кг серы Масса серы в сфалерите: Х1 = (2,4∙32,06)/65,39 = 1,18 кг. Всего масса сфалерита: 2,4 +1,18 = 3,58 кг. Определение количества меди в борните. Формула минерала: CuFe2S3. Атомная масса: медь – 63,55 г/моль; железо – 55,85 г/моль; сера – 32,06 г/моль. Общая атомная масса соединения 63,55+55,85·2+32,06∙3=271,43 г/моль. Содержание в борните меди: (63,55 ∙ 100)/271,43 = 23,41 %. Содержание в борните серы: (32,06 ∙ 3 ∙ 100)/271,43 = 35,43 % Содержание в борните железа: (55,85 ∙ 2 · 100)/271,43 = 41,15 % По данным химического анализа, в концентрате 15,2 % меди или 15,2 кг по расчету на 100 кг концентрата. Медь содержится в единственном минерале – борните, соответственно, общая масса борнита Х2 борнита – 100 % 15,2 кг меди – 23,41 % Х2 = (15,2∙100)/23,41 = 64,93 кг Количество железа в борните: 64,93 борнита – 100 % X’ кг железа – 41,15 % Х’= 41,15 · 64,93/100 = 26,72 кг Количество серы в борните: 64,93 – 15,2 – 26,72=23,01 кг. Пирит и пирротин. Оставшееся железо и сера распределяются между двумя минералами – пиритом (FeS2) и пирротином (Fe7S8). Масса железа в 100 кг концентрата – 44 кг; серы – 36,5 кг. Оставшееся железо: 44 – 26,72 (железо в борните) = 17,28 кг Оставшаяся сера: 36,5 – 1,18 (сера в сфалерите) – 23,01 (сера в борните) = 12,31 кг Обозначим массу железа в пирите Y. Тогда масса железа в пирротине (17,28 – Y). Пирит FeS2. Атомная масса: железо – 55,85 г/моль; сера – 32,06 г/моль. 55,85 г/моль железа свяжет 32,06∙2 = 64,12 г/моль серы Y кг железа свяжет - Z1 кг cеры Z1 = (Y ∙ 64,12) / 55,85 Пирротин Fe7S8. Атомная масса: железо – 55,85 г/моль; сера – 32,06 г/моль. 55,85∙7 = 390,95 г/моль железа свяжет 32,06∙8 =256,48 г/моль серы (17,28 – Y) железа свяжет - Z2 кг cеры Z2 = (17,28-Y) ∙ 256,48/390,95 Z1 + Z2 = 12,31 кг серы Составляем уравнение: (Y ∙ 64,12)/55,85 + (17,28-Y)∙ 256,48/390,95 = 12,31 Откуда Y = 1,98 кг – это масса железа в пирите, тогда масса железа в пирротине: 17,28-1,98 = 15,3 кг. Сера в пирите: Z1 = (1,98 ∙ 64,12)/55,85 = 2,27 кг. Сера в пирротине: Z2 = 12,31-2,27 = 10,04 кг. По итогам расчета заполняем таблицу рационального состава (таблица 1). Таблица 1 – Рациональный состав концентрата
Задание 2. Рассчитать материальный баланс процесса агломерации окисленной никелевой руды. Определить выход валового агломерата, его состав; Состав, расход и точку росы отходящих газов. Таблица 2 – Состав сухой никелевой руды, %
Таблица 3 – Состав золы коксика, %
Таблица 4 – Параметры по варианту
Определяем расход воздуха для горения коксика. Для этого принимаем, что в агломерат из коксика переходит 50% S и 8% С, т.е. получаем 0,9•0,5•0,096=0,04 кг серы и 84,9•0,08•0,096=0,65 кг углерода. В этом случае потребуется кислорода: для сгорания углерода в СО2 [(84,9/9,6–0,65)/12]•32=21,84 кг, для сгорания серы в SO2 (0,04/32)•32=0,04 кг, Всего 21,89 кг. С кислородом поступит азота (21,89/23)•77=73,28 кг. Теоретический расход воздуха 21,89+73,28=95,16 кг, или 95,16/1,293=73,60 м3, в том числе азота 73,60–(21,89/32)•22,4=58,28 м3. Для сжигания коксика подают воздух при α=1,5. Тогда потребуется кислорода 21,89•1,5=32,83 кг, в том числе избыток кислорода 10,94 кг. Поступит азота 73,28•1,5=109,91 кг (или 87,93 м3). Всего поступит воздуха 73,60•1,5=110,40 м3. Определим состав отходящих газов. Коксик на агломерацию поступает с содержанием 9,6 % влаги. Масса влажного коксика 9,6/(100-5,4)·100=10,15 кг, в том числе влаги 0,55 кг. Состав и количество продуктов от сгорания 10 кг коксика: При сгорании углерода в СО2 [(84,9/9,6-0,65)/12,0]•44=30,04 кг. При сгорании серы в SO2 (0,04/32)•64=0,09 кг. Влага руды и коксика 3,111+0,55=3,66 кг. Углекислота руды составляет 1,01 кг (соответствует по эквиваленту 1,3 кг СаО руды). Всего СО2 получаем 31,04 кг. Для зажигания шихты используем природный, который необходимо сжигать в подвесном горне с избытком воздуха (в отходящих газах горна должно быть 8–12% О2), чтобы температура пламени над шихтой не превышала 1200С. Продуктами горения природного газа пренебрегаем. Состав и количество продуктов сгорания без газов зажигательного горна: кг м3 % (объемн.) СО2 31,04 (31,04/44)•22,4=15,80 13,63 SO2 0,09 (0,09/65)•22,4=0,03 0,03 Н2О 3,66 (3,66/18)•22,4=4,55 3,93 О2 10,94 (10,94/32)•22,4=7,66 6,61 N2 109,91 (109,91/28) • 22,4=87,93 75,82 Итого 115,98 100,0 Подсос воздуха до эксгаустера рекомендуется принимать в пределах 60–100% от объема газов. Для нашего примера принимаем 92% от объема газа, что составляет 115,98•0,92=106,70 м3 воздуха, в том числе кислорода 106,70•0,21=22,41 м3, и азота 106,70•0,79=84,29 м3. Состав и количество газов с учётом воздуха, просасываемого через щели: м3 % (объемн) СО2 15,80 7,10 SО2 0,03 0,01 Н2О 4,55 2,04 О2 30,07 13,50 N2 172,22 77,34 Итого 222,68 100 Состав и масса золы, образующейся при сгорании 10 кг коксика: SiO2 50•0,142•0,096=0,68 кг; А12О3 30•0,142•0,096=0,41 кг; СаО 5•0,142•0,096=0,07 кг; Fe2O3 11•0,142•0,096=0,15 кг; прочие 4•0,142•0,096=0,05 кг. Всего 1,36 кг. Задание 3. Рассчитать требуемое количество ступеней экстракции и концентрацию извлекаемого металла на выходе из противоточного многоступенчатого экстрактора Таблица 5 – Исходные данные
Определить: число ступеней (n) экстракции. Расчет извлечение при экстракции: 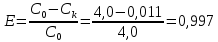 Расчет критической величины коэффициента экстракции 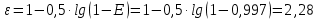 Определение оптимального соотношения потоков. Результат округляется до десятых в большую сторону 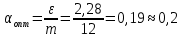 Определение уточненной величины коэффициента экстракции 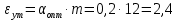 Расчет необходимого теоретического числа ступеней экстракции. Результат округляется до целых в большую сторону 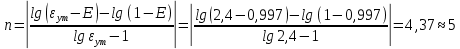 Задание 4. Рассчитать процесс очистки сульфатного никелевого электролита от примесей железа, меди и кобальта. Определить расходы реагентов и удельные потери никеля в каждой ступени Таблица 6 – Исходные данные
Очистка от железа. Расчет ведем на 100 м3 анолита. С ним поступает 0,58•100=58 кг железа. Окисление железа рассчитываем при условии окисления хлором и кислородом воздуха по реакциям 2FeSO4 + С12 + H2SO4 = Fe2(SO4)3 + 2HC1; 2FeSO4 + 1/2O2 + H2O = 2Fe(OH)SO4; 2Fe(OH)SO4 + 4H2O = 2Fe(OH)3 + 2H2SO4; Fe2(SO4)3 + 6H2O = 2Fe(OH)3 + 3H2SO4. Окисление хлором может происходить в кислой среде и продолжается всего 15–20 мин. Окисление кислородом воздуха может происходить только в среде с рН=3,5÷4,0 и продолжается не менее 1 ч. Полное осаждение железа достигается при этом же значении рН. Поэтому практически вся кислота, имеющаяся в анолите и образующаяся во время гидролиза, должна быть нейтрализована карбонатом никеля. Определяем расход хлора на окисление 1 кг железа по реакции, записанной выше: х=1•71/112=0,63 кг. Практический расход составляет 0,75–0,8 кг. Расход кислорода не определяем, так как воздух подается для перемешивания с большим избытком по сравнению с необходимым для окисления. Если необходимо окислить не только железо, но и мышьяк, то применяют последовательное окисление хлором и кислородом. Определяем количество кислоты, образующейся во время гидролиза при окислении кислородом: х=2•98•58/112=101,5. Количество кислоты в анолите по условию составляет 0,56•100=56 кг. Всего требуется нейтрализовать кислоты 101,5+56=157,5 кг. Расход никеля в виде карбоната по реакции NiCO3 + H2SO4 = NiSO4 + СО2 + Н2О составит х=59•157,5/98=94,82 кг. Кроме того, потребуется избыток карбоната. Обычно отношение железа и никеля в осадке близко к единице. Это значит, что еще потребуется около 50 кг никеля в виде карбоната и всего необходимо израсходовать 94,82+50=144,82 кг никеля. В осадке будет содержаться 58/56•107=110,82 кг Fe(OH)3 и 58/59•119=116,98 кг NiCO3. Всего твердого 227,8 кг. Влажность такого осадка обычно равна 50–55%, т.е. в данном случае в нем будет содержаться около 200 кг раствора. Чтобы не терять никель, осадок подвергают репульпации и фильтрации. В конечном сухом осадке отношение железа к никелю равно 3 при содержании железа около 30%. Отсюда следует, что потери никеля с железным кеком, считая от анодов, составят 2,2•100/3/91,2=0,8%, где 2,2 – содержание железа в анодах; 91,2 – содержание никеля в анодах. В очищенном растворе остается железа 0,2–0,3 мг/л. Вместе с железом необходимо вывести из цикла мышьяк. Очистка от меди. Очистка от меди производится способом, получившим название «цементация». Суть способа видна из следующей реакции: CuSO4+Ni=NiSO4+Сu. Для быстрого и полного протекания реакции никель подают в виде активного порошка. Под активностью понимают долю никеля, способную вступать в реакцию с медью. Обычно активность колеблется в пределах 75–85%. Очистка производится в непрерывном режиме в 2–3 стадии в аппаратах с механическим перемешиванием или с кипящим слоем. В последнем случае агентом-носителем служит очищаемый раствор. Осаждение меди заканчивается за 15–20 мин. По заданию требуется осадить 1,05•100=105 кг меди. Коэффициент использования порошка определяем по формуле проф. А. А. Цейдлера: 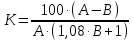 где А – отношение никель:медь в порошке; В – то же, в цементном осадке. По данным практики принимаем, что А=80/4=20; В=15:75=0,2. Тогда 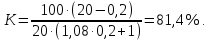 Отсюда коэффициент избытка равен 100/81,4=1,23. На осаждение 105 кг меди требуется порошка 105•(59/64)•(1/0,8)•1,23=148,62 кг. Здесь: 59 и 64 – атомные массы никеля и меди; 0,8 – содержание никеля в 1 кг порошка, кг. Во время осаждения 105 кг меди в раствор перейдет 105•59/64=96,80 кг никеля. Выход цементной меди по расчету составит 148,62–96,80+105=156,82 кг. Но фактический выход будет несколько меньше вследствие выноса и вымывания механических включений в порошок (золы восстановителя, сам восстановитель, песчинки от футеровки печи для восстановления). Фактическое содержание меди в осадке равно около 75%, а не 66% по расчету. Вводим поправку в подсчет выхода осадка: 156,82•66/75=138 кг. Потери никеля в цементной меди составят (4,3•0,8•100)/(5•91,2)=0,75%, где 4,3 – содержание меди в анодах; 5 – отношение медь:никель в осадке цементной меди; 0,8 – коэффициент перехода меди в раствор; 91,2 – содержание никеля в анодах. В очищенном растворе остается меди около 1 мг/л. Иногда столь глубокая очистка от меди не удается. Тогда прибегают к тонкой доочистке при помощи коллоидного раствора серы в щелочи. Очистка от кобальта. Эта стадия очистки основана на образовании малорастворимого осадка Со(ОН)3 после окисления присутствующего в анолите двухвалентного кобальта хлором. Основные реакции окисления, гидролиза, нейтрализации, а также суммарную реакцию можно записать в следующем виде: 2СоС12 + С12 = 2СоС13; 2СоС13 + 6Н2О = 2Со(ОН)3 + 6НС1; 6НС1 + 3NiCO3 = 3NiCl2 + ЗСО2 + ЗН2О; 2CoCl2 + Cl2 + 3NiCO3 + ЗН2О = 2Со(ОН)3 + 3NiCl2 + ЗСО2. Теоретический расход хлора на окисление можно (с небольшим округлением) считать равным 0,6 кг на 1 кг Со. Фактический расход в три-четыре раза превышает теоретический. Расход карбоната примерно вдвое превышает теоретический, поскольку отношение Ni:Со в получаемом осадке близко к единице. Степень осаждения кобальта высокая. В очищенном растворе остается кобальта 5–15 мг/л, что в данном примере соответствует осаждению на 97–99%. В нашем случае необходимо удалить 0,54•100•0,98=52,92 кг Со. Теоретический расход реагентов равен Сl 52,92•0,6=31,75 кг; Ni 52,92•1,5=79,38 кг. Фактический расход хлора составит 31,75•4=127,01 кг; никеля 79,38+52,92=132,30 кг. В первичный кек перейдет 52,92•110/59=98,66 кг Со(ОН)3 и 52,92•119/59=106,74 кг NiCO3. Всего получится осадка 98,66+106,74=205,40 кг. Влаги в нем 50%, или 205,40 кг. Итого осадка 410,80 кг. Первичный кек подвергается репульпации в растворе H2SO4. При этом никель растворяется на 95%. В осадке – кобальтовом концентрате – остается 52,92•(1–0,95)=2,65 кг никеля. Отношение Со:Ni в кобальтовом концентрате равно 52,92/2,65=20. Потери никеля в этом осадке, определяемые так же, как в медном и железном осадках, составят (2,3•0,95•100)/(20•91,2)=0,12%. ЗаключениеВ 2005 году Рик Мунаррис задался вопросом, выгоднее ли инвестировать в Google, который владеет одноименной поисковой системой, или в золото. В то время цена 1 акции Google и 1 унции золота на бирже была одинаковой. В конце 2008 года Google закрылся на 307 долларов за акцию, а золото - на 866 долларов за унцию. Россия – один из мировых лидеров золотодобывающей отрасли. Общемировые запасы золота – 50-63 тыс. т., по их размеру Россия занимает 1-3 место в мире (5-7,5 тыс. т. или 10-12%) в зависимости от методики оценки запасов. Среди других стран по запасам золота выделяются: Канада, ЮАР, США, Мексика и Австралия. Ежегодно в мире добывается 3,5 тыс. тонн золота, в 2019 г. Россия вышла на 2 место после Китая с 9% долей. К крупнейшим золотодобывающим странам также относятся: Австралия, США и Канада. За последние 10 лет (2010-2019 гг.) мировой рынок добычи золота вырос на 25%. Россия демонстрирует наибольшие темпы роста среди стран-производителей (+126 т. или +62%). Активно увеличивается производство в африканских государствах (за исключением ЮАР), Австралии, Канаде и постсоветских республиках – Узбекистане и Казахстане. Список использованной литературы1. Чугаев, Л.В. Металлургия благородных металлов / Л.В. Чугаева. - Москва: Металлургия, 2007. – 301 с. 2. Глинка, Н.Л. Общая химия: учебное пособие для вузов / Н.Л. Глинка. – Москва: Химия, 1977. – 197 с. 3. Фигуровский, Н.А. Открытие элементов и происхождение их названий / Н.А. Фигуровский. – Москва: Наука, 2007. – 228 с. 4. Определение в компонентах водных экосистем золота и других элементов методом нейтронноактивационного анализа // Вода: технология и экология. 2018. № 2. с. 62—68. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
