Реферат на тему «Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель pH. Кислотно-основные индик. Реферат по химии. Реферат по дисциплине Химия на тему Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель pH. Кислотноосновные индикаторы
 Скачать 69.34 Kb. Скачать 69.34 Kb.
|
ФАКУЛЬТЕТ ЛесотехническийКАФЕДРА ЛТ9 «Химия и химические технологии в лесном комплексе»РЕФЕРАТ ПО ДИСЦИПЛИНЕ: Химия НА ТЕМУ: «Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель pH. Кислотно-основные индикаторы»
Москва 2022 СОДЕРЖАНИЕ ВВЕДЕНИЕ………………………………………………………………………. 3 1. Теория электролитической диссоциации………………………………..........4 2. Ионное произведение воды. Водородный показатель pH…………………...7 3. Кислотно-основные индикаторы……………………………………………..11 ЗАКЛЮЧЕНИЕ…………………………………………………………………. 13 СПИСОК ЛИТЕРАТУРЫ……………………………………………………… 14 ВВЕДЕНИЕ Явления диссоциации химикам были известны; например, при нагревании хлорида аммония: он возгоняется с одновременной диссоциацией на две молекулы: NH4Cl ® NH3+ HCl. Но распад при нагревании было объяснить намного легче: энергия, необходимая для диссоциации, черпается за счет тепловой энергии. А вот откуда берется энергия при растворении соли в воде при комнатной температуре, никто объяснить не мог (температура раствора часто почти не меняется). Более того, при растворении некоторых солей в воде раствор сильно нагревается! Непонятно было также, как и на что может распадаться в растворе поваренная соль – ведь не на натрий же и хлор! В 1887 году шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду. Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации Цель данного реферата дать определение таким понятиям, как: электролитическая диссоциация, ионное произведение воды, водородный показатель рН. И рассмотреть назначение кислотно-основных индикаторов. 1. Теория электролитической диссоциации В растворе электролита имеет место электролитическая диссоциация с образованием ионов. Эта идея была выдвинута С.Аррениусом. Диссоциация — самопроизвольный распад электролита на ионы. Положительно заряженные ионы — катионы отрицательно заряженные анионами. Распад электролитов на ионы объясняет отклонения от законов Рауля и Вант-Гоффа. Так, хлорид натрия переходит в раствор в виде ионов Na+ и Cl‾. При этом из одного моля NaCl получается не 6,02 .1023 частиц, а вдвое больше. Поэтому и понижение температуры замерзания в растворе NaCl должно быть вдвое больше, чем в растворе неэлектролита той же концентрации. Точно так же в очень разбавленном растворе BaCl2, диссоциирующего по уравнению BaCl2 = Ba2+ + 2Cl‾, осмотическое давление оказывается в 3 раза больше чем, если бы хлорид бария находится в нем в виде молекул BaCl2. Таким образом, особенности водных растворов электролитов, противоречащие с первого взгляда законам Рауля и Вант-Гоффа, были объяснены на основе этих же законов. Однако теория Аррениуса не учитывала всей сложности явлений в растворах. Она рассматривала ионы как независимые от растворителя частицы. Но ей противостоялагидратная теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. Кажущееся противоречие обеих теорий было устранено предположением о гидратации ионов (И.А. Каблуков). Развитие этой идеи привело к объединению теорий Аррениуса и Менделеева. Распадаться на ионы могут только те молекулы, в которых химическая связь имеет достаточно высокую степень ионности. Чтобы ионы молекулы электролита меньше притягивались друг к другу, растворитель должен обладать высоким значением относительной диэлектрической проницаемости (ε). Распаду электролита способствуют растворители с высоким значением ε. К ним относится вода (ε = 80,1), уксусная кислота (ε = 57), этиловый спирт (ε = 25). Вещества могут распадаться на ионы и при расплавлении, когда энергии теплового движения оказывается достаточно для разрыва полярных связей. Таким образом, электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении. В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая. В одном - диссоциация протекает при растворении веществ с ионной структурой, в другом - при растворении веществ с полярной связью. Когда кристалл соли с ионной связью попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (это ион дипольное взаимодействие). Ионы вещества и молекулы воды притягиваются друг к другу противоположными полюсами. Ионы испытывают тепловые колебания и толчки со стороны молекул воды и этого достаточно, чтобы ионы перешли из кристалла в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой и таким образом происходит растворение кристаллических веществ с ионной связью. Полярные молекулы растворяющихся веществ притягивают к себе полярные молекулы воды за счет диполь – дипольного взаимодействия, вызывая расхождение полюсов молекулы вещества. Происходит поляризация молекулы, которая совместно с колебательным движением атомов и тепловым движением молекул воды приводит к распаду полярной молекулы на ионы. Образующиеся в обоих случаях ионы гидратируются. При этом ион водорода Н+ (протон) прочно связывается с молекулой воды в ион гидроксония Н3О+. Схематически это можно представить уравнением: Н2О + НCl = Н3О+ + Cl‾. В результате этого процесса общая пара электронов молекулы НCl остается у атома хлора, который превращается в ион Cl‾, а протон, внедряясь в электронную оболочку кислорода молекулы воды, образует ион гидроксония Н3О+. Протон водорода благодаря малым размерам и электростатическому полю высокой напряженности, а также отсутствию у него электронной оболочки, в водных растворах существует только в виде комплексов с молекулами воды Н3О+ окруженных другими молекулами воды. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В случае другого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов. 2. Ионное произведение воды. Водородный показатель pH Вода – слабый амфотерный электролит. И как слабый электролит в незначительной степени диссоциирует на ионы, которые находятся в равновесии с недиссоциированными молекулами: H2O <-> H+ + OH- KH2O = (H+)(OH-)/ (H2O) Учитывая значение константы диссоциации воды и концентрацию недиссоциированных молекул воды в моль/л, получим выражение, называемое ионным произведением воды: KH2O = (H+)(OH-)= 10-14 Постоянство произведения (H+)(OH-) означает, что в любом водном растворе ни концентрация ионов водорода, ни концентрация гидроксид-ионов не может быть равна нулю. В чистой воде: (H+)= (OH-)= 10-7 моль/л. Если в неё добавить кислоту, то (H+)станет больше 10-7, а (OH-)меньше. И наоборот. Из постоянства произведения (H+)(OH-) следует, что при увеличении концентрации одного из ионов воды соответственно уменьшает концентрация другого иона. Это позволяет вычислить концентрацию одного вида ионов, когда известна концентрация другого. Концентрации ионов водорода, выраженные в моль/л, обычно составляют малые доли единицы. Использование таких чисел не всегда удобно. Поэтому введена особая единица измерения концентрации ионов водорода, называемая водородным показателем и обозначается рН. Водородный показатель рН — отрицательные десятичный логарифм концентрации ионов водорода: рН = -lg(H+) Гидроксильный показатель рОН — отрицательным десятичным логарифморм ионов гидроксония: рОН = -lg(OH-) рН + рОН = 14 рН = 7 – нейтральная среда; рН < 7 – кислая среда; рН > 7 – щелочная среда. 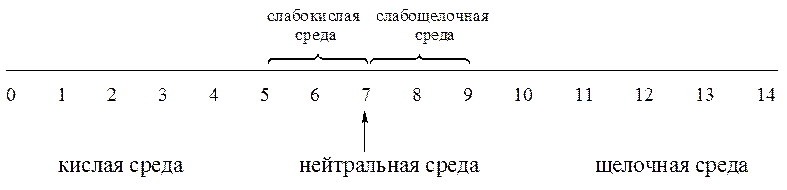 Рис.1 Шкала значений pH Ионное произведение воды — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Вывод значения ионного произведения воды — вода, хотя и является слабым электролитом, в небольшой степени диссоциирует: H2O + H2O ↔ H3O+ + OH− или H2O ↔ H+ + OH− Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: 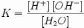 , где: , где:[H+] — концентрация ионов гидроксония (протонов); [OH−] — концентрация гидроксид-ионов; [H2O] — концентрация воды (в молекулярной форме) в воде; Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,72 моль/л. Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Так же стоит упомянуть практическое значение ионного произведения воды. Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH). Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH−] = моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной. Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы. Для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидросид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Растворы, в которых концентрация ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами 3. Кислотно-основные индикаторы Если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щёлочности раствора можно количественно охарактеризовать концентрацией ионов водорода. Кислотность и щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают её десятичный логарифм, взятый с обратным знаком. рН=-lg[H+] Для измерения рН существуют различные методы. Приближённо реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространённый индикатор – метиловый оранжевый, метиловый красный, фенолфтолеин. Индикаторы – вещества, позволяющие следить за составом среды или за протеканием химической реакции. Одни из самых распространенных – кислотно-основные индикаторы, которые изменяют цвет в зависимости от кислотности раствора. Происходит это потому, что в кислой и щелочной среде молекулы индикатора имеют разное строение. Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (рН). Индикаторы широко используют в титровании в аналитической химии и биохимии. Из-за субъективности определения цвета, индикаторы pH не всегда удобны, для точного измерения pH используют pH-метры с цифровой индикацией. Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности. Другой способ применения - использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (например, "Универсальный индикатор"). Такие полоски выпускают в самых разнообразных вариантах - с нанесенной на них цветной шкалой - эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми значениями рН; для точного измерения в узких диапазонах рН, и для ориентировочного исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек. Современные индикаторные полоски могут быть изготовлены с красителем - индикатором, привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до многократного использования. ЗАКЛЮЧЕНИЕ Итак, подведём итоги. Вода, это слабый атмосферный электролит. Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды. В разбавленных водных растворах электролитов, как и в воде, произведение концентраций ионов водорода Н+ и гидроксид-ионов ОН- — величина постоянная при данной температуре. Ионное произведение воды дает возможность для любого водного раствора вычислить концентрацию гидроксид-ионов ОН-, если известна концентрация ионов водорода Н+, и наоборот. Среду любого водного раствора можно охарактеризовать концентрацией ионов водорода Н+ или гидроксид-ионов ОН-. В водных растворах различают три типа сред: нейтральную, щелочную и кислую. Для характеристики сред растворов удобно использовать так называемый водородный показатель рН. Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода: рН = -lg[H+]. Существуют различные методы измерения рН. Качественно характер среды водных растворов электролитов определяют с помощью индикаторов. Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т. е. рН раствора. На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин. Они изменяют свою окраску в малом интервале рН: лакмус — в интервале рН от 5,0 до 8,0; метилоранж — от 3,1 до 4,4 и фенолфталеин — от 8,2 до 10,0. Величина рН имеет большое значение в химических и биологических процессах, так как в зависимости от характера среды эти процессы могут протекать с разными скоростями и в разных направлениях. Поэтому определение рН растворов очень важно в медицине, науке, технике, сельском хозяйстве. СПИСОК ЛИТЕРАТУРЫ Ипполитов Е.Г., Артемов А.В., Батраков В.В. Физическая химия [Электронный ресурс]: Учебник для студентов высших учебных заведений. – Москва: Издательский центр «Академия» 2005. – 448с. Глинка Н.Л. Общая химия [Электронный ресурс]: Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. – Москва, 2005. – 687с. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. – Москва, 2003. – 743с. Гельфман М.И., Юстратов В.П. Неорганическая химия [Электронный ресурс]: Учебное пособие для студентов, обучающихся по технологическим направлениям и специальностям. – Москва, Санкт-Петербург, Краснодар: Издательство «Лань» 2009. –528с. |

