инфарт миокарда. ИНФАРКТ МИОКАРДА, БИОХИМИЧЕСКИЕ СДВИГИ, СОПУТСТВУЮЩИЕ РАЗВИТИЮ И. Реферат по теме Инфаркт миокарда, биохимические сдвиги, сопутствующие развитию ишемии
 Скачать 255.39 Kb. Скачать 255.39 Kb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО НГМУ Минздрава России) Кафедра медицинской химии Реферат по теме Инфаркт миокарда, биохимические сдвиги, сопутствующие развитию ишемии. Биохимическая диагностика инфаркта миокарда Выполнил: студент 2 курса лечебного факультета специальности «Лечебное дело», 31 группы Захаров Даниил Андреевич Проверила: канд. хим. наук, доцент, Долганова О.М Новосибирск – 2019 Содержание Введение…………………………………………………………………….3 Причины и механизм развития……………………………………..……..4 Гиперхолестеролемия. Роль пищевого поведения в развитии гиперхолестеролемии……………………………………………………..5 Накопление и преобразования липопротеинов………………………….6 Биохимические показатели повреждения миокарда…………………….7 Заключение… …………………………………………………………….12 Список литературы……………………………………………………... 13 Введение Инфаркт миокарда - это ограниченный некроз сердечной мышцы. Некрозы в большинстве случаев коронарогенные или ишемические. Реже встречаются некрозы без коронарного повреждения: при стрессе - глюкокортикоиды и катехоламины резко повышают потребность миокарда в кислороде; при некоторых эндокринных нарушениях; при нарушениях электролитного баланса. Сейчас инфаркт миокарда рассматривается только как ишемический некроз, т.е. как повреждение миокарда вследствие ишемии, обусловленной окклюзией коронарных артерий. Самая частая причина - тромб, реже - эмбол. Возможен также инфаркт миокарда при длительном спазме коронарных артерий. Тромбоз чаще всего наблюдается на фоне атеросклеротического повреждения венечных артерий. При наличии атероматозных бляшек происходит завихрение потока крови. Кроме того, вследствие нарушенного липидного обмена при атеросклерозе увеличивается свертываемость крови, что отчасти связано также со снижением активности тучных клеток, вырабатывающих гепарин. Повышенная свертываемость крови завихрения способствуют образованию тромбов. Кроме того, к образованию тромбов может вести распад атероматозных бляшек, кровоизлияния в них. Примерно в 1% случаев инфаркт миокарда развивается на фоне коллагенеза, сифилитического поражения артерий, при расслаивающейся аневризме аорты. Выделяют предрасполагающие факторы: сильное психоэмоциональное перенапряжение, инфекции, резкие изменения погоды. Причины и механизм развития Инфаркт миокарда возникает вследствие закупорки коронарных артерий. Атеросклероз – основная причина инфаркта, результат дислипопротеинемии . Дислипопротеинемия – нарушение обмена липопротеинов, самые распространненые его причнами являются нарушения обмена холестерола и триацилглицеролов . По классификации, основанной на разделении липопротеинов (ЛП) методами ультрацентрифугирования в градиентах плотности солевых растворов, выделяют: хиломикроны (ХМ) с плотностью менее 0,950 г/мл, ЛП очень низкой плотности (ЛПОНП) с плотностью 0,950-1,006 г/мл, ЛП промежуточной плотности (ЛППП) с плотностью 1,006-0,020 г/мл, ЛП низкой плотности (ЛПНП) с плотностью 1,020-1,063 г/мл и ЛП высокой плотности (ЛПВП) с плотностью 1,063-1,210 г/мл. Дефект метаболизма холестерола и наиболее им богатых ЛПНП приводит к гиперхолестеролемии, а в дальнейшем может приводить к развитию атеросклероза. Гиперхолестеролемия – это превышение в крови нормальной концентрации холестерола. При атеросклерозе на стенках артерий образуются так называемые атеросклеротических бляшки, состоящие в основном из отложений холестерола. Атеросклеротические бляшки разрушают клетки эндотелия сосудов, на месте повреждений часто образуются тромбы. Атеросклероз – заболевание, способное развиваться при дефекте многих генов. Одна из основных причин развития атеросклероза – несоответствие поступления выведению холестерола. Максимальное количество холестерола, которое может быть выведено из организма не превышает 1,5 г/сут, а поступление с пищей при несбалансированном питании может превышать этот барьер . Генетические дефекты генов, при экспрессии которых образуются необходимые для метаболизма холестерина белки и ферменты, являются причиной следующих дислипопротеинемий. 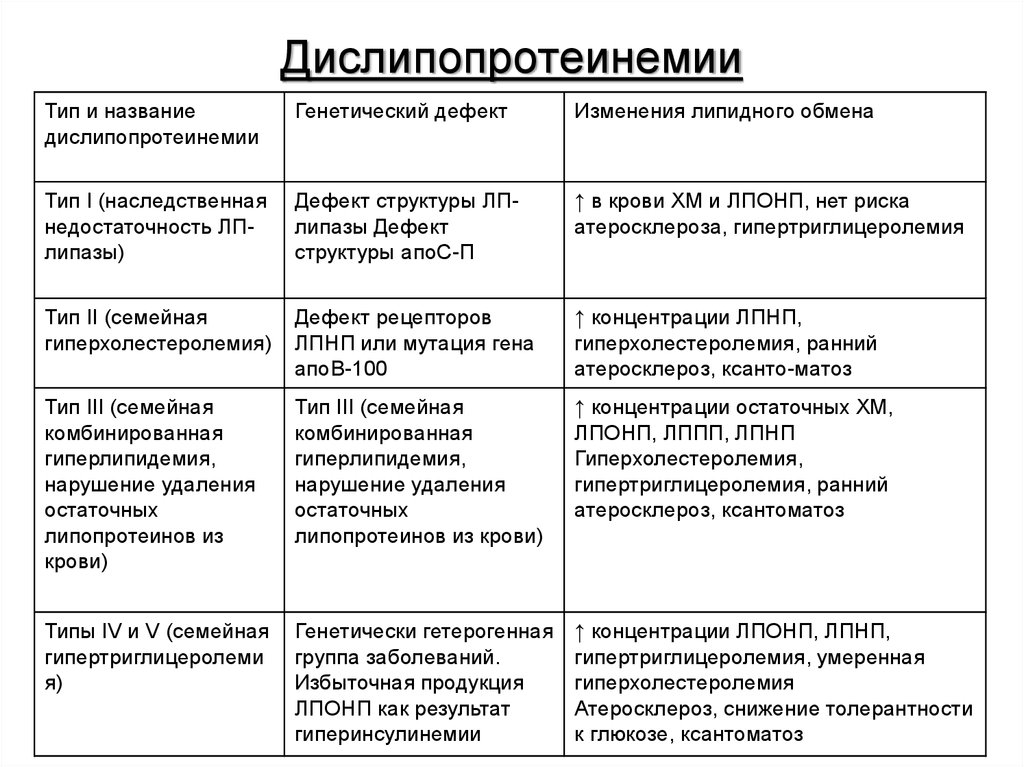 Гиперхолестеролемия. Роль пищевого поведения в развитии гиперхолестеролемии В крови взрослых людей в норме 3,1-5,2 ммоль/л холестерина, его величина, как правило, увеличивается с возрастом, вместе с риском развития ишемической болезни сердца. Гиперхолестеринемия способствует развитию атеросклероза. Вероятность развития болезни тем выше, чем выше концентрация ЛПНП и ниже концентрация ЛПВП. ЛПВП являются “антиатерогенным фактором”, так как переносят холестерин от тканей к печени, где он вступает в процесс утилизации. Норма ЛПВП 0,9 ммоль/л, норма ЛПНП 1,71—3,5 ммоль/л. Коэффициент атерогенности (К) указывает на предрасположенность человека к заболеваниям, вызванных атеросклеротическим поражением сосудов: K= Хс общий — Хс лпвп/ Хс ЛПВП, где Хс общий – общая концентрация холестерина в крови, Хс ЛПВП – концентрация холестерина в составе ЛПВП. Этот показатель нормален в диапазоне от 2 до 2,5 единиц (не выше 3,2 для женщин и 3,5 для мужчин). Зачастую гиперхолестеролемия развивается вследствие избыточного поступления с пищей: холестерина, углеводов и жиров. Для синтеза эндогенного холестерола необходимы: ацетил-КоА, АТФ и NADPH [1]. Эти продукты образуются при окислении глюкозы и жирных кислот, поэтому избыточное поступление углеводов и жиров с пищей приводит к развитию гиперхолестеролемии. В норме поддерживается динамический баланс между синтезом своего, поступившего с пищей и выведением из организма холестерина, с возрастом у многих людей выведение снижается. Накопление и преобразования липопротеинов Артерии имеют следующие строение: изнутри сосуд выстлан эндотелием, расположенным на соединительном тканном слое с погруженными в нём гладкомышечными клетками, внутренний слой сосуда носит название – интима. Индикаторы проявления болезни — так называемые липидные пятна. Их появление связано с местным отложением липопротеидов в интиме. Атерогенными свойствами обладают ЛПОНП, ЛПНП и ЛППП, так как они переносят холестерин к клеткам тканей организма. ЛПОНП являются основными переносчиками эндогенного жира. ЛППП и ЛПНП образуются в кровяносном русле из ЛПОНП под действием ЛП-липазы. Изначально переносимые ими вещества откладываются в интиме преимущественно за счет связывания с протеогликанами межклеточного вещества. Во внутренней оболочке сосуда связанные с протеогликанами липопротеиды могут вступать в химические реакции. Преобладающими являются два типа таких реакций: окисление и неферментативное гликозилирование. Содержание антиоксидантов в интиме значительно меньше, чем в плазме, из-за этого липидный и белковый компоненты ЛПНП легко окисляются. Окисление апопротеинов ведет к разрыву пептидных связей и соединению боковых цепей аминокислот (β-аминогруппы лизина) с продуктами расщепления жирных кислот (4-гидроксиноненаль и малоновый диальдегид). При перекисном окислении липидов образуются оксистерины, гидроперекиси и альдегиды. Стойкая гипергликемия, причиной которой является сахарный диабет, усиливает неферментативное гликозилирование апопротеинов, что также ускоряет атерогенез. Биохимические показатели повреждения миокарда При инфаркте миокарда (ИМ) в результате некроза клеток сердечной мышцы в кровеносное русло попадают содержащиеся в них ферменты и белки. По их наличию, времени появления и концентрации в плазме крови можно оценить ущерб, нанесенный сердечной мышце. Эти сведения дополняют данные ЭКГ и помогают в ранней диагностике ИМ, что позволяет своевременно избрать правильную тактику лечения. Идеальный биохимический маркер должен обладать наивысшей специфичностью и чувствительностью в отношении некроза миокарда, в течение короткого времени после начала симптомов ИМ достигать в крови диагностически значимого уровня, этот уровень должен сохраняться в течение многих дней. В настоящее время маркера, полностью отвечающего всем этим требованиям, не существует, поэтому для диагностики ИМ рекомендуется параллельно использовать два маркера — "ранний" и "поздний". Содержание "раннего" маркера при ИМ диагностически значимо повышается в крови в первые часы заболевания, "поздний" —достигает диагностически значимого уровня только через 6—9 ч, но обладает высокой специфичностью в отношении некроза миокарда. Ранние маркеры некроза миокарда: Миоглобин МВ-КФК (сердечная форма креатинфосфокиназы — КФК) Сердечная форма белка, связывающего жирные кислоты (сБСЖК) Поздние маркеры некроза миокарда: Лактатдегидрогеназа (ЛДГ) Аспартатаминотрансфераза (АсАТ) Сердечные тропонины I и Т Среди множества биохимических маркеров, которые могут менять свою концентрацию в плазме крови при ИМ, наиболее кардиоспецифическими являются тропонины, МВ-фракция креатенинфосфокиназы (КФК-МВ) и миоглобулин, которые и представляют наибольшую диагностическую ценность. Тропонин - является ферментом «быстрого реагирования», поскольку попадает в периферический кровоток из зоны некроза уже в первые часы повреждения миокарда. Тропонины Т и I присутствуют только в клетках миокарда, поэтому повышение их концентрации в крови является достоверным признаком ИМ и показателем его распространенности. Отрицательный тропониновый тест вначале сердечного приступа и через 12 часов позволяет исключить у больного ИМ и диагностировать нестабильную стенокардию. Даже незначительное повышение уровня тропонинов в периферической крови через 6-12 часов после болевого приступа расценивается как признак ишемии миокарда ведущей к некрозу и позволяет выявить ИМ без явных клинических симптомов и ЭКГ-признаков заболевания. МВ-фракция креатенинфосфокиназы (МВ-КФК) содержится преимущественно в клетках миокарда, но в небольшом количестве присутствует и в скелетных мышцах, поэтому активность этого фермента в крови может повышаться при повреждении не только сердечной мышцы, но и других мышечных групп. Судить о повреждении миокарда на фоне сердечного приступа позволяет нарастание активности МВ-КФК в динамике. Для диагностики ИМ в первые сутки от начала сердечного приступа ее определяют 2-3 раза каждые 8 часов. Три отрицательных результата позволяют исключить ИМ, а нарастание концентрации этого фермента в крови с высокой долей вероятности свидетельствует об ИМ. Уровень активности MB - КФК позволяет определить величину инфаркта миокарда и тяжесть заболевания. Миоглобин — очень ранний и чувствительный, но менее специфичный маркер ИМ, поскольку содержание этого мышечного белка в крови может увеличиваться и по другим причинам. Миоглобин при сердечном приступе появляется в крови еще до формирования очага некроза, на стадии выраженного ишемического повреждения сердечной мышцы. Повышение уровня миоглобина в 10 раз и больше указывает на некроз мышечных клеток. Лактатдегидрогеназа (ЛДГ) — фермент, принимающий участие в реакциях гликолиза, катализируя превращение лактата в пируват, при этом образуется NADH. ЛДГ имеет пять изо-энзимов. В сердечной мышце содержится преимущественно изоэнзим ЛДГ-1. При ИМ концентрация ЛДГ начинает превышать нормальный уровень через 14—48 ч после начала симптомов, достигает максимального значения на 3—6-е сутки заболевания и возвращается к норме на 7—14-е сутки болезни. ЛДГ-1 была обнаружена также в эритроцитах, почках, мозге, желудке, повышение концентрации этого белка в крови больных далеко не всегда связано с некрозом миокарда. Отношение ЛДГ-1/ЛДГ-2, превышающее 0,76, обладает 90% специфичностью при выявлении некроза миокарда. Это соотношение может увеличиваться и в случае отсутствия ИМ, если у больного имеются массивный гемолиз, мегалобластическая анемия, распространенное повреждение скелетных мышц, тяжелое заболевание печени. Из-за позднего повышения концентрации ЛДГ в сыворотке крови этот маркер не применяется для ранней диагностики ИМ и суждения об успехе тромболитической терапии, однако ЛДГ длительно использовалась для диагностики ИМ в поздние сроки заболевания. Аспартатаминотрансфераза (АсАТ) – фермент, который катализирует преобращение оксалоацетата в аспартат, перенося NH3 на первую молекулу. Вторым продуктом реакции является α-кетоглутарат. Реакция играет важную роль в высвобождении NH3 из аминокислот, который затем перерабатывается в цикле мочевины, так как аспартат, полученный в процессе реакции, нужен для образования аргининосукцината. У больных ИМ уровень АсАТ превышает норму через 8—12 ч после начала боли, достигает максимального значения к 24—З6-му часу и возвращается к норме за 3—4 дня. Большое количество этого фермента содержится в тканях печени, что сильно снижает его специфичность в отношении некроза миокарда. АсАТ неудобна как для ранней, так и для поздней диагностики ИМ, она используется только в сочетании с более чувствительными и специфичными маркерами. Низкая специфичность в отношении некроза миокарда послужила причиной того, что использование этого маркера, как и ЛДГ, для диагностики ИМ в настоящее время также признано нецелесообразным. Повышение АСТ, превышающее повышение АЛТ, характерно для повреждения сердечной мышцы; если же показатель АЛТ выше, чем АСТ, то это, как правило, свидетельствует о разрушении клеток печени. Неспецифическая реакция на повреждение миокарда включает нейтрофильный лейкоцитоз (появляется через несколько часов после окклюзии и длится 3-7 сут, число лейкоцитов достигает 12000-15000 в мкл). СОЭ повышается медленнее, достигает пика в 1-ю неделю и часто остается повышенной в течение 1-2 нед. сБСЖК по последовательности аминокислот идентичен БСЖК, содержащемуся в поперечнополосатой мышечной ткани скелетных мышц, однако представлен в скелетной мускулатуре в минимальном количестве. Максимальное количество сБСЖК находится в ткани миокарда — 0,5 мг/г. Единственная мышца, в которой имеется относительно большое количество сБСЖК, — это диафрагма (примерно 25% от содержания в ткани миокарда). Некоторое количество сБСЖК содержится в тканях аорты, и можно предположить, что содержание его повышается, в крови при расслаивающей аневризме аорты. Так как сБСЖК в основном свободно расположен в цитоплазме клеток, в случае повреждения клеточной мембраны кардиомиоцита он быстро попадает в кровоток. В крови здоровых людей циркулирует небольшое количество сБСЖК. 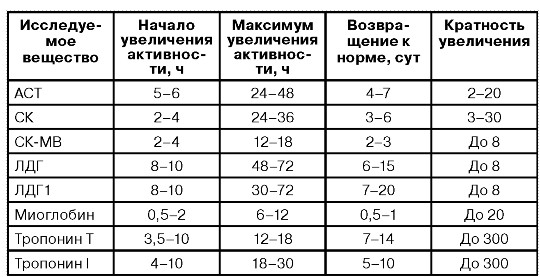 Заключение Инфаркт миокарда является одной из наиболее распространенных причин смерти от сердечно-сосудистых заболеваний. Сам по себе инфаркт еще не способен вызвать летальный исход. В большинстве случаев смерть во время инфаркта связана с наступлением одного из осложнений этой болезни. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность. Инфаркт миокарда – неотложное состояние, требующее срочного медицинского вмешательства. Крайне важным является своевременное распознавание инфаркта миокарда на основе его главных симптомов. Симптомы (признаки) инфаркта миокарда могут быть весьма специфичными, но могут походить и на симптомы другой болезни (атипичные симптомы), или же вовсе отсутствовать. Рассматривая данное заболевание с точки зрения биохимии также можно сделать несколько выводов: Атеросклероз, результат нарушения липидного обмена, является основным звеном патогенеза ишемической болезни сердца. Для диагностики и выбора наиболее эффективного лечения пациентов с сердечной патологией следует иметь полное представление об этиологии и патогенезе ИБС. Одна из основных причин развития ИБС – наследственные болезни обмена липидов. Также, несомненно, важно помнить о профилактиктических мерах, а именно, правильном питание, отказе от вредных привычек, регулярном занятие спортом, что позволит предупредить острую форму ИБС – инфаркт миокарда. Список литературы: Биологическая химия с упражнениями и задачами: учебник/ под ред. С.Е. Северина. – 2-е изд., испр. и доп. – М.: ГЭОТАР – Медиа, 2013. – С.302-396. Патологическая анатомия: учебник/ А.И. Струков, В.В. Серов. – 5-е изд. стер. – М.: Литтерра, 2010. – С. 359-360 Медицинская физиология: учебник/ А.К. Гайтон, Дж.Э. Холл/ пер. с англ.; под ред. В.И. Кобрина. – М.: Логосфера, 2008. – С. 941-945 Климов А. Н. Обмен липидов и липопротеидов и его нарушения. Санкт-Петербург, 1999. – С. 512. Ischemic myocardial injuries after cardiac malformation repair in infants may be associated with oxidative stress mechanisms /al. Cardiovasc Pathol // Oliveira MS.-2011,Jan-Feb. - P. 1-18 Foreman, R.D. Mechanisms of cardiac pain / R.D. Foreman // Ann. Rev. Physiol. – 1999. – Vol. 61. – P. 143-167. |
