рефрактометрия. Рефрактометрический метод анализа в химии
 Скачать 6.6 Mb. Скачать 6.6 Mb.
|
Атомные и групповые рефракции для D - линии спектра натрияТаблица 3
Молярную рефракцию атомов, построенных из ионов, рассчитывают как сумму ионных рефракций (табл. 4). Приступая к установлению строения вещества по молекулярной рефракции, следует, прежде всего, обеспечить необходимую точность исходных данных. Экспериментальные величины показателя преломления и плотности должны иметь погрешность до нескольких единиц четвёртого десятичного знака, легко достижимую на обычных лабораторных рефрактометрах предельного угла и при работе с пикнометрами объёмом более 1 - 2 мл с термостатированием до 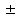 0,10С. Абсолютное значение температуры несущественно, но обе величины (n и ρ) обязательно должны быть измерены при одной и той же температуре. В расчётную формулу необходимо вставлять величину плотности ρ 0,10С. Абсолютное значение температуры несущественно, но обе величины (n и ρ) обязательно должны быть измерены при одной и той же температуре. В расчётную формулу необходимо вставлять величину плотности ρ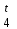 : отношение весов равных объёмов вещества и воды при температуре t пересчитывают в плотность по формуле: : отношение весов равных объёмов вещества и воды при температуре t пересчитывают в плотность по формуле:ρ 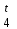 = ρ = ρ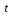 + ( ρ + ( ρ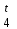 )воды. )воды.При вычислениях надо употреблять точное значение М согласно установленной или предполагаемой брутто-формуле, а не непосредственно результат приближённого экспериментального определения, так как погрешности большинства обычных физико-химических методов определения молекулярной массы достигают нескольких процентов и сопоставимы с величиной самих структурных влияний на молекулярную рефракцию. Уравнение (26) выражает правило аддитивности молярной рефракции. Физически более обоснован способ расчёта рефракции как суммы рефракций не атомов, а связей (табл. 5). Таблица 4 Ионные рефракции
Правило аддитивности молярной рефракции используют для установления строения молекул, сравнивая R, найденную экспериментально, с рассчитанной по уравнению (26) для предлагаемой структуры молекулы. Близость значений Rэксп. и Rвыч. служит подтверждением строения молекулы (табл. 6). Расхождения до 0,3 - 0,4 мл/моль обусловлены возможными ошибками эксперимента и неточностью собственно аддитивных констант, а для ионных соединений отклонения от аддитивности дополнительно связаны с взаимной поляризацией ионов. Закономерности рефракций связей. 1. Константы связей какого-либо элемента с атомами других элементов, принадлежащих к одной и той же группе периодической системы, увеличиваются с увеличением размера атома. Например: C-F < C-Cl < C-Br < C-J. Наиболее легко поляризуемые орбитали, то есть наружные орбитали атомов большого размера, менее прочно удерживаются связанными ядрами, чем аналогичные орбитали атомов меньшего размера. 2. Несмотря на повышенную электроотрицательность гетероатома, константы связей С-О и С-N имеют большие значения, чем С-С - связи. Это связано с наличием несвязанных электронов на гетероатоме. 3. Величины констант для кратных связей больше, чем для одинарных связей между теми же элементами. Например: С≡С > C=C > C−C (табл. 3) Причем двойная связь имеет величину, более чем вдвое превышающую величину для одинарной связи (rC=C > 2rC−C). Это показывает, что π-электроны гораздо легче поляризуются, чем σ-электроны. Исключением из этого правила является, по-видимому, двойная связь N=O. 4. Для констант связей С=С, C=N и С=О обнаруживается характерная связь с положением элементов в группах и периодах периодической системы, и эти константы уменьшаются по мере роста электроотрицательностей неодинаковых атомов в соответствии с данным порядком перечисления, а константы для связей C=S и С=О уменьшаются в приведённом порядке. Значительное различие между величиной констант для С=О и C=S ( гораздо больше, чем различие между С−О и C−S) связано с тем, что атом серы не склонен к образованию двойной связи с углеродом и поэтому проявляет, находясь в этом состоянии, сильный М-эффект. Учитывая указанные тенденции, следует иметь в виду, что точные величины рефракции связей довольно сильно меняются при изменении молекулярного окружения связей, и поэтому будет наблюдаться большее или меньшее отклонение наблюдаемых молекулярных рефракций от величин, рассчитанных на основании стандартных или средних значений. Например, значения молекулярных рефракций для изомеров бутина СH3−CH2−C≡CH и СН3−С≡С−СН3 будут различны, поскольку различны величины рефракций для концевой и неконцевой С≡С - связи (табл. 5). Таблица 5 Рефракции связей для D-линии спектра натрия при 20 0С
Для соединений с одинаковой эмпирической формулой, но с разным химическим строением рефракция различна. Поэтому, экспериментально определяя рефракцию и сравнивая её с вычисленным значением, можно установить химическое строение исследуемого органического соединения. Примеры структурного анализа по молекулярной рефракцииНеобходимой предпосылкой успешного проведения структурного анализа по молекулярной рефракции является полное использование информации, содержащейся в самой брутто-формуле. Её следует сопоставить с формулами предельных соединений с тем же числом углеродных атомов, и по разнице в содержании водорода сделать заключение о степени непредельности анализируемого вещества и возможном содержании в нём кратных связей и циклов. Пример: Формула С8Н11Сl2Br, где общее число атомов одновалентных элементов nI = 11 + 2 + 1 = 14 - на 4 атома меньше, чем в предельном соединении с nIV = 8 (2∙8 + 2 = 18), должна отвечать либо ациклическим структурам, содержащим две двойные связи или одну тройную, либо моноциклической структуре с одной двойной связью, либо же бициклической - без кратных связей. Эти альтернативные типы структур и должны быть положены в основу подсчёта RАДД по формуле (17). Сравнение экспериментального значения R с RАДД даёт возможность отвергнуть некоторые из предполагаемых альтернативных вариантов структур, подтвердить другие и сделать более детальные заключения о строении, основываясь на следующих соображениях: 1. Совпадение R и RАДД с погрешностью в несколько десятых долей миллилитров в моле подтверждает вероятность, как предполагаемой брутто-формулы, так и структуры. При этом расхождения до 0,3 - 0,4 относятся за счёт приближённого характера самих аддитивных констант, возможных ошибок измерений и влияния примесей. Если при расчёте предполагалось наличие двух и более кратных связей, то совпадение с экспериментальной величиной свидетельствует о том, что кратные связи изолированы друг от друга, кумулированы или образуют простейшие ароматические структуры (бензольное кольцо, некоторые гетероциклы). Окончательные формулировки выводов, как правило, должны учитывать вероятность нескольких структур, неразличимых по молекулярной рефракции в указанных пределах погрешности расчётов. 2. Расхождение R и RАДД более чем на 0,3 - 0,4 мл/моль указывает на ошибочность сделанных при подсчёте RАДД предположений о строении и составе органического соединения или свидетельствует об особенностях структуры, вызывающих экзальтации молекулярной рефракции. В этом случае необходимо рассмотреть другие возможные при данной брутто-формуле значения RАДД для иного числа и природы кратных связей или напряжённых колец, а также иных функциональных групп. Превышение экспериментальной величины R над аддитивной, вычисленной для структур с двумя и более кратными связями, может быть экзальтацией молекулярной рефракции, вызванной сопряжением. Сопоставление величины экзальтации с литературными (табличными) данными для хорошо изученных сопряжённых систем может дать дополнительную информацию о характере сопряжённой системы и разветвлённости углеродного скелета в месте её расположения. Депрессия молекулярной рефракции (случай, когда R < RАДД) наблюдается только у некоторых ароматических гетероциклических соединений. За исключением этого специального случая отрицательные величины R−RАДД свидетельствуют о несоответствии состава и строения органического соединения предполагаемым. Другие возможные причины отрицательных разностей R−RАДД - ошибки, допущенные в расчётах и измерениях. Рефрактометрия была первым из физических методов, широко применявшихся для определения структуры органических соединений и в течение многих десятилетий (до начала применения ИК - спектроскопии в сороковых годах ХХ века) играла ведущую роль. В настоящее время она применяется в качестве легко доступного источника предварительной информации, дополняющей данные других методов. .2 Оптическая экзальтация Отклонение рассчитанных величин R от экспериментальных примерно до 1 %, обусловлено тем, что средние величины рефракций связей не дают в сумме строго аддитивно молярную рефракцию. Значительно большие отклонения (до 10 %) могут встречаться в случае молекул, содержащих сопряжённые кратные связи. Поскольку наблюдаемая величина R больше рассчитанной, то это явление называется оптической экзальтацией и обозначается как ER. Экзальтация указывает на наличие в молекуле сопряжённых кратных связей, например: 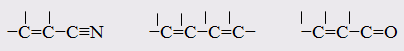 В молекулах с подобными фрагментами π-электронное облако делокализовано по всем атомам, образующим систему сопряжённых связей, и может свободно перемещаться вдоль этой системы, то есть обладает высокой подвижностью. Такое электронное облако легко смещается под действием электрического поля, благодаря чему молекула проявляет повышенную поляризуемость, и наблюдается оптическая экзальтация. Степень экзальтации, возрастая с увеличением длины цепи сопряжения, указывает на повышение подвижности электронов, их поляризуемость, например, в системах: Оптическая экзальтация встречается и в случае замещённых бензолов. Заместители, обладающие положительным электромерным эффектом (+Е - эффектом), обуславливают экзальтацию, которая уменьшается в ряду NR2 > NH2 > OR > OH > галогены. Это объясняется увеличением поляризуемости молекулы, возникающей за счёт сопряжения свободной пары электронов с π-электронным секстетом бензольного кольца, которое дополнительно облегчается в случае групп NR2 и öR наличием электронодонарных алкилов. Способность −Е - групп, таких как NO2, C=O, C≡N, увеличивать подвижность π-электронов бензольного кольца проявляется в экзальтации, наблюдаемой для нитробензола С6Н5NO2, ацетофенона С6Н5СОСН3, бензонитрила С6Н5С≡N и др. Алкильные группы также увеличивают молекулярную рефракцию за счёт +Е - эффекта. Таким образом, в области видимого света поляризуемость молекул практически полностью обусловлена смещением π-электронов, и поэтому для органических соединений она равна сумме эффективных смещений отдельных электронов. Последнее обстоятельство придаёт молекулярной рефракции свойство аддитивности для составляющих фрагментов молекулы, что находит широкое применение при определении состава и строения молекул. 3.3 Дисперсия молекулярной рефракции Дисперсией рефракции называется зависимость рефракции или показателя преломления света от длины волны. При нормальной дисперсии показатель преломления n возрастает с уменьшением длины волны. Дисперсию можно охарактеризовать, как разность значений рефракции одного и того же соединения при двух различных длинах волн α и β (Rα - Rβ). Однако обычно в качестве меры дисперсии используют безразмерную величину - относительную дисперсию: 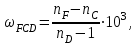 (34) (34)где nF, nC, nD - показатели преломления, измеренные для F - C - линий спектра водорода. F (λ = 486,1 нм), С (λ = 656,3 нм) и D спектра натрия (λ = 589,3 нм), (см. табл. 1). Относительная дисперсия весьма чувствительна к наличию и положению кратных связей в молекуле. Например, для алифатических парафинов ωFCD ≈ 17−18, а для бензола ωFCD = 33,3. Это позволяет по величине дисперсии и показателю преломления определить принадлежность углеводорода к тому или иному классу соединений и предположить его возможное строение. .4 Рефракция и размеры молекул Рефракцию можно использовать для вычисления не только электронной поляризуемости молекулы или иона (по уравнению 19), но и для расчёта эффективного радиуса частицы (атома, иона). Поскольку рефракция имеет размерность объёма, отнесённого к определённому количеству вещества (удельная - к одному грамму, молярная - к одному молю), то можно (условно) рассматривать молекулу как сферу с радиусом rм и проводящей поверхностью. В этом случае: αэл = rМ. Тогда из уравнения (19) получим: 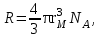 (35) (35)откуда: 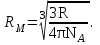 (36) (36)4. Рефрактометрия растворов Аддитивность рефракции характерна и для жидких смесей (растворов). Рефракция смеси равна сумме рефракций компонентов, отнесённых к их долям в смеси. Молярную и удельную рефракции двухкомпонентной смеси можно соответственно представить в виде следующих уравнений: R = N1R1 + (1 - N1) R2 (37) r = w1r1 + (1 - w1) r2, (38) где N1, N2 и w1, w2 - соответственно мольная и массовая доли первого и второго компонентов. Уравнения (37) и (38) используются для определения состава смеси и рефракции её компонентов. Рефрактометрия достаточно широко применяется для идентификации веществ, а также для оценки степени их чистоты. При идентификации, а также определении чистоты веществ критерием служит совпадение показателей преломления исследуемого образца и заведомо известного чистого соединения. Важно, чтобы все измерения n выполнялись при одинаковой температуре и при одних и тех же длинах волн. Если образец загрязнён, то его можно рассматривать как разбавленный раствор примесей в исследуемом соединении. При этом в случае незначительного содержания примесей их концентрацию Сх можно определить, воспользовавшись линейным соотношением: 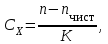 (39) (39)где n и nчист. - показатели преломления образца и чистого вещества; К - коэффициент, определяемый экспериментально. Для ориентировочной оценки величину Сх можно определить, исходя из аддитивности показателей преломления. Чувствительность этого метода тем выше, чем сильнее различаются показатели преломления примесей и чистого органического соединения. Рефрактометрический метод иногда применяется для контроля за процессом очистки вновь синтезированных органических соединений, показатели преломления которых ещё не известны. Если при очистке образца различными способами показатель преломления от одной очистки к другой продолжает изменяться, то органическое соединение не считают чистым (индивидуальным), и процесс очистки продолжают. .1 Анализ двухкомпонентных растворов По значению показателя преломления бинарного раствора можно определить его концентрацию. Для этого необходимо, чтобы была известна зависимость показателя преломления от состава раствора. Для ряда растворов (например, сахарозы, некоторых спиртов, кислот, оснований, солей) зависимости показателей преломления установлены и сведены в таблицы, которыми и пользуются при количественном анализе. Если таких таблиц нет, то используют градуировочные графики, которые строят по результатам измерений эталонных растворов. Кривые зависимостей показателя преломления от состава бинарных растворов существенно изменяются с изменением природы раствора. Эти кривые подразделяют на три типа: I тип - изотермы, имеющие незначительную положительную или отрицательную кривизну, когда изменение n от состава отличается от линейного хода по величине не более, чем на 0,0075-0,008 (рис. 4а); II тип - изотермы, имеющие заметную кривизну, когда Δn > 0,008 (рис. 4б); III тип - изотермы с сингулярной точкой (рис. 4в). 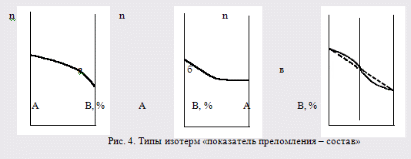 Большинству бинарных растворов соответствуют кривые I-го типа. Сюда относятся нормальные растворы и растворы с ассоциированными компонентами, а также растворы с химическим взаимодействием компонентов и растворы, в которых по каким-либо причинам такое взаимодействие не проявляется отчётливо на изотерме "показатель преломления - состав". К растворам типа II и III относятся растворы с сильно выраженным химическим взаимодействием компонентов и с образованием частично диссоциированных соединений. В некоторых случаях по положению сингулярной точки на кривой III-го типа удаётся определить стехиометрический состав образовавшегося соединения. Таким образом, в рефрактометрии двухкомпонентных систем, используется помимо количественного физико-химический метод анализа, который позволяет обнаружить достаточно выраженное взаимодействие компонентов. При отсутствии межмолекулярного взаимодействия, приводящего к ассоциации компонентов, справедливо свойство аддитивности рефракции. В этом случае молярная рефракция раствора RР равна сумме произведений рефракций его компонентов и их мольных долей в этом растворе: Rp = N1∙R1 + N2∙R2, где R1 и R2 - молярные рефракции соответственно растворителя и растворённого вещества; N1 и N2 - мольные доли растворителя и растворённого вещества. Для расчёта RР с использованием экспериментальных данных по уравнению (15) необходимо знать величины "среднемолекулярной массы" раствора, которая определяется соотношением: Мср = N1∙M1 + N2∙M2, где M1 и М2 - молекулярные массы компонентов раствора, N1 и N2 - мольные доли компонентов раствора. Свойством аддитивности, подобно молекулярной рефракции, обладает и удельная рефракция: 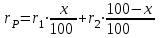 (40) (40)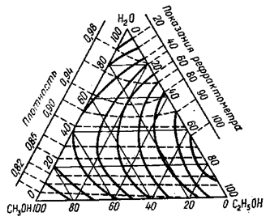 Рис. 5. Треугольная диаграмма для рефрактометрического анализа тройной системы: этиловый спирт - метиловый спирт - вода 4.2 Анализ трёхкомпонентных растворов Для анализа тройных систем необходимо знать два каких-либо независимых, характеризующих состав системы, параметра. Одним из таких параметров обычно служит показатель преломления, а вторым - как правило, плотность раствора. Состав смеси по значениям этих параметров можно определить графически. Для этого сначала готовят трёхкомпонентные смеси известного состава и строят зависимость "состав - свойство". Зависимость значений показателя преломления и плотности раствора от состава системы представлена на рис. 5. посредством, так называемой тройной диаграммы (треугольник Гиббса - Розебома). Осями координат служат стороны равностороннего треугольника, на каждой из которых откладывается массовая доля бинарной системы, вершины треугольника соответствует 100 % компонентам, а любая точка внутри треугольника определяет состав трехкомпонентной системы. Определив ρ и n стандартных растворов, наносят на диаграмму изоденсы по точкам, соответствующим составам и имеющим одну и ту же плотность, и изорефракты - по точкам, определяющим состав равнопреломляющих смесей. Из окончаний изоденс и изорефракт опускают перпендикуляры на дополнительные шкалы (линии, проведённые параллельно боковым сторонам треугольника), плотности и показатели преломления соответствующие значениям этих величин. При проведении анализа измеряют плотность и показатель преломления исследуемого образца и определяют точку, отвечающую составу, на пересечении изорефракты изоденсы. Из этой точки проводят линии, параллельные сторонам треугольника, и по отсечённым этими линиями отрезкам определяют состав анализируемой смеси. Подробно методика построения тройных диаграмм описана в методических указаниях по физической химии "Изучение взаимной растворимости жидкостей в трёхкомпонентных системах" [14]. 5. Рефрактометрия полимеров Рефрактометрический метод достаточно часто применяют при анализе высокомолекулярных соединений. Этот метод впервые был предложен и впоследствии нашёл широкое применение для количественного определения стирола в продуктах его сополимеризации с дивинилом (1,3-бутадиен). Методика [9] позволяет с погрешностью до 5 % установить число содержащихся в сополимерах звеньев дивинила, присоединённых в положения 1-2, а также температуру стеклования таких полимеров с погрешностью до 3-4 0С. Рефрактометрический метод применяется и для исследования кристаллизуемости хлоропреновых каучуков. При помощи этого метода можно определить степень кристалличности образцов полихлоропрена, закристаллизованных при разных температурах [8]. При переходе от одного углеводородного полимера к другому поляризуемость молекулы существенно не меняется, однако замена атомов водорода на атомы галогенов приводит к изменению поляризуемости полимеров и соответственно к изменению их показателя преломления Рефрактометрия является простым и удобным методом исследования процессов кристаллизации и плавления полимеров, подвергшихся кристаллизации в различных температурных условиях. |
