лабораторный практикум ТХ. Регистрация в Журнале регистрации вещественных доказательств и документов к ним
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
Тема: Определение угарного газа в крови Цель: освоить химические методы качественного определения карбоксигемоглобина в крови Опыт 1 Проба Гоппе-Зейлера К 2-3 каплям пробы крови добавьте несколько капель 30% NaOH. Кровь с СОНЬ остается красной, а не содержащая СОНЬ - буреет. Сделайте вывод о наличии или отсутствии карбоксигемоглобина в пробе. Опыт 2Проба Бюркера К 2-3 каплям пробы крови добавьте несколько капель K3[Fe(CN)6]. Кровь, не содержащая СОНЬ, становится желтой. Сделайте вывод о наличии или отсутствии карбоксигемоглобина в пробе. Опыт 3 Проба Залесского К 2-3 каплям пробы крови добавьте несколько капель CuS04. Кровь, не содержащая НЬСО, становится зеленой Сделайте вывод о наличии или отсутствии карбоксигемоглобина в пробе. Опыт 4 Проба Либмана К 2-3 каплям пробы крови добавьте несколько капель 40% раствора формальдегида. При отсутствии в пробе токсиканта, появляется коричнево-черная окраска Сделайте вывод о наличии или отсутствии карбоксигемоглобина в пробе. Лабораторная работа №7 ОПРЕДЕЛЕНИЕ ПИЩЕВЫХ ДОБАВОК В ПРОДУКТАХ Цель: определение нитритов в колбасных изделиях; определение сернистой кислоты в кондитерских изделиях; распознавание природы красителей. Опыт №1 Определение нитритов в колбасных изделиях Методика определения: 10 г исследуемого материала (предварительно измельченного) помещают в химический стакан, прибавляют 100 мл дистиллированной воды, настаивают при комнатной температуре в течение 40 мин, время от времени взбалтывая содержимое стеклянной палочкой. Раствор фильтруют через бумажный фильтр в сухую колбу. В 2 мерные колбы на 100 мл пипеткой переносят по 5 и 15 мл отфильтрованной вытяжки и приливают по 60 мл дистиллированной воды. Одновременно готовят стандартный раствор: 15 мл раствора с содержанием NaN02 0,0075 г/л отбирают пипеткой в мерную колбу на 100 мл и добавляют 60 мл дистиллированной воды. Далее во все три колбы добавляют по 15 мл реактива Грисса. Сравнивают интенсивность окраски стандартного раствора с окраской испытуемых растворов. Сравнение проводят в пробирках или цилиндрах. Содержание NaN02 рассчитывают по формуле:  Опыт №2 Определение сернистой кислоты в кондитерских изделиях Методика определения: 5 г исследуемого материала (предварительно измельченного) помещают в коническую колбу, прибавляют 50 мл дистиллированной воды и встряхивают в течение 5 мин. К раствору добавляют 25 мл 1 М раствора гидроксида калия, закрывают пробкой и встряхивают в течение 15 мин. Затем прибавляют 10 мл раствора (1:3) кислоты серной, 1 мл раствора крахмала и титруют 0,01 М раствором йода до появления синего окрашивания, не исчезающего при перемешивании. В тех же условиях проводят контрольный опыт с дистиллированной водой. Содержание сернистой кислоты (%) вычисляют по формуле: 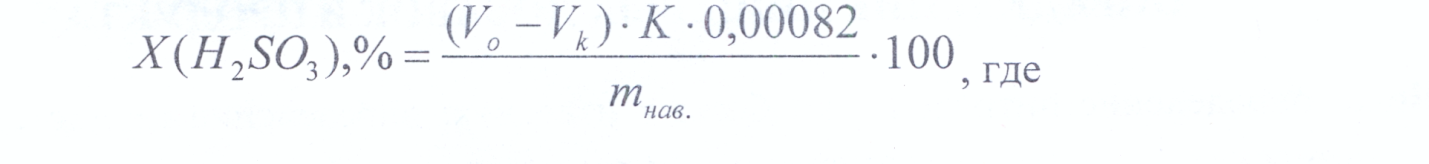 Х- содержание сернистой кислоты, %; Х- содержание сернистой кислоты, %;V„ - объем раствора йода, израсходованный на титрование в основном опыте, мл; Vk - объем раствора йода, израсходованный на титрование в контрольном опыте, мл; К - поправочный коэффициент раствора йода; тнт, - масса навески, взятой для анализа, г; 0,00082 - титр раствора йода по сернистой кислоте, г/мл. Опыт №3 Экспресс-метод распознавания природы красителей Методика определения: в пробирку наливают 3 мл исследуемого раствора, прибавляют 4 капли 10% раствора аммиака или 30-40% раствора натрия гидроксида. Пробирку нагревают на спиртовке до начала закипания. Если в пробирке содержится натуральный краситель, то раствор приобретает темное окрашивание с зеленоватым оттенком. Раствор синтетического красителя цвет не изменит. Для идентификации запрещенного в нашей стране синтетического красителя амаранта используют специфическую реакцию с сульфатом меди (II). К 5 мл исследуемого раствора прибавляют 1 мл сульфата меди (II). При наличии амаранта раствор приобретает желтую окраску, переходящую в розовую при добавлении нескольких капель уксусной кислоты. Лабораторная работа №8 ОПРЕДЕЛЕНИЕ КАЧЕСТВА ВОДЫ Цель: определение качества воды по запаху, показателю жесткости, по содержанию примеси хлоридов. Опыт №1. Определение запаха воды Методика определения при температуре 20 °С В колбу вместимостью 250 мл отмеривают 100 мл испытуемой воды температуры 20 °С, закрывают часовым стеклом, перемешивают, затем сдвигают стекло в сторону и определяют характер и интенсивность запаха. Методика определения при температуре 60 °С В колбу вместимостью 250 мл отмеривают 100 мл испытуемой воды, накрывают колбу часовым стеклом и подогревают на водяной бане до температуры 50 - 60 °С. Содержимое колбы несколько раз перемешивают, затем сдвигают стекло в сторону и определяют характер и интенсивность запаха. Таблица 1. Оценка интенсивности запаха воды.
Запах воды не должен превышать 2 баллов. Специфический запах, появляющийся при хлорировании, не должен превышать 1 балла. (Согласно ГОСТу 2874 - 82) При определении запаха должны соблюдаться следующие условия: воздух в помещении, где проводится анализ, не должен иметь отвлекающего запаха; одежда, руки, лицо, волосы наблюдателя так же не должны иметь отвлекающего запаха, одно и то же лицо не должно длительное время производить определение запаха, так как наступает утомление, привыкание к запахам и притупление обоняния. Опыт №2. Определение жесткости воды Методика определения общей жесткости воды В колбу для титрования отмеряют 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора и медленно титруют при постоянном перемешивании 0,01 моль/л раствором Трилона Б (индикатор - кислотный хром черный специальный). Титрование ведут до трех сходящихся результатов. Результаты оформляют в виде таблицы. Таблица 2. Результаты определения общей жесткости воды.
Общую жесткость воды (в ммоль экв/л) рассчитывают по закону эквивалентов: 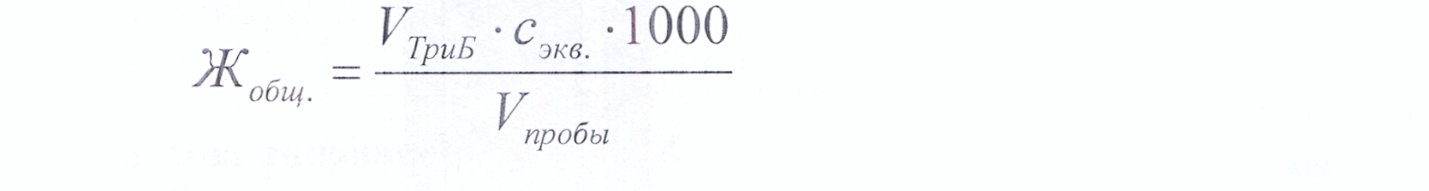 Методика определения карбонатной и некарбонатной жесткости воды В колбу для титрования отмеряют 100 мл исследуемой воды и медленно титруют при постоянном перемешивании 0,1 моль/л раствором хлористоводородной кислоты (индикатор - метиловый оранжевый). Титрование ведут до трех сходящихся результатов. Результаты оформляют в виде таблицы. Таблица 3. Результаты определения карбонатной и некарбонатной жесткости воды.
Карбонатную жесткость воды (в ммоль экв/л) рассчитывают по формуле: Виды жесткости и единицы ее измерения Воду с растворенными в ней солями называют жесткой, а совокупность свойств такой воды - жесткостью. Согласно ГОСТ 6055 - 86 различают: -*■ карбонатную жесткость - это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальция, магния и железа. Часто этот вид жесткости называют временной или устранимой; -*■ некарбонатную жесткость - совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция, магния и железа. Этот вид жесткости также называют постоянной или неустранимой; -*■ общую жесткость, складывающуюся из карбонатной и некарбонатной жесткости. Она равна сумме концентраций ионов Са2+, Mg2+, Fe2+. Количественно жесткость воды в России выражают единицами жесткости. За единицу жесткости принимают жесткость воды в одном литре которой содержится один миллимоль эквивалент ионов Са или Mg (ммоль экв/л). Числовое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м . Одна единица жесткости соответствует массовой концентрации ионов Са , равной 20,4 мг/л или ионов Mg , равной 12,15 мг/л. По величине жесткости различают воду: -> Очень мягкая (0-1,5 ммоль экв/л); -> Мягкая (1,5 - 3,0 ммоль экв/л); -> Среднежесткая (3,0 - 4,5 ммоль экв/л); -> Довольно жесткая (4,5 - 6,5 ммоль экв/л); -> Жесткая (6,5 -11,0 ммоль экв/л); -»• Очень жесткая (свыше 11,0 ммоль экв/л). Методы устранения и снижения жесткости воды Устранение или снижение жесткости воды называют умягчением. Его осуществляют различными методами: 1. Термическая обработка воды. Сущность метода заключается в предварительном нагревании воды до 70 - 80°С или ее кипячении. Метод позволяет устранить только временную (карбонатную) жесткость, обусловленную наличием в воде хорошо растворимых гидрокарбонатов кальция, магния и железа. При этом катионы Са2+, Mg2+, Fe2+ осаждаются в виде нерастворимых соединений. При термической обработке воды удается также снизить содержание в ней растворимых газов, т. к. их растворимость с увеличением температуры падает. 2. Химическая обработка воды (реагентный метод). Этот метод позволяет устранить как временную жесткость, так и постоянную. Сущность его заключается в обработке воды специальными реагентами, образующими с ионами, вызывающими жесткость, малорастворимые соединения. К числу таких реагентов относятся: сода Na2C03, известь негашеная СаО и гашеная Са(ОН)2, различные фосфаты натрия (Na3P04, Na6P6018) и др. При обработке воды известью (гашеной или негашеной) происходит устранение ее временной жесткости и одновременное снижение ее щелочности. Процесс называется известкованием или декарбонизацией. Обработка известью позволяет связать и растворенный в воде углекислый газ. Использование фосфатов натрия предпочтительнее, так как образующие фосфаты кальция, магния и железа менее растворимы, чем соответствующие их карбонаты и гидроксиды. Для одновременного устранения карбонатной и некарбонатной жесткости широкое распространение в промышленности получил известково - содовый метод: обработка воды смесью СаО и Na2C03. Он становится еще более эффективным, если его проводить при нагревании, сочетая достоинства химического и термического методов. 3. Ионообменный метод. Это современный физико-химический метод, широко используемый в промышленности. Использование его для умягчения и деминерализации воды позволяет не только уменьшить ее жесткость, но достичь ее глубокой очистки. Вода, подвергшаяся такой обработке, практически не содержит посторонних ионов. Метод основан на способности некоторых веществ, не растворимых в воде, стехиометрически обменивать свои ионы на ионы внешней среды (воды, растворов электролитов). Вещества, обладающие такими свойствами, называют ионообменниками (ионообменными сорбентами) или сокращенно ионитами. Большинство ионитов -твердые, ограниченно набухающие вещества, аморфной или кристаллической структуры. Они состоят из каркаса (матрицы) и закрепленных на нем иогенных (активных функциональных) или комплексообразующих групп. Эти группы диссоциируют, давая полионы (фиксированные ионы, ковалентно связанные с каркасом) и эквивалентное число подвижных противоионов, способных к обмену и компенсирующих своими зарядами заряды полионов. По знаку заряду подвижных противоионов, т. е. по знаку заряду обменивающихся ионов, иониты делятся на катиониты, аниониты и амфолиты, по химической природе каркаса - на неорганические, органические и минерально -органические. Приложение Вода - одно из наиболее важных и распространенных химических соединений на нашей планете. Она является регулятором климатических условий на земле и универсальным растворителем в процессах, происходящих в живой и неживой природе. Хорошая растворяющая способность воды, обусловленная полярностью ее молекул, приводит к тому, что в природе она чаще всего встречается не в виде индивидуального химического соединения, а в виде сложной многокомпонентной системы, в состав которой входят минеральный вещества, газы, коллоидные и крупнодисперсные частицы, а также различные микроорганизмы. Определение физических и органолептических свойств Внешний вид воды обусловливают ее физические свойства (запах, вкус, цвет, прозрачность, осадок, муть). Определение физических свойств воды имеет большое гигиеническое значение, так как наличие в воде постороннего запаха, привкуса, окраски может указывать на загрязнение воды посторонними веществами, кроме того, отталкивает потребителя, действуя на его эстетические чувства, даже если она безвредна. Характер и интенсивность запаха определяют органолептически. Характер запаха определяют по ощущению воспринимаемого запаха. Различают две группы запахов: -*■ запахи естественного происхождения Обусловлены живущими и отмирающими в воде микроорганизмами, влиянием берегов, дна, почв, грунтов. Так, присутствие в воде растительных остатков придает ей землистый, илистый, или болотный запах. Если вода цветет и в ней содержатся продукты жизнедеятельности актиномицетов, то она имеет ароматический запах. Наличие сероводорода придает воде запах тухлых яиц. При гниении органических веществ в воде или загрязнении ее нечистотами возникает гнилостный, сероводородный или фекальный запах. Обычно характер запаха воды описывается следующими терминами: ароматический (огуречный, цветочный); болотный (кислый, тинистый); гнилостный (фекальный, сточный); древесный, землистый, плесневелый, рыбный, сероводородный, травянистый, неопределенный. -*• запахи искусственного происхождения Возникают при загрязнении воды промышленными и сельскохозяйственными сточными водами. Их характер определяют по названию тех веществ, запах которых они представляют: фенольный, камфорный, аптечный, хлорный, металлический. Некарбонатную жесткость воды находят по разности: 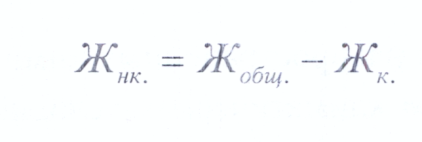 Таблица 4. Оценка воды по величине жесткости.
Опыт №3. Определение содержания примеси хлоридов Методика определения: в пробирку наливают 5 мл исследуемой воды, добавляют 3 капли 10% раствора нитрата серебра и взбалтывают. Таблица 5. Приближенное определение примеси хлоридов.
Сделайте вывод по итогам проделанной работы: оцените исследуемую пробу воды по запаху, показателю жесткости, по содержанию примеси хлоридов. Лабораторная работа №9 |
