Решение А) kh 2 po 4 2koh k 3 po 4 2H 2 o fэ(kh 2 po 4 ) , т к. замещаются 2 атома водорода, поэтому
 Скачать 45.13 Kb. Скачать 45.13 Kb.
|
|
Контрольная работа №1.ХИМИЯ 12. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнение реакций этих веществ с КОН и определите для этих веществ количество вещества эквивалентов и молярные массы эквивалентов, если массы веществ 32,45 г. Решение: А) KH2PO4 + 2KOH = K3PO4 + 2H2O fэ(KH2PO4) = ½, т.к. замещаются 2 атома водорода, поэтому Mэ(KH2PO4) = M(KH2PO4)* fэ(KH2PO4) = 136*(1/2) = 68 г/моль-экв. n(KH2PO4) = m/M = 32/68 = 0,47 моль Б) Bi(OH)2NO3 + KOH = Bi(OH)3 + KNO3 fэ(Bi(OH)2NO3) = 1/1, т.к. замещается 1 ион NO3- на 1 ион OH-, поэтому Mэ(Bi(OH)2NO3) = M(Bi(OH)2NO3)*fэ(Bi(OH)2NO3) = 305*(1/1) = 305 г/моль-экв. n(Bi(OH)2NO3) = m/M = 45/305 = 0,148 моль 29. Какой объем 0,1н раствора НCl потребуется на нейтрализацию раствора, содержащего 0,56 г КOH? Решение: KOH + HCl → KCl + H2O Масса раствора соляной кислоты X г (HCl) – 0,56 г (KOH) 36,46 г/моль (HCl) – 56,1056 г/моль (KOH) 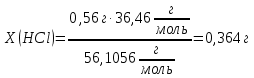 Объём раствора HCl 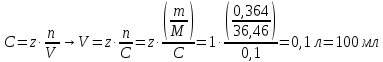 Где z – число эквивалентности; n – количество вещества, моль. Соответственно, потребуется 1 объём 0,1н раствора HCl на 10 объёмов KOH. 67. Напишите электронные формулы атомов элементов и назовите их, если значения квантовых чисел (n, l, ml, mS) электронов наружного (последнего) и предпоследнего электронных слоев следующие: а) 6, 0, 0, +1/2; 6,0,0,-1/2; 6,1,-1,+1/2. б) 3, 2, -2, + ½; 3,2,-1,+1/2; 4,0,0+-1/2. Решение: а) записаны 3 значения для 3 е-, для всех n = 6 → все на 6-м эн. уровне - элемент в 6 периоде. 6,0,0,+1/2 и 6,0,0,-1/2 → на 6 ур. 2 s электрона (6s2) 6,1,-1,+1/2 → на 6 ур. 1 р электрон (6р1) т.е. валентные электроны описываются формулой 6s2 6р1 → Tl таллий № 81 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p1 б) 3,2,-2,+1/2 и 3,2,-1,+1/2 → на 3 ур. 2 d электрона (3d2) (для 3d-электронов, гл. кв. число n=3, орбитальное кв. число l=2, магнитное кв. число может быть ml = +2, +1 , 0 , -1, -2, спиновое кв. число может быть ms=+½, -½) 4,0,0,+-1/2 → на 4 ур. 2 s электрона (4s2) (нет элемента с 3d2 4s1. +-1/2 скорее всего означает, что один электрон +1/2, другой -1/2 - всего 2 s-электрона) т.е. валентные электроны описываются формулой 3d2 4s2 → Ti титан №22 1s2 2s2 2p6 3s2 3p6 3d2 4s2 102. Как изменяются термическая устойчивость, растворимость в воде и основные свойства гидроксидов щелочных металлов в ряду LiOH→CsOH?
Все гидроксиды щелочных металлов – бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе, очень хорошо растворимы в воде и этаноле, при переходе от LiOH к CsOH растворимость увеличивается. Термическая устойчивость солей кислородных кислот (карбонатов, сульфатов, фосфатов) возрастает вниз по подгруппе, изменяясь симбатно росту радиуса и усилению степени ионности связи. В ряду LiOH-CsOH основные свойства увеличиваются (сила оснований возрастает). 105. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды? Ковалентная связь - химическая связь между двумя атомами, осуществляемая за счёт общей электронной пары. Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. С точки зрения МВС в молекуле воды кислород находится в sp3-гибридизации. По ру и рz гибридным орбиталям идёт образование ковалентной связи с s-орбиталями водорода, а s и рх орбитали, на которых находятся спаренные электроны также гибридны, но на них находятся по паре электронов. Из-за этого угол в молекуле не равен 109°28', а равен 104,5°. 122. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода? 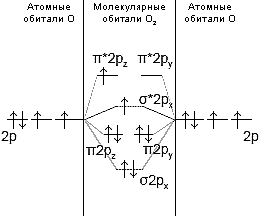 Из энергетической схемы образования молекулы О2 следует, что она парамагнитна, так как на *2px и *2py имеются неспаренные электроны. 147. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6(ж). Решение: Реакция горения бензола C6H6(ж) + 15/2O2(г) = 6CO2(г) + 3H2O(г) + 3135,58 кДж ∆Hх.р. = -Q = -3135,58 кДж ∆Hх.р. = 3 *∆H(H2O) + 6*∆H(CO2) - ∆H(C6H6) ∆H(C6H6) = 3*(-241,8) + 6*(-393,5) + 3135,58 = 49,18 кДж/моль Ответ: ∆H(C6H6) = 49,18 кДж/моль 172. Окисление аммиака протекает по уравнению 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж) -1528кДж. Определите ΔН298 NH3(г) и NH4OH(р), если теплота растворения NH3(г) в воде равна –34,65кДж. Решение: 4NH3(г) +3O2(г) =2N2(г) +6H2O(ж) +1528 кДж ∆Hх.р. = -Q = 1528 кДж ΔН°реакции = ΣΔН°ƒ продуктов – ΣΔН°ƒ исх. в-в. Ст. энтальпия образования жидкой воды ΔН°ƒ (6H2O(ж)) = – 285,9 кДж/моль, О2 и Н2 - простые вещества, для которых ΔН°ƒ=0. Отсюда: ΔН° реакции = 6ΔН°ƒ (6H2O(ж)) – 4ΔН°ƒ (NH3(г)) ΔН°ƒ (NH3(г)) = [6ΔН°ƒ (6H2O(ж)) - ΔН°реакции] / 4 = (– 285,9 ∙ 6 + 1528)/4 = – 46,85 кДж/моль Выражение для теплоты растворения: NH3(г) + H2O(ж) = NH4OH(р-р) ΔН°= –34,65 кДж/моль ΔН°реакции = ΔН°ƒ (NH4OH(р-р)) –ΔН°ƒ (NH3(г)) – ΔН°ƒ (6H2O(ж)) ΔН°ƒ (NH4OH(р-р)) = ΔН°реакции + ΔН°ƒ (NH3(г)) + ΔН°ƒ (6H2O(ж)) = –34,65–285,9-46,85= =–367,4 кДж/моль Ответ: ΔН°ƒ (NH3(г)) = – 46,85 кДж/моль, ΔН°ƒ (NH4OH(р-р)) = –367,4 кДж/моль. 203. Дана реакция СН4(г) + Н2О(г) = СО(г) + 3Н2(г) ΔН=-206 кДж. Как повлияют на эту реакцию: а) увеличение температуры; б) увеличение давления; в) разбавление компонентов реакции инертным газом? Решение: а) При понижении температуры химическое равновесия смещается в сторону продуктов реакции. При понижении температуры равновесие смещается в сторону экзотермической реакции. При понижении температуры скорость химической реакции уменьшается; б) При понижении давления химическое равновесие сместится в сторону большего объема, то есть в сторону продуктов реакции; в) В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ. 220. Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NН3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Решение: Константа равновесия определяется по уравнению: Кр = [NH3]2/[N2]*[H2]3 = 0,1 Отсюда, равновесная концентрация азота: [N2] = 0,082 / 0,23 *0,1 = 0,08 моль/л Из 1 моль азота образуется 2 моль аммиака, следовательно, на 0,08 моль/л аммиака было затрачено ½ концентрации азота, т.е. 0,04 моль/л азота. Исходная концентрация азота составит: 0,04 + 0,08 = 0,12 моль/л Ответ: 0,12 моль/л. |
