Контрольная работа по неорганической химии. Вариант 07rd. Решение Теплота образования это количество тепла, выделенное при образовании 1 моли вещества Fe s FeS
 Скачать 112.57 Kb. Скачать 112.57 Kb.
|
|
7. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Ответ: -100,26 кДж/моль Решение Теплота образования – это количество тепла, выделенное при образовании 1 моли вещества: Fe + S =FeS M(Fe)=55,8 г/моль; n=m/M=6,3/55,85= 0,1128 моль ∆Нобр. =- 11,31 кДж/ n = -11,31 кДж/0,1128 моль = - 100,26 22. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите ΔG0298 реакции, протекающей по уравнению NH3(г)+HCl(г)=NH4Cl(к) Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92.08 кДж. Решение Критерием направления протекания химической реакции является убыль энергии Гиббса ΔG. Энергия Гиббса является функцией состояния, поэтому ее изменение не зависит от пути процесса ΔG0т=ΔH0-T ΔS0 ΔH0х.р.= Σnкон ΔH0f кон – Σnисх ΔH0f исх.= ΔH0f(NH4Cl(к)) = -315.39 кДж/моль ΔH0f(HCl(г)) = -92.80 кДж/моль ΔH0f(NH3(г)) = -46.19 кДж/моль ΔH0х.р.= ΔH0f(NH4Cl(к)) - ΔH0f(HCl(г)) - ΔH0f(NH3(г)) = -315.39 + 92.80+ 46.19 = - 176,4 кДж. ΔS0х.р.= Σnкон S0кон – Σnисх S0исх. S0298f(NH4Cl(к)) = 94.56 Дж/моль*K S0298f(HCl(г)) = 186.70 Дж/моль*K S0298 (NH3(г)) = 192.50 Дж/моль*K ΔS0х.р = ΔS0f(NH4Cl(к)) - ΔS0f(HCl(г)) - ΔS0f(NH3(г)) = 94.56 - 186.70 -192.50 = - 284,64 Дж/моль*K Энергию Гиббса при стандартных условиях из соотношения ΔG0т=ΔH0-T ΔS0 =- 176,4 - 298*(- 284,64) *10-3=-92, 08 кДж.<0 Значение ΔG0298<0 указывает на возможность самопроизвольного протекания процесса, т.е. реакция протекает в прямом направлении Ответ: -92.08 кДж. 37. Как изменится скорость прямой реакции в системе 2SO2(г) + O2(г) 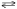 2SO3(г);, если концентрацию SO2 увеличить в 2 раза, а концентрацию О2 уменьшить в 2 раза? 2SO3(г);, если концентрацию SO2 увеличить в 2 раза, а концентрацию О2 уменьшить в 2 раза?Решение В соответствии с законом действия масс запишем выражения скорости прямой реакции: v=k*[SO2]2*[O2] Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении обьема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции: v1=k*(2[SO2])2*(1/2*[O2])=2* k*[SO2]2*[O2] Следовательно скорость прямой реакции возрастет в n = v1/v = 2* k*[SO2]2*[O2]/ k*[SO2]2*[O2] =2 67. Напишите выражение константы химического равновесия для реакции MgCO3(т) 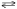 MgO(т) + CO2(г); ∆H0 < 0. MgO(т) + CO2(г); ∆H0 < 0.Какими способами можно сместить химическое равновесие этой реакции вправо? Решение Общее выражение для константы химического равновесия:: 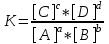 =к*[ MgO(т)]*[ CO2(г)]/[ MgCO3(т)] =к*[ MgO(т)]*[ CO2(г)]/[ MgCO3(т)] В гетерогенных реакциях концентрации чистых жидкостей и твердых веществ просто исключаются из выражений констант равновесия. (Однако они входят в нее неявным образом). До тех пор пока твердые карбонат магния и оксид магния находятся в контакте с газом, их влияние на равновесие не изменится. Следовательно, члены MgCO3(т) и MgO(т) в выражении для константы равновесия остаются постоянными и могут быть включены в K. При этом получается новое выражение: 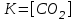 . .Химическое равновесие может сдвинуться в ту или иную сторону от изменения концентраций действующих веществ, температуры и давления. Чтобы сместить химическое равновесие данной реакции вправо (в сторону прямой реакции) по принципу Ле Шателье надо уменьшить давление или концентрацию углекислого газа и повысить температуру, так как реакция эндотермическая идет с поглощением тепла. ∆H0 =-393,5 -601,24+1096,2 = +101,3 кдж/моль>0 97. Напишите электронную формулу атома брома. Сколько электронов находится на последнем р-подуровне? К какому электронному семейству относится элемент? Решение Электронная формула атома брома: 1s22s22p63s23p63d104s24p5 на последнем р-подуровне у атома брома находится 5электронов  Бром относится к электронному семейству р-элементов Используя метод электронного баланса, расставьте коэффициенты в уравнениях окислительно-восстановительных реакций. Укажите окислитель и восстановитель 127. H2S + HNO2 = S + NO + H2O FeSO4 + HNO3 + H2SO4 = Fe2(SO4)3 + NO + H2O Решение H2S + HNO2 → S + NO + H2O Восстановитель 3|S-2-2е = S Окислитель 2|NO2-1 + 4Н++3е = NO + 2H2O 2 NO2-1 + 8Н++3 S-2= 2 NO + 4H2O +3 S 3H2S + 2 HNO2 = 3 S + 2 NO + 4 H2O FeSO4 + HNO3 + H2SO4 → Fe2(SO4)3 + NO + H2O Восстановитель 3| Fe+2 -е= Fe+3 Окислитель 1|NO2-1 + 4Н++3е = NO + 2H2O 2NO2-1 + 8Н++ 6 Fe+2 = 2NO + 4H2O + 6 Fe+3 9 SO4-2 9 SO4-2 6 FeSO4 + 2HNO3 + 3 H2SO4 = 3 Fe2(SO4)3 + 2 NO + 4 H2O Запишите в молекулярной и ионно-молекулярной формах уравнения реакций между веществами.
Решение Na2SiO3 + MgCl2 MgSiO3 ↓ + 2NaCl SiO3-2 + Mg+2 MgSiO3 ↓ Zn(OH)2 + KOH K2ZnO2 + H2O Zn(OH)2 + 2OH - ZnO2-2 + 2H2O Определите, какие из солей подвергаются гидролизу? Cоставьте ионно-молекулярные и молекулярные уравнения реакции гидролиза солей. Укажите реакцию среды. Какое значение рН имеют растворы этих солей?
Решение CsCl – соль сильного основания и сильной кислоты не подвергается гидролизу CuSO4 – соль слабого основания Cu(ОН)2 и сильной кислоты H2SO4. Гидролиз проходит по катиону с образованием слабого основания. При этом среда кислая CuSO4 + H2O = Cu(OH)2 + H2SO4 Cu+2 + H2O = Cu(OH)2 + 2H+ pH<0 Соль сильного основания KOH и слабой кислоты H2CO3 гидролизуется по аниону с образованием щелочи, среда щелочная: K2CO3 + H2O = KOH + KHCO3 CO3 -2 + H2O = OH- + HCO3 -1 pH>0 233. Сколько нужно взять AgNO3 на 500 мл раствора, чтобы его титр стал 0,0025 г/мл? Решение Т=а/500 =0,0025г/мл а=0,0025*500 = 1,2500 г Ответ: нужно взять 1,2500 г AgNO3 на 500 мл раствора 263. Вычислите температуру кипения 5%-ного раствора нафталина C10H8 в бензоле. Температура кипения бензола 80,2оС. Эбулиоскопическая константа его 2,57о. Решение По закону Рауля повышение температуры кипения (∆Т) по сравнению с температурами кипения растворителя выражаются уравнением 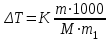 , , где K- эбуллиоскопическая константа. Температура кипения бензола 80,2оС. Эбулиоскопическая константа его 2,57о m и M(С10Н8)= 120+8=128 г/моль– масса вещества, m1– масса растворителя ∆Т=2,57*5*1000/128*95= 1,06 Т=80,2+1,06=81,26 оС Ответ: температуру кипения 5%-ного раствора нафталина C10H8 в бензоле 81.26оС 293. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и палладиевым электродами, погруженными в растворы их солей, если [Ni2+]=0,01 моль/л, а [Pd2+]=0,1 моль/л. Решение В данном гальваническом элементе катод - Pd |Pd2+, а анод - Ni|Ni2+ . Схема гальванического элемента: А (–) Ni2+ | Ni || Pd2+ | Pd (+) К Процессы на электродах: (–) А: Ni – 2e- = Ni2+; (+) K: Pd+ 2+ 2e- = Pd. По формуле Нернста рассчитываем значение электродного потенциала анода. E Ni2+ = E0 Ni/|Ni2+ + 0,059/2*lg[Ni+2] = –0,250+ 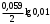 = –0,250 - 0,059 = 0,309 B = –0,250 - 0,059 = 0,309 BE Pd/Pd2+ = E0 Pd/Pd2+ + 0,059/2*lg[Pd+2] = + 0,990В -0,059/2 = +0,9605 B ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА ЭДС = 0,9605+0,309= 1,2695 В Ответ: ЭДС = 1,2695 В. 323. Электролиз раствора NaI (анод графитовый) проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу веществ, выделившихся на катоде и на аноде Решение На катоде из двух возможных процессов Na+ + e = Na0 (1) 2 H2O + 2 e = H2+2OH- (2) будет протекать тот, который имеет больший электродный потенциал. Стандартный электродный потенциал системы (1) равен -2,71В. Электродный потенциал системы (2) зависит от рН и в нейтральной среде имеет значение -0,41 В. На катоде будет происходить процесс с большим электродным потенциалом, т.е. электрохимическое восстановление воды. Для выбора анодного процесса следует сравнить электродные потенциалы систем 2I- - 2 e = I2 (3) 2H2O - 4e = O2 + 4H+ (4) Стандартный электродный потенциал системы (3) 0,54 В. Электродный потенциал окисления воды зависит от рН и в нейтральной среде составляет 0,82В. На аноде будет протекать процесс с меньшим значением электродного потенциала, т.е. окисление иодид-ионов. Складывая уравнения катодного и анодного процессов, получаем суммарное уравнение процесса электролиза: 2NaI + 2H2O = I2 + H2 + 2NaOH Массу выделившегося иода на аноде находим по уравнению закона Фарадея, имея в виду, что t=2,5ч=3600*2,5 = 9000 с и ЭI2=127 : mJ2=ЭJt/ F= 127*6*9000/96500=71,07 г. Объем водорода, выделившегося на катоде: V(Н2)=Vэ*I*t/F= 11,2*6*9000/96500 = 6,27 л 362 . Железное изделие покрыли хромом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Укажите продукты коррозии Решение
Электродные потенциалы: E0Fe/Fe2+ = -0,44 В E0Cr/Cr3+ = -0,74 В Поскольку E0Fe/Fe2+ > E0Cr/Cr3+ в образующейся гальванопаре хром будет выполнять роль анода, покрытие – катодное Коррозия во влажном воздухе: Катод: 2H2O + O2 + 4e → 4OH- Анод: Fe - 2e → Fe2+ Суммарный процесс: 2Fe + 2H2O + O2 → 2Fe(OH)2 Первичный продукт коррозии - гидроксид железа(II). Коррозия в растворе соляной кислоты: Катод: 2H+ + 2e → H2 Анод: Fe - 2e → Fe2+ Суммарный процесс: Fe + 2HCl → FeCl2+ H2↑ Первичный продукт коррозии - хлорид железа(II). 383. Как из карбида кальция и воды, применив реакцию Кучерова, получить уксусный альдегид, затем уксусную кислоты и винилацетат. Напишите уравнения соответствующих реакций. Составьте схему полимеризации винилацетата Решение Из карбида кальция и воды получаем ацетилен:  По реакции Кучерова получаем уксусный альдегид, затем уксусную кислоту  Затем из ацетилена и уксусной кислоты в кислой среде получаем винилацетат, который является мономером в реакции полимеризации. Катализатор – ацетат цинка, температура 170-220оС 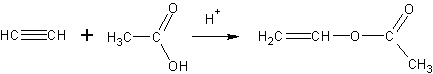 Полимеризация винилацетата приводит к получению полимера поливинилацетата: 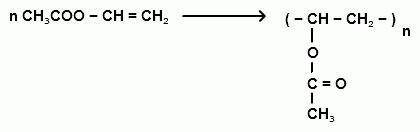 |
