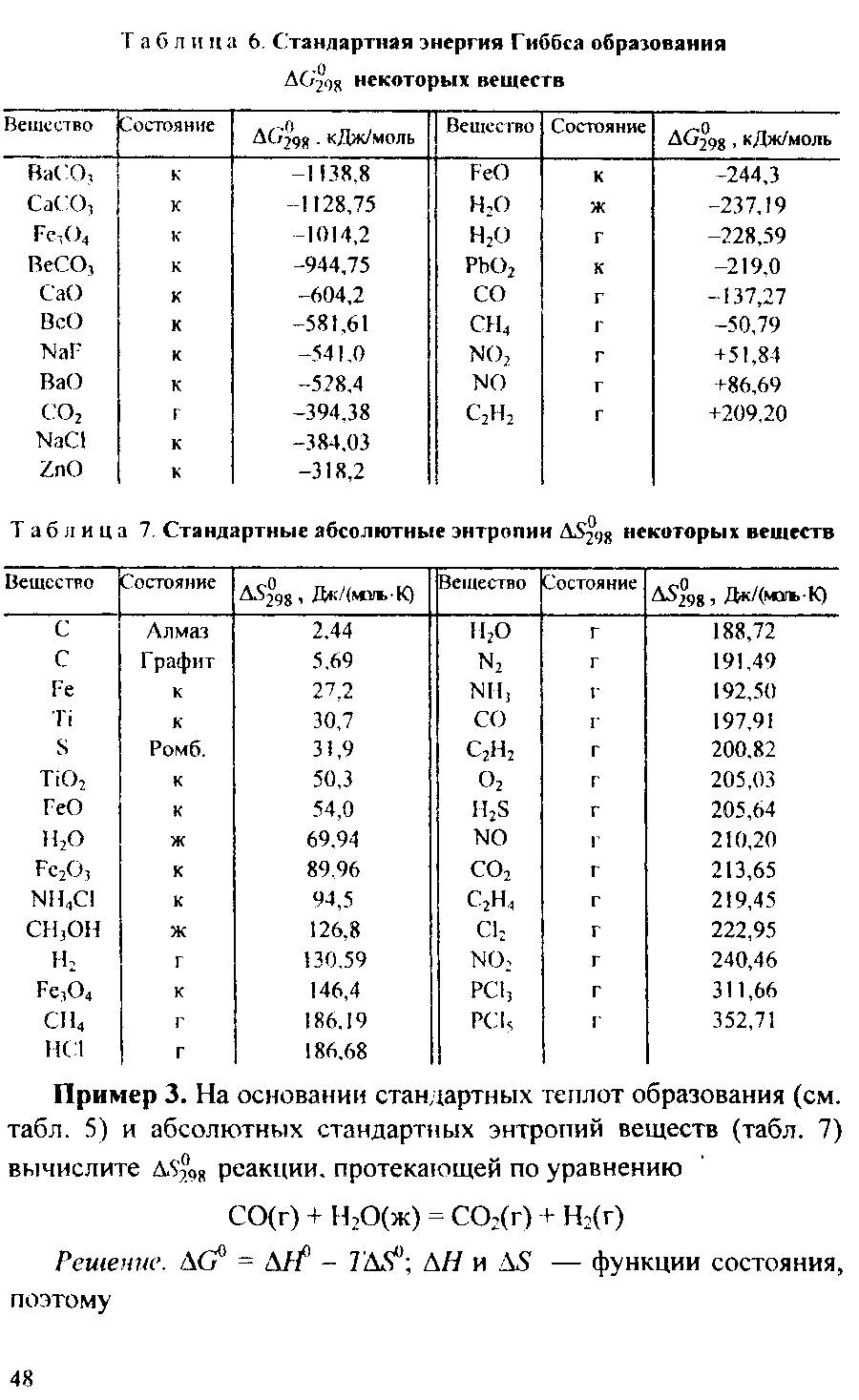
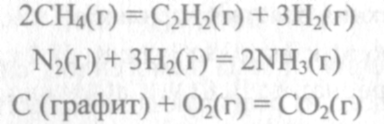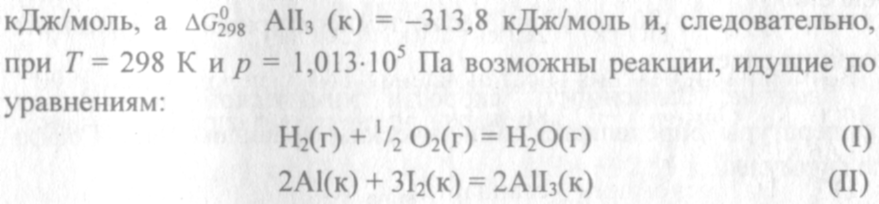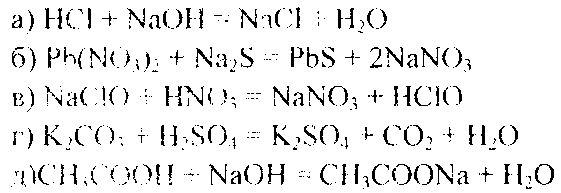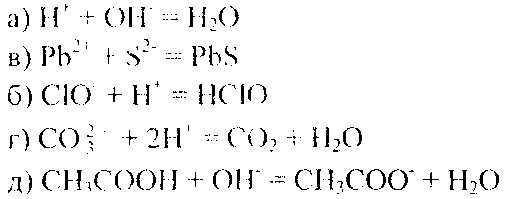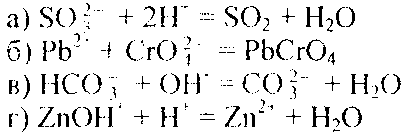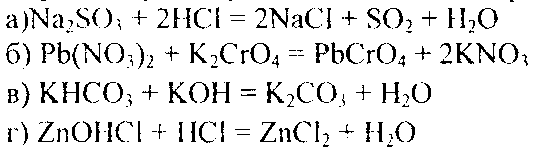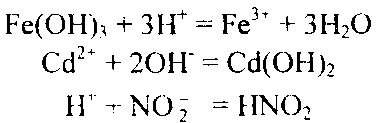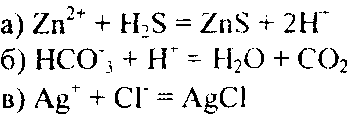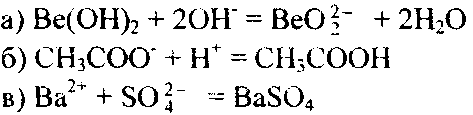Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомна-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
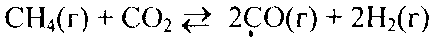
Р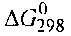 ешение. Вычислим ешение. Вычислим 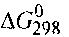 прямой реакции. Значения прямой реакции. Значения
соответствующих веществ приведены в табл. 6. Зная, что AG есть функция состояния и что ΔG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим 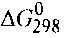 процесса процесса
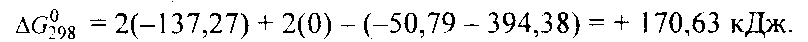
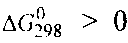
Т о, что, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном о, что, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном




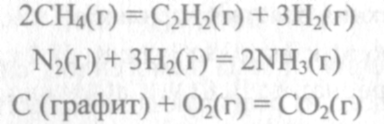
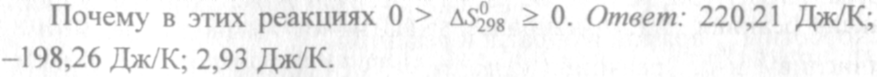
Химическая кинетика и равновесие
К инетика — учение о скорости различных процессов, в том инетика — учение о скорости различных процессов, в том
числе химических реакций. Критерием принципиальной осущест-
вимости реакций является неравенство
Н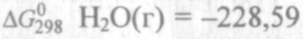 о это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, о это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так,
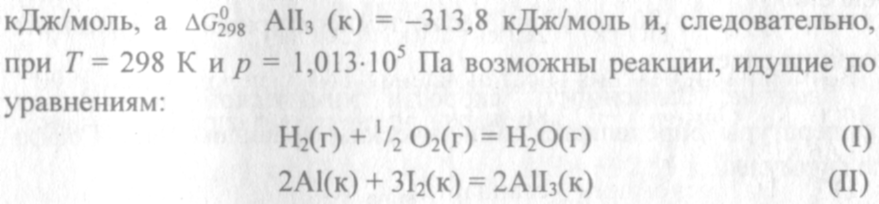
Однако эти реакции при стандартных условиях идут только в
присутствии катализатора (платина для первой и вода для второй).
Катализатор как бы снимает кинетический «тормоз» и проявляется
термодинамическая природа вещества. Скорость химических
реакций зависит от многих факторов, основные из которых —
концентрация (давление) реагентов, температура и действие
катализатора. Эти же факторы определяют и достижение равно-
весия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и
обратной реакции в системе
2S02(r) + 02(г) <± 2S03(r)
если объем газовой смеси уменьшится в три раза? В какую
сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ:
[S02] = а, [02] = b, [SO3] = с. Согласно закону действующих масс,
скорости прямой и обратной реакций до изменения объема равны








На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2S04? Чему равны молярная концентрация эквивалента и титр раствора H2S04? Ответ: 0,023 н.; 1,127- 10-3 г/см3.
Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Ответ: 26,6 см3.
На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты. Ответ: 0,5 н.
Какая масса HN03 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г; 0,016 г/см3.
Какую массу NaN03 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCI. Чему равна массовая доля полученного раствора: Ответ: 32,5%.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Из 700 г 60%-иой серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ: 16,7%.
Свойства растворов
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (ΔT) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением


Вычислите массовую долю (%) водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,39°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 6,45%.
Вычислите молярную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при
- 0,279 С. Крископическая константа воды 1,86 . Ответ: 60 г/моль.
Вычислите температуру кипения 5%-ного раствора нафталина C10H8 в бензоле. Температура кипения бензола 80,2°С. Эбуллиоскопическая константа его 2,57°. Ответ: 81,25°С.
Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465 С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 342 г/моль.
Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена C14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 С. Температура кристаллизации уксусной кислоты 16,65 С. Ответ: 3,9 .
При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81 . Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 2,57 . Ответ 8.
Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558°С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86 . Ответ: 442 г/моль.
Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбулиоскопическая константа этилового эфира 2,12°. Ответ: 1,16 г.
Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,86°, Ответ: 0,82°С.
Сколько граммов мочевины (NН4)CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86 . Ответ: 1,12 г.
Вычислите массовую долю (%) водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100/26 С. Эбулиоскопическая константа воды 0,52°. Ответ: 8,25%.
Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1°. Ответ: 3,91 г.
Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26°? Эбулиоскопическая константа воды 0,52°. Ответ: 7,5 г.
При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86 . Ответ: 92 г/моль.
Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбулиоскопическая константа воды 0,52°. Ответ: 101,52°С.
Вычислите массовую долю (%) водного раствора метанола СН3ОН, температура кристаллизации которого -2,79 С. Криоскопическая константа воды 1,86°. Ответ: 4,58%.
Ионно-молекулярные (ионные) реакции обмена
При решении задач этого раздела см. табл. 9 и табл. III приложения.
Ионно-молекулярные, или ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества, записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример 1. Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) НС1 и NaOH; б) Pb(N03)2 и Na2S; в) NaCIO и HN03; г) К2С03 и H2S04; д) СН3СООН и NaOH.
Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
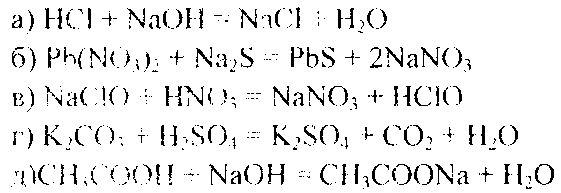
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (НЮ, НСЮ). осадка (PbS), газа (С02).
В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода — более слабый электролит; чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства: a) Nа+ и CI- ; б) Na+ и NO3- ; в) Na+ и NO3- ; г) К+ и SO42-; д) Na+, получим ионно-молекулярные уравнения этих реакций:
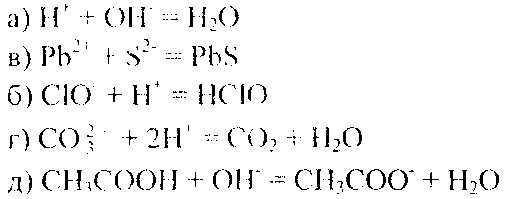
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
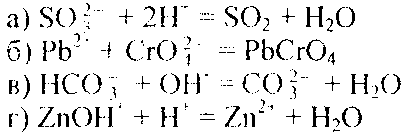
Решение. В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходит из соответствующих растворимых сильных электролитов. Например:
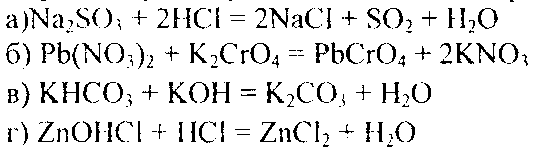
КОНТРОЛЬНЫЕ ВОПРОСЫ
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) NaHC03 и NaOH; б) K2Si03 и НС1; в) ВаС12 и Na2S04
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и НС1; б) FeS04 и (NH4)2S; в) Сг(ОН)3 и КОН.
Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Mg2+ + CO32- =MgC03
б) Н+ + ОН- = Н2О
Какие из веществ — Al(OH)3;H2S04; Ва(ОН)2 — взаимодействуют с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
Составьте молекулярные иионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНС03 и H2S04; б) Zn(OH)2 и NaOH:в) СаСl2 иAgN03.
Составьте молекулярные иионно молекулярные уравнения реакций взаимодействия врастворах между: a) CuS04 и H2S; б) ВаСО3 и HN03; в) FeCl3 и КОН.
187. Составьте по три молекулярных уравнения реакций,
которые выражаются ионно-молекулярными уравнениями:
а) Cu2+ + S2- = CuS
б) SiO32- + 2H+ = H2SiО3
188. Составьте молекулярные и ионно-молекулярные
уравнения реакций взаимодействия в растворах между: a) Sn(OH)2
и НС1; б) BeS04 и КОН; в) NH4CI и Ва(ОН)2:
Какие из веществ KHC03, СН3СООН, NiS04, Na2S — взаимодействуют с раствором серной кислоты? Напишите молекулярные и ионно-молекулярные уравнения этих реакций.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) AgN03 и К2СrО4; б) Pb(N03)2 и KI; в) CdS04 и Na2S.
Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями.
а) СаС03 + 2Н+ = Са2+ + Н20 + С02
б) А1(ОН)3 + ОН- = А102 +2Н20
в) РЬ2+ + 2I- = РЬI2
192.Составьте молекулярные и ионно-молекулярные
уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2
и NaOH; б) Си(ОН)2 и HN03; в) ZnOHN03 и HN03.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na3P04 и СаС12; б) К2С03 и ВаС12; в) Zn(OH)2 и КОН.
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
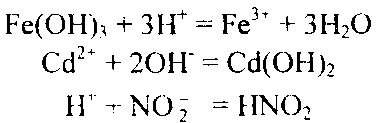
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и НС1; б) Сг(ОН)3 и NaOH: в) Ва(ОН)2 и СоС12.
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
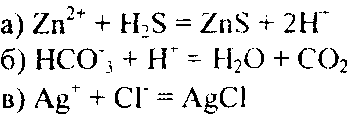
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2S04 и Ва(ОН)2; б) FeCl3 и NH4OH; в) CH3COONa и НС1.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) FeCl3 и КОН; б) NiS04 и (NH4)2S; в) MgC03 и HN03.
Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
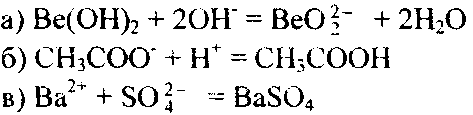
200. Какие из веществ — NaCl, NiS04, Ве(ОН)2, КНС03 —
взаимодействуют с раствором гидроксида натрия. Запишите
молекулярные и ионно-молекулярные уравнения этих реакций.
|
 Скачать 10.69 Mb.
Скачать 10.69 Mb.