|
Химия.Шиманович. Решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентовзаочников инженернотехнических (нехимических) специальностей вузов
ЛИТЕРАТУРА
Основная
Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии.— Л.: Химия, 1986.
Коровин H.B. Общая химия.— М.: Высшая школа, 1998.
Лабораторные работы по химии / Под ред. Н.В. Коровина.— М: Высшая школа, 1998.
Лучинский Г.П. Курс химии.— М: Высшая школа, 1985. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии.— М.: Высшая школа, 1990.
Угай Я.А. Общая и неорганическая химия. — М.: Высшая школа, 1997.
Дополнительная
Глинка Н.Л. Общая химия.—Л.: Химия, 1977-1987.
Глинка Н.Л. Задачи и упражнения по общей химии.— Л.: Химия, 1985.
Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии - М: Высшая школа, 1997.
Краткий справочник физико-химических величин / Под ред. А.А. Равделя, A.M. Пономаревой.— Л.: Химия, 1983.
Свойства неорганических соединений: Справочник / А.И. Ефимов и др./.— Л.: Химия, 1983.
Фролов В.В. Химия.—М.: Высшая школа, 1986.
Харин А.Н., Катаева И.А., Харина А.Т. Курс химии.— М.: Высшая школа, 1983.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Каждый студент выполняет вариант заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 98594, две последние цифры 94, им соответствует вариант контрольного задания 94.
КОНТРОЛЬНОЕ ЗАДАНИЕ № 1
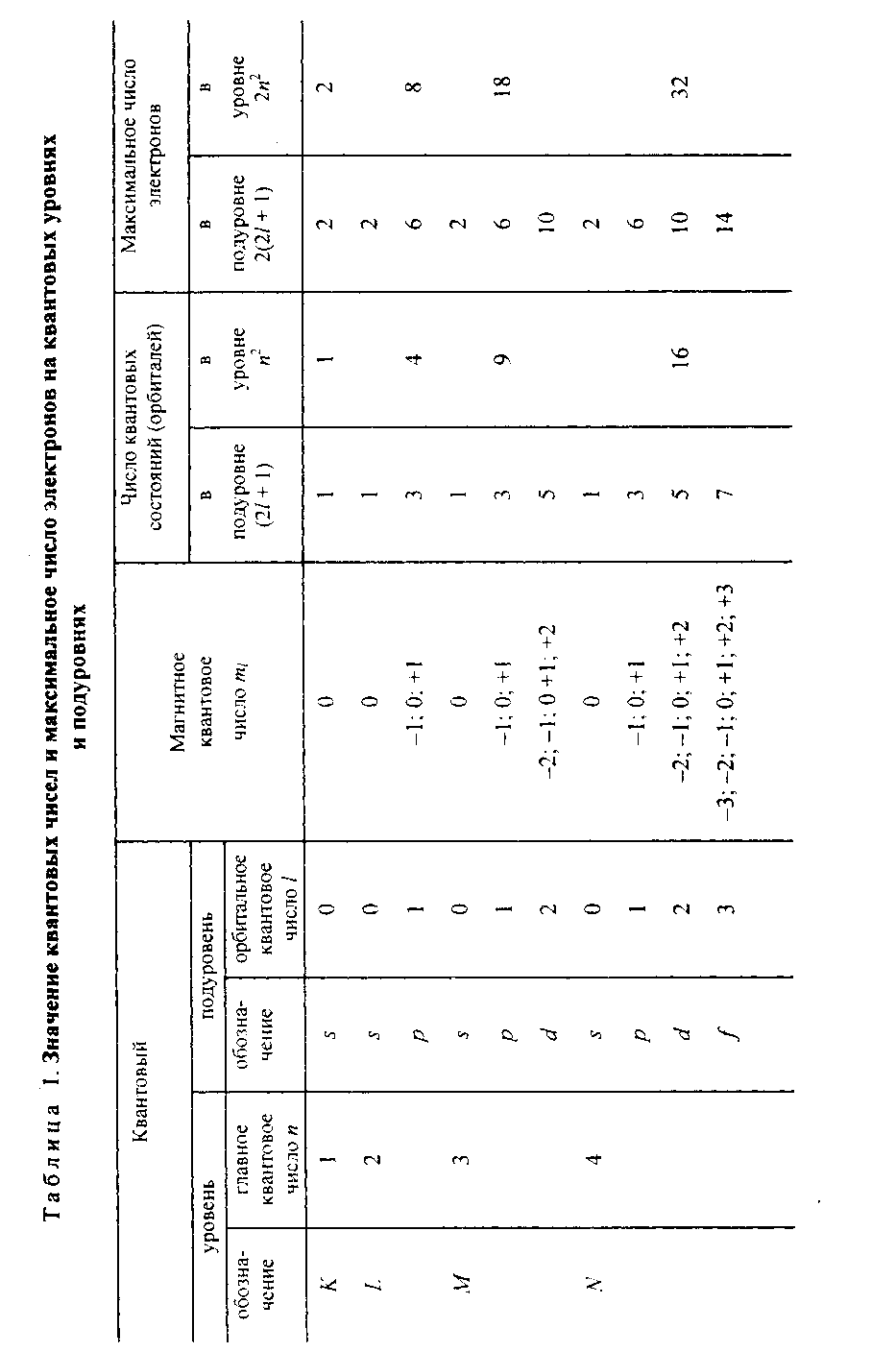
Моль. Количество вещества эквивалента (эквивалент) и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Закон эквивалентов
С 1 января 1963 г. в СССР введена Международная система единиц измерения (СИ), состоящая из шести основных единиц: метр (м) — длина, килограмм (кг) — масса, секунда (с) — время, ампер (А) — сила тока, кельвин (К) — термодинамическая температура, кандела (кд) — сила света. XIV Генеральная конференция по мерам и весам (1971) утвердила в качестве седьмой основной единицы Международной системы моль (моль) — единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде
12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц. Моль вещества соответствует постоянной Авогадро NA = (6,022045 ± 0,000031) 1023 моль-1 структурных элементов. При применении понятия «моль» следует указывать, какие структурные элементы имеются в виду, например, моль атомов Н, моль молекул Н2, моль протонов, моль электронов и т.п. Так, заряд моля электронов равен 6,022- 1023 ē и отвечает количеству электричества, равному 1 фараде (F). Масса моля атомов или масса моля молекул (молярная масса), выраженная в граммах (г/моль), есть грамм-атом данного элемента или




Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите молярную массу эквивалента, молярную и атомную массы этого элемента.
Чему равен при н.у. эквивалентный объем водорода? Вычислите молярную массу эквивалента металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32,68 г/моль.
Вычислите в молях: а) 6,02 • 1022 молекул С2Н2; б) 1,80 · 1024 атомов азота; в) 3,01 · 1023 молекул NH3. Какова молярная масса указанных веществ?
Вычислите количество вещества эквивалента и молярную массу эквивалента Н3Р04 в реакциях образования: а) гидрофосфата; б) дигидрофосфата: в) ортофосфата.
В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла?
Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.) Вычислите молярную массу эквивалента, молярную массу и относительную атомную массу этого металла.
Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла. Ответ: 103, 6 г/моль.
Напишите уравнение реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидрок-сожелеза; в) трихлорид железа. Вычислите количество вещества эквивалента и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций.
Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнение реакций этих веществ с КОН и определите количество вещества эквивалентов и молярные массы эквивалента.
14. В каком количестве Сг(ОН)3 содержится столько же
эквивалентов, сколько в 174,96 г Mg(OH)2? Ответ: 205,99 г.
15. Избытком хлороводородной (соляной) кислоты подейст-
вовали на растворы: а) гидрокарбоната кальция; б) дихлорида
гидроксоалюминия. Напишите уравнения реакций этих веществ с
НС1 и определите количество вещества эквивалентов и молярные
массы эквивалента.

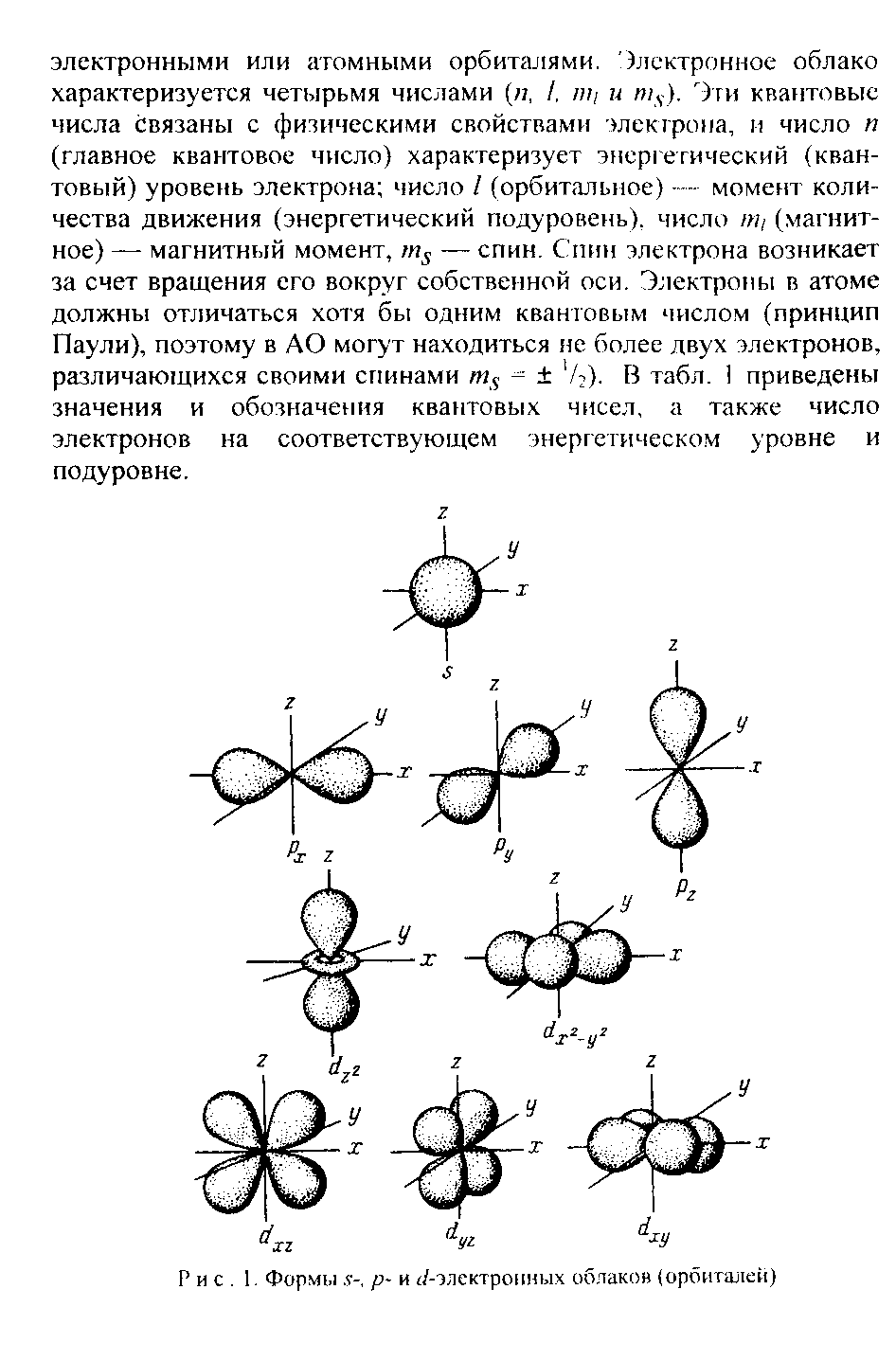
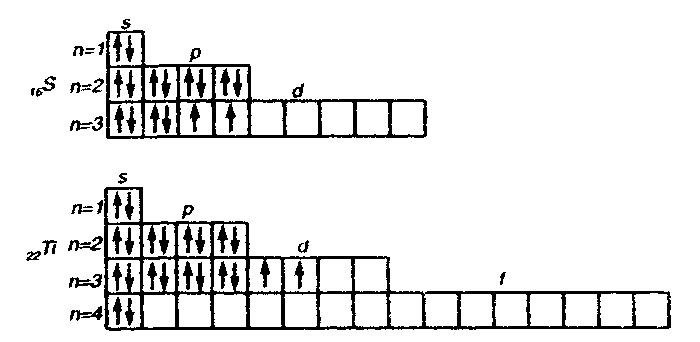
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlх, где n — главное квантовое число, l — орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение — s. р, d, f) х — число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией — меньшая сумма n+l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
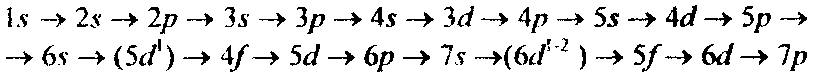
Так как число электронов в атоме элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 16 (сера) и № 22 (титан) электронные формы имеют вид:
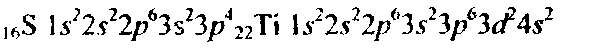
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольникам □ , кружка ○ или линейки — , а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух элементов с противоположными спинами:
В данном пособии применяют прямоугольники. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
Пример 3. Изотоп 101-го элемента — менделевия (256) был получен бомбардировкой α-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращение атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением
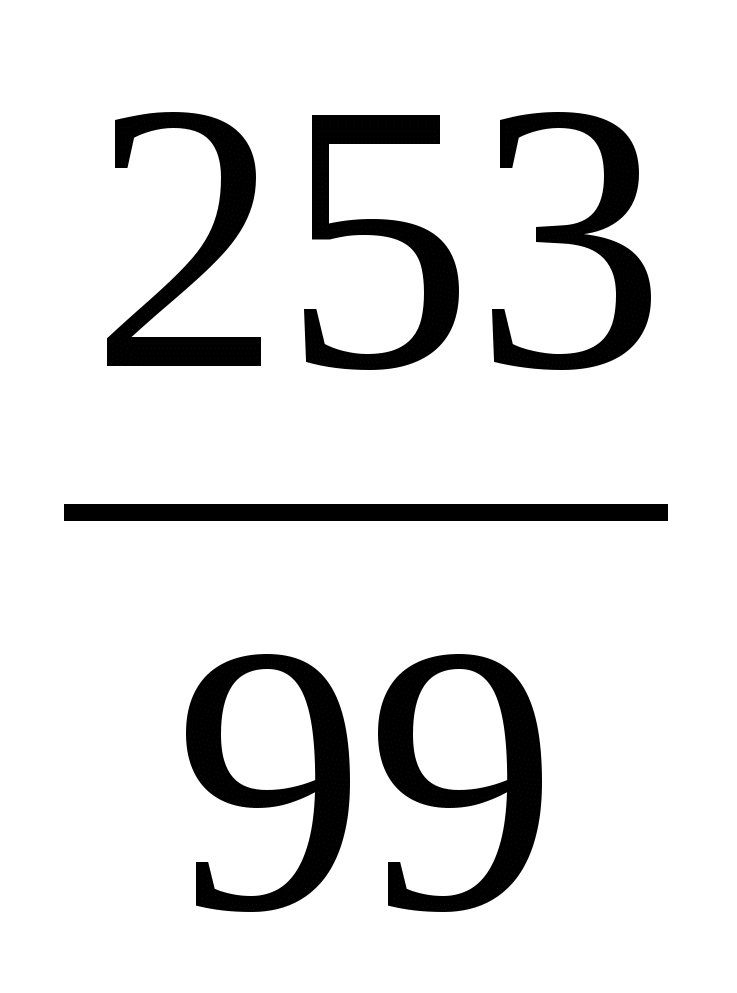 Es+ Es+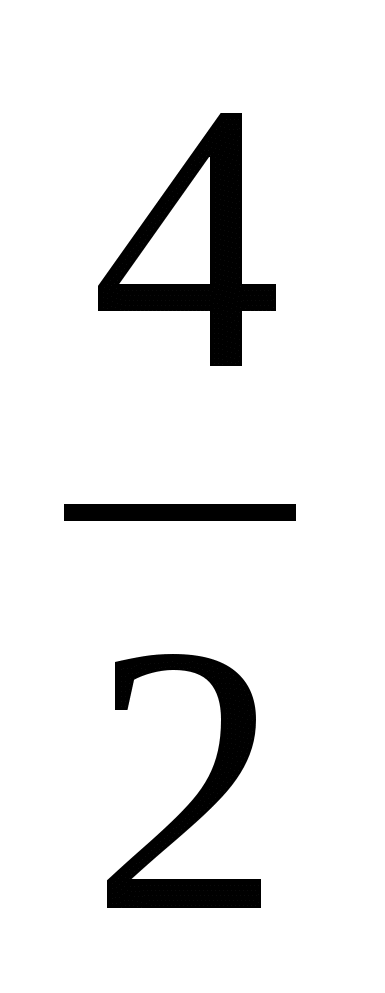 He= He=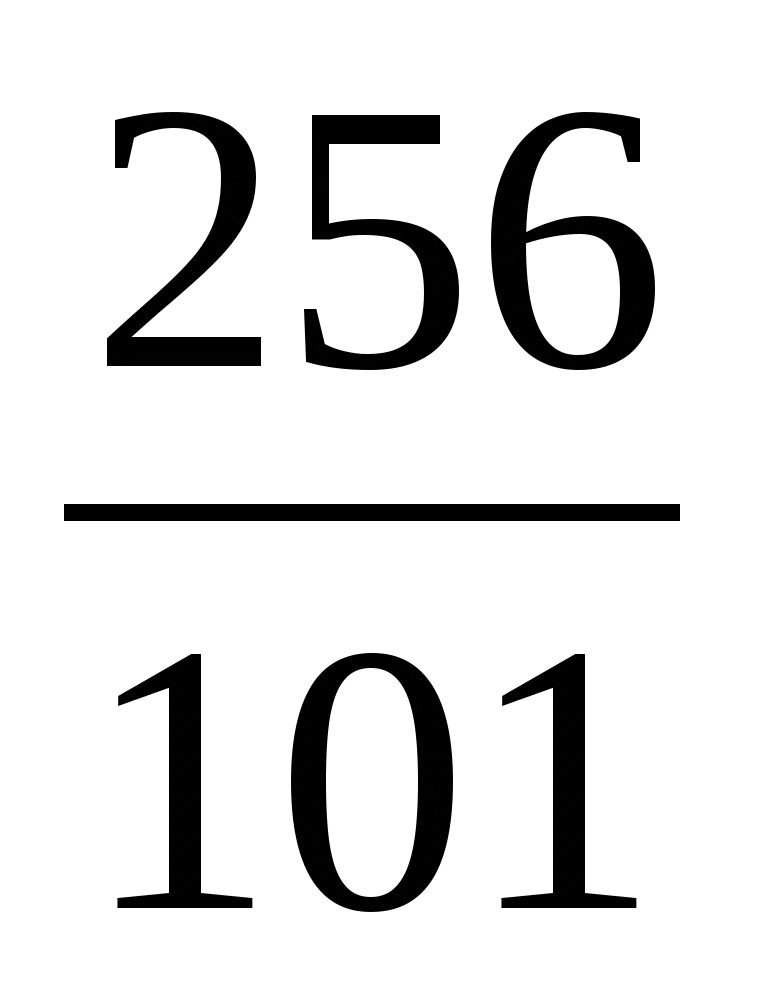 Md+ Md+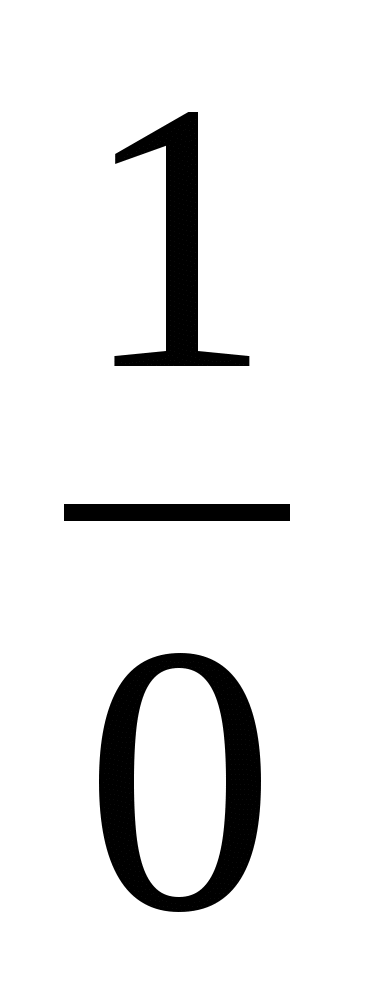 n n
Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид: 253Es (α, n) 256Md. В скобках пишут бомбардирующую частицу, а через запятую — частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы 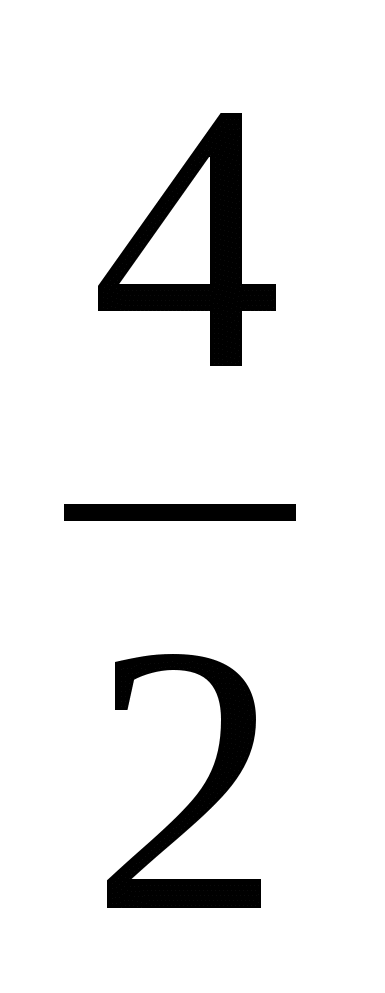 He; He;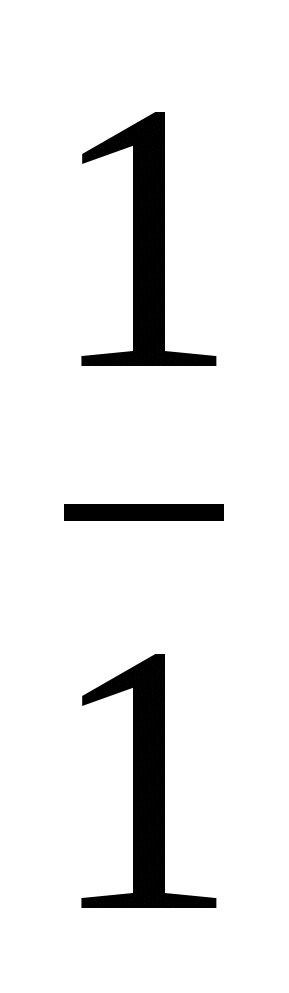 H; H;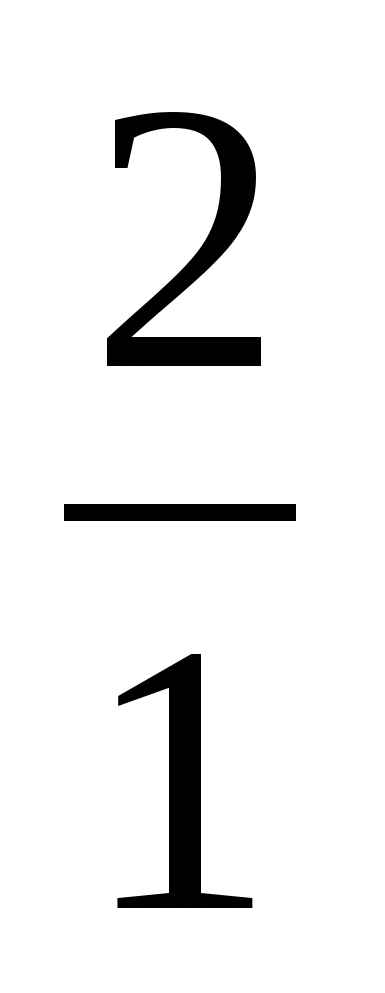 D; D; 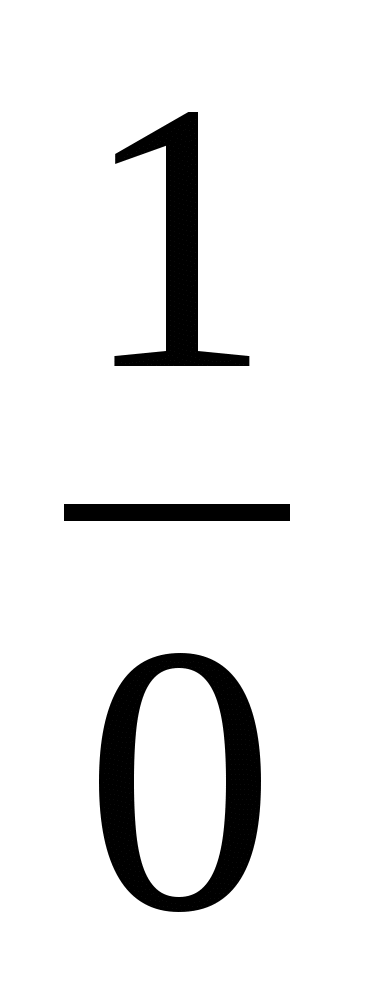 n обозначают соответственно α, р, d, n. n обозначают соответственно α, р, d, n.
Пример 4. Исходя из сокращенных уравнений ядерных реакций (табл. 2), напишите их полные уравнения.
Решение. Ответ на вопрос см. в табл. 2.

КОНТРОЛЬНЫЕ ВОПРОСЫ
Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение элементов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
Какое максимальное число электронов могут занимать s - р- d- иf- орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов?
Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5sили 4p? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
Изотоп никеля-57 образуется при бомбардировке α -частицами ядер атомов железа-54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Какие орбитали атома заполняются электронами раньше: 4dили 5s; 6sили 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы
выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
Изотоп кремния-30 образуется при бомбардировке α -частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных З d -орбиталей у атомов последнего элемента?
Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин
p-электронов у атомов первого и d -электронов у атомов второго элемента?
Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных З d -орбиталей в атомах этих элементов?
Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l= 0, 1, 2 и 3? Какие элементы в периодической системе называют s- р- d- и f-элементами? Приведите примеры.
Какие значения могут принимать квантовые числа п, l, тlи ms, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния?
Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а) 1S22S22р53 S1; б) 1S22S22p6в) 1S22S22p63s23p63d4; г) 1S22S22p63s23p64s2д) 1s22s22pb3s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит «провал» одного 4s-электрона на Зd-подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атомов второго элемента?
38. Квантовые числа для электронов внешнего энергетического
уровня атомов некоторых элементов имеют следующие значения:
n = 4; l = 0; ml = 0; ms: = ± 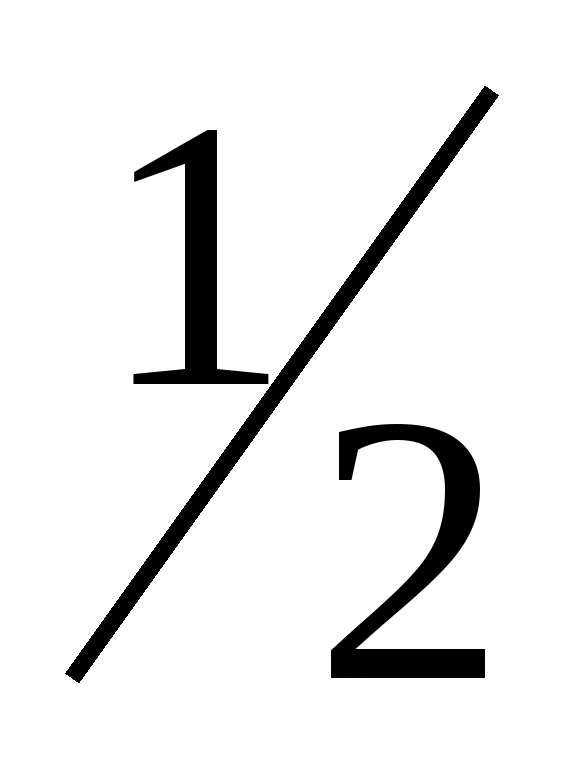 . Напишите электронные формулы атомов этих элементов и определите сколько свободных 3d-орбиталей содержит каждый из них. . Напишите электронные формулы атомов этих элементов и определите сколько свободных 3d-орбиталей содержит каждый из них.
В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из этих элементов?
Периодическая система элементов Д.И. Менделеева
Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2, nр6).

Данные элементы находятся соответственно в VA-, VIA-, VIIA-группах и имеют структуру внешнего энергетического уровня s2p3 s2p4 и s2p5- Ответ на вопрос см. в табл. 3.
Пример 2. У какого из элементов четвертого периода— марганца или брома — сильнее выражены металлические свойства?
Решение. Электронные формулы данных элементов
25Mn 1s22s22p63s23p63d54s2
35Br 1s22s22p6 3s23p6 3d10 4s2 4p5
Марганец — d-элемент VIIB- группы, а бром — p-элемент VIIA-труппы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома — семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d- элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
|
|
|
 Скачать 10.69 Mb.
Скачать 10.69 Mb.









